
- •Одесский национальный политехнический университет
- •7.110204 " Технология фармацевтических препаратов"
- •Часть первая теоретические основы химической технологии
- •Раздел 1. Понятие химическая технология и химического производство
- •Раздел 2. Основные закономерности химической технологии
- •Раздел 1
- •1.1. Определение технологии как науки. Механическая и химическая технология
- •Раздел 1
- •1.2. Содержание и структура курса
- •Раздел 1
- •1.3. Этапы развития химической технологии
- •1.4. Межотраслевой характер химической технологии
- •1.5. Основные понятия и определения химического производства
- •1.5. Основные понятия и определения химического производства
- •1.5.1. Компоненты химического производства
- •1.6. Иерархическое строение химического производства
- •1.7. Классификация химических производств
- •1.8. Показатели химического производства
- •1.8.1. Технологические показатели
- •1.8.2. Экономические показатели
- •1.8.3. Эксплуатационные показатели
- •1.8.4. Социальные показатели
- •1.9. Объемы производства основных продуктов
- •1.10. Методы химической технологии
- •1.10.1. Методические основы химической технологии как науки
- •1.10.2. Понятие о модели и моделировании
- •1,10.3. Математическое моделирование как метод изучения химических процессов и реакторов
- •1.10.4. Физическое моделирование. Место и значения эксперимента
- •1.10.5. Моделирование методом масштабного перехода на основании определенных частных соотношений (масштабирование)
- •1.10.6. Понятие о системе. Системный анализ как основной метод изучения химико-технологических систем
- •Раздел 2 основные закономерности химической технологии
- •2.1. Система процессов в химическом реакторе
- •2.1.1. Понятие о химико-технологический процессе
- •2.1.2. Классификация хтп
- •2.1.3. Главные показатели хтп
- •2.1.4. Взаимосвязь между показателями хтп
- •1.5. Равновесие химико-технологических процессов
- •2.2. Гомогенные химико-технологические процессы
- •2.2.1. Скорость гомогенных процессов
- •2.2.2. Влияние разных факторов на скорость гомогенного хтп
- •2.2.1.1. Влияние температуры
- •2.2.2,2. Влияние концентрации реагентов
- •2.2.2.3. Влияние давления
- •2.2.2,4. Влияние катализатора
- •2.3. Гетерогенные (некаталитические) химико-технологические процессы
- •2.3.2. Скорость гетерогенного хтп
- •2.3.3. Общие принципы интенсификации гетерогенных хтп
- •2.3.4. Гетерогенные некаталитические процессы в системе г-т
- •2.3. 4.1. Кинетические модели гетерогенных хтп в системе г-т
- •2.3.5. Гетерогенные некаталитические процессы в системах г-ж и ж-ж
- •2.3. 5.1. Кинетические модели процессов в системе г-ж (ж-ж)
- •2.4. Каталитические химико-технолоґические процессы
- •2.4.1. Использование катализаторов - наиболее эффективный способ повышения скорости и селективности химико-технолоґических процессов. Суть и виды катализа
- •2.4.2. Гомогенный катализ. Скорость превращения в гомогенном катализе. Влияние условий осуществления гомогенного катализа на его эффективность
- •2.4.4. Требования к промышленным катализаторов
- •1. Достаточно высокой активностью относительно реакции
- •2. Минимальной продолжительностью контактирования
- •3. Низкой температурой зажигания
- •4. Стойкостью к действию контактных ядов.
- •Доступностью и дешевизной.
- •2.4.5. Состав и изготовления твердых катализаторов
2.2. Гомогенные химико-технологические процессы
Гомогенными называются процессы, которые происходят в однородной среде - жидкости или газообразной смеси, в которой поверхность раздела между отдельными ее частями или компонентами отсутствуюет. Гомогенные процессы в промышленности встречаются довольно редко. В самом деле гомогенную систему получить тяжело. Любое вещество содержит следы разных примесей, которые находятся в другой фазе. Так, даже в 1 мл дистиллированной воды содержится от 20000 до 30000 частичек пыли.
В гомогенных процессах реакции происходят в объеме, как правило, значительно быстрее чем в гетерогенных. Осуществление и управление технологическими гомогенными процессами значительно проще и легче, поэтому многие промышленные гетерогенные процессы стараются перевести в гомогенные
В промышленности для реализации гомогенных химико-технологических процессов довольно часто осуществляют операции, которые предшествуют химическому взаимодействию, а именно: поглощение газов жидкостями или конденсацию паров, растворение или плавление твердых материалов. В обеих случаях получают жидкофазные системы. Вследствие выпаривания жидкостей или выделения из них в газовую фазу полезных компонентов получают гомогенные газофазные системы. Примером процесса, который реализуется как жидкофазный, может быть получение этанола: во время процесса сернокислотной гидратации этилена сначала серная кислота абсорбирует этилен, а уже потом гомогенно в жидкой фазе образуется этилсерная кислота, которая в дальнейшем гидролизуется с выделением целевого продукта - этанола:
63
![]()
Гомогенные процессы в газовой фазе широко используют в технологии неорганических и органических веществ, например, в производстве серной, азотной и соляной кислот, хлорирование и нитрирование органических соединений и т.п.. Для реализации гомогенного газофазового процесса в технологии органических веществ сконденсированное органическое соединение сначала испаряют, а потом в газовой фазе осуществляют его взаимодействие с определенным реагентом: хлором, оксидом серы (IV), кислородом (воздухом), оксидами азота и т.п..
Гомогенные жидкофазные процессы в промышленности используют значительно чаще. К гомогенным жидкофазным процессам принадлежат реакции нейтрализации и обмена в технологии минеральных солей, а в технологии органических веществ - получение простых и сложных эфиров, полимеризация в растворах и расплавах, щелочное плавление бензосульфокислот в производстве фенола, отдельные стадии сернокислотной гидратации этилена в производстве этилового спирта и прочие
В гомогенной среде (газо- и жидкофазной) много процессов происходит по цепному механизму: окиснение, полимеризация, пиролиз углеводородов, синтез хлористого водорода и т.п..
2.2.1. Скорость гомогенных процессов
Для обоснованного выбора оптимальных условий осуществления химико-технологического процесса нужно владеть информацией о скорости реакции в зависимости от ряда факторов, т.е. знать кинетику процесса. Химическая кинетика изучает закономерности хода термодинамически возможных реакций во времени и их механизм. Скорость химической реакции определяется изменением концентрации определенного компонента в реакционной системе за единицу времени в единице объема.
Гомогенные процессы преимущественно происходят в кинетической области, т.е. скорость процесса определяется скоростью химической реакции. Поэтому все закономерности, характерные для химической реакции, есть общими для всего жидкофазового или газофазного процесса. Скорость химических реакций в жидкой фазе, как правило, на несколько порядков выше, чем в газах (при той же температуре), но скорость диффузии в жидкостях значительно меньше, чем в газах из за их высокой вязкости. Так, коэффициент диффузии в газах составляет 0,1...1, а в жидкостях-
10-4…10-5см2/с.
64
В зависимости от механизма, все реакции разделяют по молекулярности на: мономолекулярные, бимолекулярные, тримолекулярные. Молекулярность реакции определяется количеством молекул, которые принимают участие в каждом элементарном акте реакции. Она не равняется сумме стехиометрических коэффициентов перед реагентами в уравнении реакции, а определяется изучением механизма.
К
мономолекулярным принадлежат реакции
внутримолекулярных перегруппировок
![]() (изомеризация,
инверсия и
т.п.)
и реакции разложения
(изомеризация,
инверсия и
т.п.)
и реакции разложения
![]() .
Примерами
мономолекулярных реакций является
плазмохимическая
диссоциация сероводорода; дегидратация
этанола,
разложение оксида
азота (V):
.
Примерами
мономолекулярных реакций является
плазмохимическая
диссоциация сероводорода; дегидратация
этанола,
разложение оксида
азота (V):
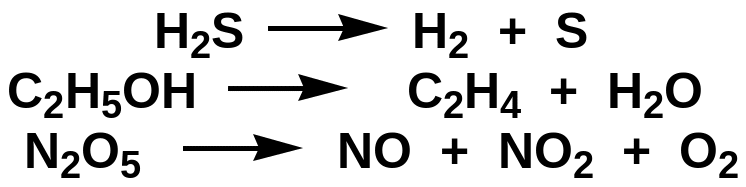
Бимолекулярные - это реакции в элементарном акте которых принимают участие две молекулы. Эти реакции встречаются чаще всего. К бимолекулярних принадлежат такие реакции:
-
присоединение:
![]() или
или
![]() ,
например,
,
например,
![]()
-разложение:
![]() , или
, или
![]() например,
например,
![]()
-замещения (обмена)
![]() или
или
![]()
напрмер,
![]()
Тримолекулярные реакции происходят вследствие взаимодействия между тремя молекулами. Такие реакции встречаются сравнительно редко, по обыкновению они происходят постадийно. К тримолекулярным реакциям принадлежат:
—
присоединение:
![]() ,
,
![]() ,
например,
,
например,
![]()
-обмена:
![]() ,
например,
,
например,
![]()
-
рекомбинации:
![]() .
.
Реакций большей молекулярности не бывает, поскольку вероятность одновременной встречи большего количества реагирующих молекул очень мала.
65
Согласно закону действующих масс - за постоянной температуры скорость химических реакций прямо пропорциональная концентрации реагирующих веществ - и для химической реакции
![]()
будет иметь такой вид:
![]() (2.47)
(2.47)
![]() (2.48)
(2.48)
![]() (2.49)
(2.49)
![]() (2.50)
(2.50)
где
![]() - скорости
рекцій
соответственно за веществами A,
B, R, S;
CA
,CB
,CR
,CS-
концентрации исходных
веществ и продуктов реакции; kA,
kB,
kR,
kS
-константы
скорости реакций по веществам,
соответственно А,
В,
R,
S.
- скорости
рекцій
соответственно за веществами A,
B, R, S;
CA
,CB
,CR
,CS-
концентрации исходных
веществ и продуктов реакции; kA,
kB,
kR,
kS
-константы
скорости реакций по веществам,
соответственно А,
В,
R,
S.
В вышеприведенных формулах концентрации веществ записываются в показателях степеней, которые отвечают стехиометрическим коэффициентам в уравнении этой реакции. Это справедливо для идеального случая. Для реальных процессов в большинстве случаев показатели степеней отличаются от стехиометрических коэффициентов и их определяют исключительно экспериментально. В связи с этим введено понятия - порядок реакции (n). Порядок реакции - это сумма показателей степеней при концентрациях реагирующих веществ в кинетическом уравнении реакции. Учитывая это, кинетические уравнения реакции будут иметь вид
![]() (2.51)
(2.51)
![]() (2.52)
(2.52)
![]() (2.53)
(2.53)
![]() (2.54)
(2.54)
где
![]() -
неизвестные
показатели степеней за концентраций
реагирующих веществ, соответственно
А,
В,
R,
S,
-
неизвестные
показатели степеней за концентраций
реагирующих веществ, соответственно
А,
В,
R,
S,
66
Сумма
![]() -
это порядок прямой реакции, а сумма
-
это порядок прямой реакции, а сумма
![]() - порядок обратимой
реакции.
- порядок обратимой
реакции.
Различают реакции нулевого, первого, второго, третьего и дробного порядков.
В реакциях нулевого порядка скорость не зависит от концентрации реаґента и равняется константе скорости.
![]() (2.55)
(2.55)
Скорость реакции первого порядка можно описать таким уравнением:
![]() (2.56)
(2.56)
или после интегрирования
![]() (2.57)
(2.57)
где СА,0 - начальная концентрация вещества А, кмоль/м3 ; СА,Х— уменьшение
концентрации вещества А (или же увеличение концентрации продуктов) за время реакции τ, кмоль/м3 ; к - константа скорости реакции, с-1, мин-1, ч-1; ω -скорость реакции, кмоль/ч м3.
Скорость реакции второго порядка опишется такими уравнениями:
![]() (2.58)
(2.58)
где СВХ - уменьшение концентрации реаґента В; к — константа скорости реакции,
кмоль-1·ч-1·м3
ипи
![]() (2.59)
(2.59)
Если исходные вещества реагируют в еквимолекулярных количествах (СА,0=СВ,0 ) то уравнение (2.58) приобретает вид
![]() (2.60)
(2.60)
67
или
![]() (2.61)
(2.61)
Скорость реакции третьего порядка, если С, —С, =С- будет иметь вид
![]() (2.62)
(2.62)
или
![]() (2.63)
(2.63)
Если концентрация одной из исходных веществ не равняется концентрациям двух других (С *СВ =СС ), то уравнение скорости этой
реакции будет иметь вид
![]() (2.64)
(2.64)
или
![]() (2.65)
(2.65)
Из уравнений (2.55 - 2.65) видно, что каждому типу реакций отвечает свое выражение для определения константы скорости.
Для технологических расчетов скорость реакции выгоднее виражат через степень превращения основных исходных реагентов хА. Тогда скорость реакции первого порядка запишется
![]() (2.66)
(2.66)
или после интегрирования
![]() (2.67)
(2.67)
Скорость реакции второго порядка запишется (для реаґентов, взятых в эквимолекулярных количествах)
![]() (2.68)
(2.68)
68
и соответственно
![]() (2.69)
(2.69)
Скорость реакции третьего порядка запишется (для реагентов, которые реагируют в еквімолярних количествах)
![]() (2.70)
(2.70)
На практике довольно часто встречаются реакции дробового порядка, в которых сумма показателей степеней в кинетическом уравнении не равняется целому числу. Преимущественно такими реакциями есть сложные багатостадійні или каталитические, отдельные стадии хода которых лимитируют скорость всего процесса. Например, скорость тримолекулярного процесса
![]()
описывается кинетическим уравнением
![]()
т.е. общий порядок прямой реакции равняется 1,8.
