
- •Раздел 1. Введение
- •Раздел 2. Равновесие сложных гетерогенных систем
- •Тема 1. Правило фаз Гиббса
- •§ 1 Основные определения
- •§ 2 Вывод правила фаз Гиббса
- •§ 3 Условная вариантность.
- •Тема 2. Однокомпонентные системы
- •§1. Общие положения
- •§2. Равновесие двух фаз однокомпонентной системы.
- •§3. Диаграммы состояния однокомпонентных систем
- •Тема 3. Двухкомпонентные системы
- •§1. Общие положения
- •§2. Диаграмма плавкости при неограниченной растворимости в жидком состоянии и полной нерастворимости в твердом
- •§3. Диаграмма плавкости бинарной системы с неограниченной растворимостью компонентов в жидком и твердом состояниях
- •§4. Диаграмма плавкости бинарной системы с устойчивым химическим соединением
- •§5. Диаграмма плавкости бинарной системы с химическим соединением, плавящимся инконгруэнтно
- •Тема 4. Трёхкомпонентные системы
- •§1. Общие положения
- •§2. Геометрические образы фазовых равновесий в тройных сплавах
- •§3. Диаграмма состояния с тройной эвтектикой (растворимость компонентов в твёрдом состоянии отсутствует)
- •3.1. Строение пространственной диаграммы
- •3.2. Кристаллизация типичных сплавов
- •3.3. Реальная диаграмма с тройной эвтектикой
- •3.4. Диаграмма плавкости системы CaO – SiO2 – Al2o3
Тема 3. Двухкомпонентные системы
§1. Общие положения
Для описания состояния двухкомпонентной системы (бинарной) необходимо указание уже трех переменных: обычно давление, температура и концентрация. Взаимосвязь трех переменных величин изображается с помощью трехмерной фигуры. Рассмотрим пример такой фигуры и геометрические образы фазовых равновесий для бинарной системы, компоненты которой в жидком состоянии образуют растворы во всей области концентрации, а в твердом состоянии вообще не растворяются один в другом.
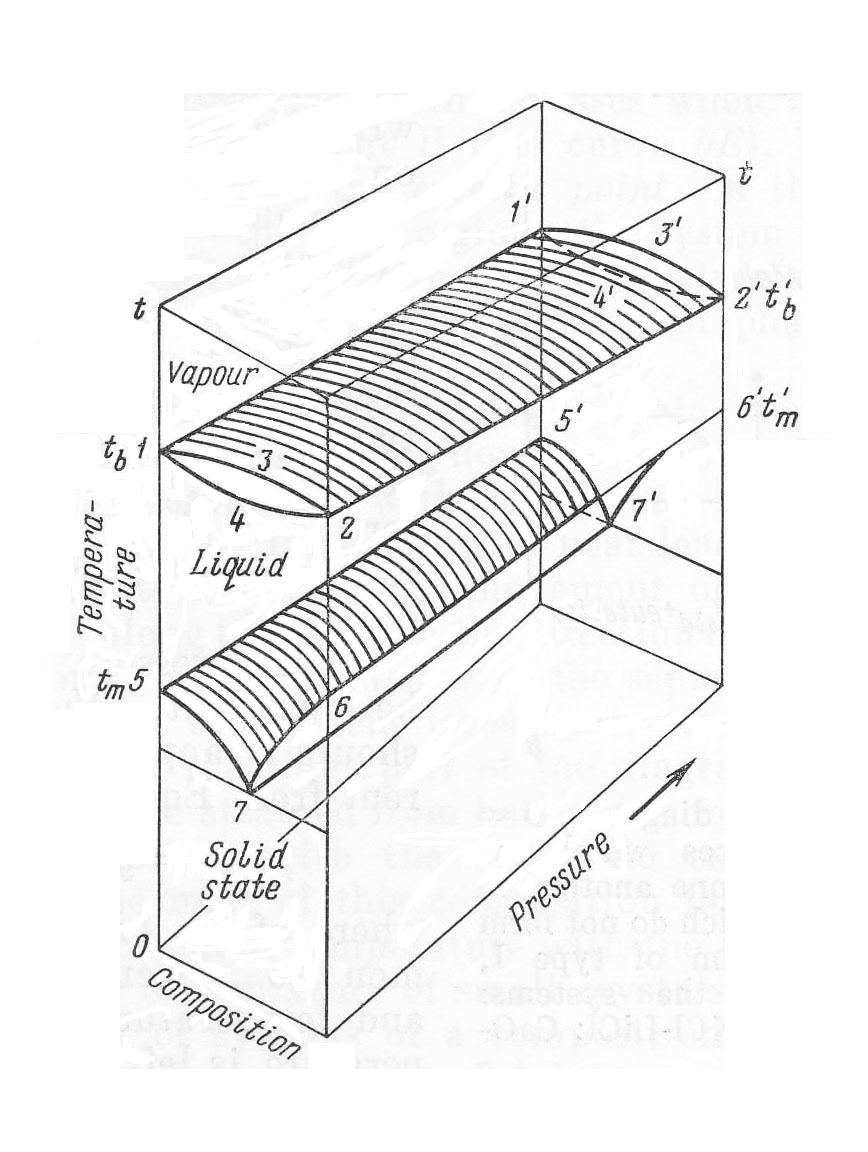
Диаграмма состояния бинарной системы с неограниченной растворимостью в жидком состоянии и полной нерастворимостью в твердом.
На рисунке изображены области трех агрегатных состояний:
I – область твердого состояния (Solid state); II – область жидкого состояния (Liquid); III – область пара (Vapour).
Применим правило фаз к любой из этих областей:
С = k + 2 – ƒ – r = 2 + 2 – 1 - 0 = 3,
т.е. произвольно можно изменять три параметра: температуру, давление и концентрацию. Точки, лежащие на линиях 111 и 221 соответствуют температурам кипения чистых компонентов при различных давлениях. Точки на линиях 551 и 661 – температуры плавления чистых компонентов в зависимости от давления.
На диаграмме можно различить ряд поверхностей.
Выпуклая поверхность 132113121 выражает зависимость температуры кипения жидких растворов от состава пара и давления.
Вогнутая поверхность 142114121 выражает зависимость температуры кипения от давления и состава жидкого раствора.
На поверхности 551771 жидкий расплав находится в равновесии с компонентом А.
На поверхности 676171 жидкий расплав находится в равновесии с компонентом В.
Число степеней свободы на поверхности:
С = 4 – ƒ = 4 – 2 = 2
На поверхности можно произвольно изменять только два параметра.
На линии 771 в равновесии находятся три фазы: жидкость, кристаллы компонента А и кристаллы компонента В.
Число степеней свободы на линии:
С = 4 – 3 = 1
Произвольно можем менять только один параметр. Два других будут являться функцией третьего.
Поскольку в интервале давлений 0÷100атм. термодинамические свойства конденсированных фаз можно считать постоянными, то обычно рассматривают не объемную диаграмму равновесия между жидкостью и твердыми фазами, а ее сечения при постоянном давлении, обычно при Р=1атм. Такие диаграммы получили название «диаграммы плавкости».
§2. Диаграмма плавкости при неограниченной растворимости в жидком состоянии и полной нерастворимости в твердом
Диаграмма плавкости для рассматриваемого примера будет иметь следующий вид:
Р = const
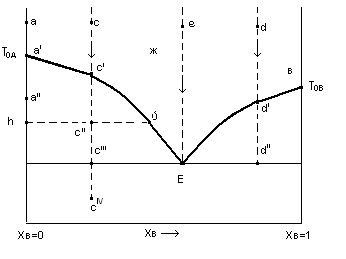
Обсудим более подробно эту диаграмму. Начнем с точки а, соответствующей чистому компоненту А в жидком состоянии. Здесь система условно обладает одной степенью свободы.
Сусл. = k+ 1 – ƒ = 2 – 1 = 1
При отводе теплоты от системы жидкость охлаждается и фигуративная точка на диаграмме перемещается вниз до точка а′, в которой начнется кристаллизация жидкого компонента А при постоянной температуре ТОА.

Сусл. = 2 – ƒ = 2 – 2 = 0 Сусл. = 2 – ƒ = 2 – 1 = 1
После этого потеря теплоты будет связана с понижением температуры и фигуративная точка системы движется в направлении а″, что означает охлаждение уже твердого А.
Изобразим процесс охлаждения в координатах температура – время.

Если к жидкому компоненту А добавить растворимый в нем компонент В, то температура начала кристаллизации компонента А из расплава (А-B)ж будет ниже температуры кристаллизации чистого А. Это является следствием из закона Рауля, который будет рассматривается в разделе «Растворы» учебной дисциплины «Физическая химия». Кривая а′Е отражает это понижение. Равным образом понижается температура начала кристаллизации и в том случае, если к жидкому компоненту В добавлять компонент А (кривая вЕ). Обе кривые пересекаются в точке Е, называемой эвтектической.
В области над кривыми – в области расплава – система имеет условно две степени свободы:
Сусл. = k + 1 – ƒ = 2 + 1 – 1 = 2,
т.е. здесь произвольно можно изменять и температуру и состав, а число фаз (одна) будет оставаться постоянным. Линия аЕв – линия ликвидуса. Возьмем в области реализации жидкого состояния фигуративную точку с и рассмотрим последовательность превращений в системе при движении ее вниз.

Сусл. = 2 + 1– 1 = 2
При отводе теплоты такой системы достигается состояние с′, где расплав насыщен компонентом А и он начинает выделяться в чистом виде.
Сусл. = к + 1 – ƒ = 3 – ƒ = 3 – 2 = 1
Т = ƒ(Х1) и Х = ƒ(Т) связаны уравнением Шредера.
Система становится моновариантной и при дальнейшем отводе теплоты понижение температуры сопровождается дальнейшей кристаллизацией компонента А и одновременно изменением состава остающегося раствора по линии с′Е в направлении точки Е. При этом фигуративной точке всей системы отвечают две фигуративные точки каждой из фаз, например, точке с″ отвечают точки h и ύ. Фигуративная точка твердой фазы опускается по вертикали. Фигуративная точка расплава перемещается по кривой с′Е. Точки
h и ύ называются сопряженными, а линия h с″ ύ – коннодой. Существует правило, которое носит название «правило рычага»: фигуративная точка всей системы делит проходящую через нее конноду на отрезки, обратно пропорциональные массам фаз, на которые распадается равновесная система, т.е. для фигуративной точки с″:
![]()
Вариантность в точке с″ такая же, как и в точке с′: Сусл =3–ƒ = 3–2 = 1.
Аналогичные явления, только связанные с выделением компонента В происходят при отводе от системы теплоты для точек в правой части диаграммы (например d). Когда фигуративная точка системы достигает положения с′″, фигуративная точка жидкости попадает в Е. В эвтектической точке Е, которая может быть достигнута с обеих сторон, расплав состава Е может находиться в равновесии с обоими твердыми компонентами А и В.

Сусл =3–ƒ = 3–3 = 0
При постоянной температуре смесь мелких кристаллов компонентов А и В начинает выпадать одновременно, образуя твердую эвтектику.
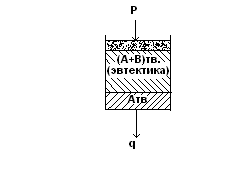
Эвтектика не представляет собой самостоятельную фазу. Фазы здесь две: Атв и Втв.
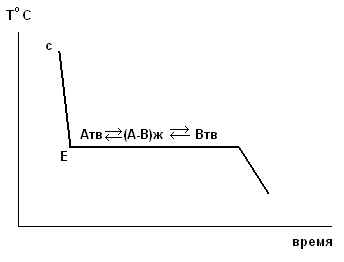
На графике в координатах температура – время процесс кристаллизации сплава выглядит следующим образом:

Принципиальное отличие в механизме кристаллизации сплава по сравнению с чистым веществом заключается в том, что сплав кристаллизуется в интервале температур с′ - с′′′). Температура Тс′ - температура начала кристаллизации сплава.
Существует единственный сплав, который будет кристаллизоваться как чистое индивидуальное вещество. Его состав отвечает составу эвтектики.
При рассмотрении процессов в двухкомпонентной системе (при кристаллизации) возникает вопрос: почему не вводим ограничение
x = const, когда фигуративная точка движется вниз? Поскольку в однокомпонентной системе вводилось ограничение: Р = const или
Т = const при движении фигуративной точки вправо или вниз. Ответ, по-видимому, должен быть таким: в однокомпонентных системах, принимая постоянство давления и ограничивая число степеней свободы, мы беремся такое постоянство поддерживать (например, используем цилиндр с поршнем, имеющим постоянное давление). В случае двухкомпонентной системы мы не ставим задачу поддерживать х = const и не принимаем для этого никаких мер. В самом деле: состав жидкой фазы при понижении температуры будет изменяться по уравнению Шредера.
