- •Раздел 1. Введение
- •Раздел 2. Равновесие сложных гетерогенных систем
- •Тема 1. Правило фаз Гиббса
- •§ 1 Основные определения
- •§ 2 Вывод правила фаз Гиббса
- •§ 3 Условная вариантность.
- •Тема 2. Однокомпонентные системы
- •§1. Общие положения
- •§2. Равновесие двух фаз однокомпонентной системы.
- •§3. Диаграммы состояния однокомпонентных систем
- •Тема 3. Двухкомпонентные системы
- •§1. Общие положения
- •§2. Диаграмма плавкости при неограниченной растворимости в жидком состоянии и полной нерастворимости в твердом
- •§3. Диаграмма плавкости бинарной системы с неограниченной растворимостью компонентов в жидком и твердом состояниях
- •§4. Диаграмма плавкости бинарной системы с устойчивым химическим соединением
- •§5. Диаграмма плавкости бинарной системы с химическим соединением, плавящимся инконгруэнтно
- •Тема 4. Трёхкомпонентные системы
- •§1. Общие положения
- •§2. Геометрические образы фазовых равновесий в тройных сплавах
- •§3. Диаграмма состояния с тройной эвтектикой (растворимость компонентов в твёрдом состоянии отсутствует)
- •3.1. Строение пространственной диаграммы
- •3.2. Кристаллизация типичных сплавов
- •3.3. Реальная диаграмма с тройной эвтектикой
- •3.4. Диаграмма плавкости системы CaO – SiO2 – Al2o3
§ 3 Условная вариантность.
Вариантность системы при условии постоянства некоторого числа переменных или соотношений между переменными называется условной. Сусл. – условная вариантность. Общее число переменных:
t = k∙ƒ + 2.
Наиболее часто накладываемое условие на систему – постоянство давления. Оно оправдано при рассмотрении равновесий между конденсированными фазами, термодинамические свойства которых, как мы знаем, слабо от него зависят. В этом случае:
t = k∙ƒ + 1, и
Сусл = k + 1 – ƒ – r. (15)
Если ограничение
для системы будет такое:
 ,
,
то t = k∙ƒ и
Сусл = k – ƒ – r. (16)
В общем случае, если на систему накладывается l ограничений, то правило фаз принимает вид:
Сусл = k + 2 – ƒ – r – 1. (17)
В количественном соотношении всегда
Сусл < С. (18)
Тема 2. Однокомпонентные системы
§1. Общие положения
Равновесие однокомпонентной системы определяется только внешними параметрами Р и Т, поскольку внутренних - нет.
Если система однокомпонентная, то число химических реакций r = 0. Тогда:
С = k + 2 – ƒ – r = 3 – ƒ. (19)
Отсюда следует зависимость вариантности от числа фаз, находящихся в равновесии. Чем больше число фаз в равновесии, тем меньше вариантность. Установим наибольшую и наименьшую вариантность.
Наибольшая вариантность:
Снаиб = 3 – 1 = 2.
Наибольшей вариантности соответствует наименьшее число фаз, находящихся в равновесии – 1.
Наименьшая вариантность:
Снаим = 3 – 3 = 0.
Наименьшей вариантности отвечает наибольшее число фаз, находящихся в равновесии – 3. То есть в любой однокомпонентной системе не может одновременно находиться в состоянии равновесия более 3 – х фаз.
§2. Равновесие двух фаз однокомпонентной системы.
Уравнение Клапейрона – Клаузиуса
Подставим в правило фаз Гиббса для однокомпонентной системы ƒ = 2. Тогда: С = 3 - ƒ = 1. Это означает, что при равновесии двух фаз в однокомпонентной системе только один из внешних параметров может принимать произвольные значения, а другой должен быть при этом строго определённым, иначе равновесие материализоваться не будет (в ограниченном интервале температур и давлений возможны метастабильные состояния). То есть: Р = ƒ(T) или Т = ƒ(Р). В явном виде обсуждаемая зависимость известна как уравнение Клапейрона – Клаузиуса:
![]() ,
(20)
,
(20)
где ∆H – молярное изменение энтальпии при переходе от одной сосуществующей фазы к другой, кДж/моль; (V2 – V1) – изменение молярных объёмов при переходе от одной сосуществующей фазы к другой л/моль.
§3. Диаграммы состояния однокомпонентных систем
Диаграмма состояния – это график в определённых координатах, на котором изображены возможные состояния многофазной и многокомпонентной системы. Точка, отвечающая состоянию системы на этой диаграмме, называется фигуративной. С одной из диаграмм состояния – диаграммой состояния воды, мы уже знакомы. Сейчас посмотрим на нее в несколько ином плане.
Диаграмма состояния воды.

Диаграмма состояния однокомпонентной системы изображается в координатах Р и Т.
Точка «О», отвечающая равновесию трех фаз на диаграмме, называется «тройной точкой». Для нее:
С = 3 – ƒ = 3 – 3 = 0.
Поэтому она характеризуется вполне определенными значениями температуры и давления (Т = 273,16К, Р = 0,006атм.).
Линия АО – линия равновесных состояний двухфазной системы
лед пар
С = 3 – 2 = 1.
Линия АО начинается, как можно считать, при абсолютном нуле.
Линия ОВ – линия равновесных состояний двухфазной системы
жидкость пар
С = 3 – 2 = 1.
Точка В имеет координаты: T = 3740С; P = 220атм).
Линия ОС – линия равновесных состояний двухфазной системы
тв. вещество жидкость
С = 3 – 2 = 1.
Поле I - область равновесного состояния льда
С = 3 – 1 = 2.
Поле II - область равновесного состояния жидкой воды
С = 3 – 1 = 2.
Поле III - область равновесного состояния пара
С = 3 – 1 = 2.
Рассмотрим последовательность превращений в системе при движении фигуративной точки по горизонтальной прямой от положения x до положения y.
В точке х при давлении 1 атм и температуре Т1 устойчив лед.
Подсчитаем вариантность в этой точке. Поскольку на систему накладывается ограничение Р = 1атм, то вариантность будет условной:
Сусл = 2 – ƒ = 1,
т. е. произвольно можно изменять один параметр – температуру.
Продвижение по горизонтали вправо означает нагревание льда, продолжающееся до точки n. Здесь происходит фазовый переход
л
 ед
вода, появляется новая фаза и условная
вариантность
ед
вода, появляется новая фаза и условная
вариантность
Сусл = 2 – 2 = 0
Следовательно, температура будет оставаться постоянной, пока лед полностью не расплавится и система снова не станет однофазной. После чего температуру теперь уже жидкой воды снова можно повышать до точки m. В точке m вода закипит при 1000С, и эта температура будет оставаться постоянной, пока вся вода не превратится в пар, который дальше будет нагреваться до температуры Т2. Сусл = 2 – 2 = 0
Нагреваться от точки m до y будет уже пар.
Путь системы от состояния, отмеченного фигуративной точкой х до состояния, отмеченного фигуративной точкой у можно изобразить на графике температура-время:
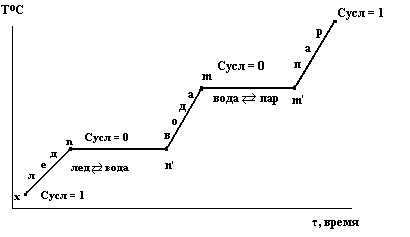
Полностью плавление индивидуального вещества происходит при постоянной температуре.
Диаграмма состояния железа
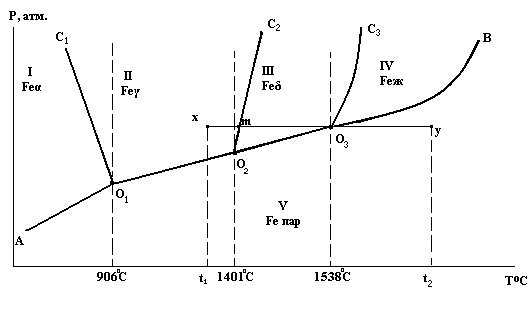
Feα - объемноцентрированный куб (ОЦК).
Feγ - гранецентрированный куб (ГЦК).
Feδ - объемноцентрированный куб (ОЦК).
О1, О2, О3 – тройные точки на диаграмме, здесь в равновесии находятся три фазы:
О 1
- Feα
Feγ
Feпар
1
- Feα
Feγ
Feпар
О2 - Feγ Feδ Feпар С = 0
О3 - Feδ Feж Feпар
Параметры Р и Т имеют строго определенное значение.
Линии ни диаграмме отвечают равновесию двух фаз:
А О1
- Feα
Feпар
О1
- Feα
Feпар
О 1С1 - Feα Feγ
О 1О2 - Feγ Feпар
О 2С2 - Feγ Feδ С = 3 – 2 = 1
О 2О3 - Feδ Feпар
О 3С3 - Feδ Feж
О 3В - Feж Feпар
Можно произвольно изменять один параметр, не изменяя числа фаз, находящихся в равновесии.
Области на диаграмме отвечают устойчивому состоянию одной фазы.
 I
- устойчиво Feα
I
- устойчиво Feα
II - устойчиво Feγ
III - устойчиво Feδ С = 3 – 1 = 2
IV - устойчиво Feж
V - устойчиво Feпар
Система бивариантна, можно изменять два параметра Р и Т.
Рассмотрим последовательность превращений в системе при движении фигуративной точки по горизонтальной прямой от положения х до положения у, что соответствует изобарическому нагреванию железа.
В точке х устойчиво Feγ. Сусл = 2 – ƒ = 2 – 1 = 1
Нагревание Feγ при давлении Р приводит нас в состояние, отмеченное на диаграмме фигуративной точкой m. Появляется новая фаза - Feδ и вариантность изменяется: Сусл = 2 – ƒ = 2 – 2 = 0
Дальнейший подвод теплоты приводит к исчезновению Feγ при постоянной температуре.
Далее нагревается уже Feδ и фигуративная точка, перемещаясь вправо, попадает в точку О3. Точка О3 отвечает равновесию трех фаз:
Feδ Feж Feпар
Однако при Р = const образование сразу двух новых фаз: жидкости и пара невозможно, т.к. Сусл = 2 – ƒ = 0 и ƒmax = 2; в равновесии могут находиться только две фазы. Поэтому последовательность превращений в точке О3 будет такова:

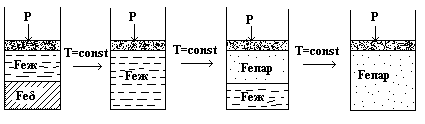
на короткое время
От точки О3 до точки у нагреваться до температуры Т2 будет уже пар.
Путь сиcтемы xmO3y в координатах температура – время можно изобразить следующим образом:
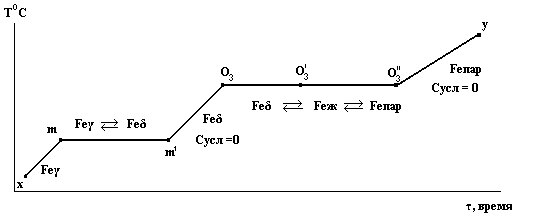
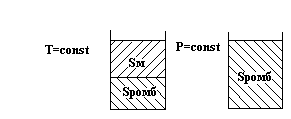
Диаграмма состояния серы
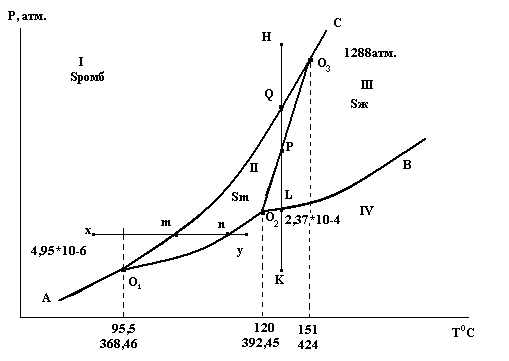
Сера существует в двух устойчивых кристаллических модификациях:
ромбической (Sромб) и моноклинной (Sм).
О1, О2, О3 – тройные точки на диаграмме. Здесь в равновесии находятся три фазы.

О 1 - Sромб Sм Sпар
О 2 - Sм Sж Sпар С = 3 – ƒ = 3 – 3 = 0
О 3 - Sромб Sм Sж
Давление и температура имеют строго определенное значение.
В точке О3 в равновесии находятся все конденсированные фазы.
Линии на диаграмме отвечают равновесию двух фаз.
А О1 - Sромб Sпар О1О3 - Sромб Sм
О 1О2 - Sм Sпар О2О3 - Sм Sж
О 2В - Sм Sпар О3С - Sромб Sж
Вариантность на линии: С = 3 – ƒ = 3 – 2 = 1
Области на диаграмме (поля) отвечают устойчивому состоянию одной фазы.

I - устойчива Sромб
II - устойчива Sм С = 3 – ƒ = 3 – 1 = 2
III - устойчива Sж
IV - устойчива Sпар
Рассмотрим последовательность превращений при движении фигуративной точки от положения х до положения у, что соответствует изобарическому нагреванию серы.
В точке х устойчива ромбическая сера. Сусл. = 2 – ƒ = 2 – 1 = 1
Нагревание Sромб приводит нас в состояние, которому отвечает фигуративная точка m. Появляется новая фаза – сера моноклинная.
Сусл. = 2 – ƒ = 2 – 2 = 0
Температура будет оставаться постоянной, пока ромбическая сера полностью не перейдет в моноклинную.
При дальнейшем подводе теплоты температура моноклинной серы будет повышаться, и система придет в состояние n, где появится новая фаза - Sпар. Система снова станет инвариантной до полного испарения.
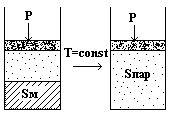
В дальнейшем, до точки у будет нагреваться уже пар серы.
В рассмотренном примере превращение твердого вещества в пар произошло, минуя жидкое состояние.
График в координатах температура – время:
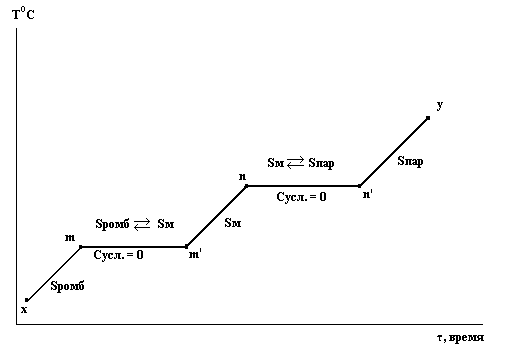
Рассмотренные примеры изобарических превращений H2O, Fe, S дают представления о том, как строятся диаграммы состояния однокомпонентных систем. Имея совокупность графиков в координатах температура – время, при подводе или отводе теплоты для различных давлений, и взяв из них температуры остановок (площадок), можно установить положение линий на диаграмме и координаты тройных точек.
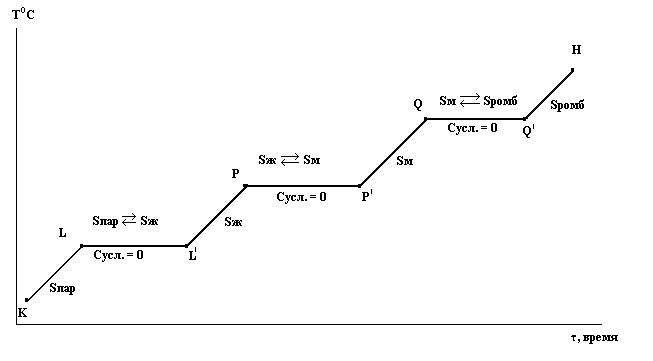
Теперь рассмотрим последовательность превращений в сере при движении фигуративной точки от положения К в положение Н, что соответствует изотермическому сжатию.

В точке К устойчив пар. Сусл. = 2 – ƒ = 2 – 1 = 1
Увеличивая давление, попадаем в точку L, где пар начинает конденсироваться в жидкость. Сусл. = 2 – ƒ = 2 – 2 = 0.
Следовательно, конденсация будет происходить при постоянном давлении, пока весь пар не превратится в жидкую серу.
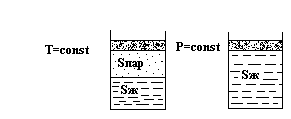
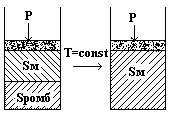
Система станет моновариантной и давление жидкости можно повышать до точки Р. Здесь из жидкости начнут выпадать кристаллы моноклинной серы и давление будет оставаться постоянным до полной кристаллизации:
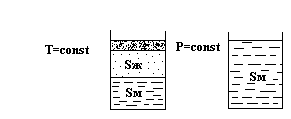
При более высоком давлении в точке Q моноклинная сера начнет переходить в ромбическую. Давление при этом тоже будет оставаться постоянным.
От точки Q до H точки сжиматься будет уже ромбическая сера.
График в координатах давление – время: