
- •Оглавление
- •Предисловие
- •Введение
- •Модуль 1. Структура и методы синтеза полимеров
- •1.1. Структура макромолекул.
- •Гетероцепные полимеры различных классов:
- •Энергия различных связей между структурными единицами макромолекулы:
- •Показатели термодинамической гибкости полимеров в конформации макромолекулярного клубка:
- •1.2. Надмолекулярная структура
- •1.3. Свободнорадикальная полимеризация
- •1.4. Ионная полимеризация
- •Типы структур полибутадиена и полиизопрена, получаемые на катализаторах Циглера-Натта
- •1.5. Сополимеризация
- •1.6. Ступенчатые реакции синтеза полимеров.
- •1.7. Технологическое оформление синтеза промышленных полимеров
- •Контрольные вопросы к главе 1.
- •Модуль 2. Физические свойства полимеров.
- •2.1. Физические и фазовые состояния и переходы.
- •Зависимость мгновенного и истинного удлинений от относительного удлинения при деформации растяжения:
- •2.2. Термодинамика высокоэластической деформации.
- •2.3. Релаксационные свойства полимеров.
- •2.4. Стеклование и стеклообразное состояние.
- •2.5. Механические свойства кристаллических полимеров.
- •2.6. Теории разрушения и долговечность полимеров.
- •2.7. Реология расплавов и растворов полимеров.
- •Молекулярная масса возникновения флуктуационной сетки ряда промышленных полимеров:
- •Контрольные вопросы к главе 2.
- •Модуль 3. Основные химические свойства полимеров и реакции в полимерных цепях
- •3.1. Особенности химических реакций в полимерах.
- •3.2. Деструкция полимеров под действием тепла и химических сред.
- •Теплоты полимеризации и температуры начала термораспада для различных полимеров:
- •3.3. Химические реакции, протекающие
- •При действии света и ионизирующих излучений.
- •3.4. Механохимические реакции в полимерах.
- •Энергия когезии участка цепи длиной 0,5 нм и число звеньев
- •3.5. Реакции полимеров с кислородом и озоном.
- •3.6. Формирование сетчатых структур в полимерах.
- •Контрольные вопросы к главе 3.
- •Библиографический список
Молекулярная масса возникновения флуктуационной сетки ряда промышленных полимеров:
Полимер |
Мс, тыс. ед. |
Полимер |
Мс, тыс. ед. |
Полистирол |
31,2 |
Полиизобутилен |
15,2 |
Полиметилметакрилат |
27,5 |
Цис-полиизопрен |
10,0 |
Поливинилацетат |
24,5 |
1,4-Полибутадиен |
5,9 |
Полидиметилсилоксан |
24,4 |
Полиэтилен |
3,8 |
Эластичность расплавов следует учитывать при переработке полимеров в изделия, т.к. может проявить себя в следующих нежелательных формах:
аномалия вязкости, постепенное нарастание напряжений в полимере и потеря текучести при больших напряжениях сдвига – прямое следствие эластических деформаций;
сокращение длины и «разбухание» струи, искажение формы струи из капилляра вискозиметра или головки экструдера, затрудняющее расчет отверстий для требуемого профиля экструдата, – прямое следствие релаксации эластических деформаций при выходе из капилляра.
Как следует из изложенного, при синтезе и переработке полимеров большое значение имеют процессы их взаимодействия с низкомолекулярными жидкостями. Взаимодействие между макромолекулами и молекулами растворителя, называют сольватацией. При наличии сродства между ними происходит самопроизвольное диспергирование друг в друге (растворение), начинающееся с быстрого проникновения в фазу полимера молекул растворителя. Макромолекулы за это время не успевают перейти в фазу растворителя, и полимер набухает, поглощая растворитель. Увеличение массы (Qм) или объема (Qо) полимера в результате набухания его в определенных условиях (форма и размеры образца, продолжительность, температура и др.) называют степенью набухания: Qм=(mн-mо).100/mо%; Qо=(Vн-Vо).100/Vо%. Растворитель быстро проникает по механизму капиллярного всасывания в области рыхлой упаковки макромолекул, раздвигая их (внутриструктурное набухание). Одновременно с заполнением пор, пустот и каналов, растворитель медленно диффундирует в надмолекулярные образования полимера и разрушает их (межструктурное набухание).
Скорость набухания υ зависит от скорости диффузии растворителя в полимер и может оцениваться углом наклона зависимости степени набухания от времени к оси абсцисс или определяться по увеличению массы Δm (υм) или степени набухания ΔQ (υQ) образца полимера за данный отрезок времени Δτ:
υм=(m2-m1)/(τ2-τ1)=Δm/Δτ; υQ=(Q2-Q1)/(τ2-τ1)= ΔQ/Δτ.
Степень набухания, при которой появляется горизонтальный участок кривой, называется максимальной (Qмакс) или равновесной. Полимер набухает значительно медленнее в парах, чем в жидкости, но максимальная степень набухания при этом не изменяется. Скорость проникновения растворителя от поверхности вглубь зависит от степени термодинамического сродства растворителя и полимера, температуры, уровня межмолекулярного взаимодействия в полимере и других условий процесса. В начале процесса набухания концентрация растворителя уменьшается от поверхности к центру, образец сильно деформируется, и в нем возникают внутренние напряжения, вызывающие разрыв наиболее растянутых участков макромолекул с образованием свободных радикалов, способных инициировать реакции деструкции. Интенсивная окислительная деструкция со снижением прочности полимера, усиливающаяся с повышением температуры, наблюдается в том случае, если сам растворитель легко окисляется. Процесс набухания можно представить как одностороннее смешение, а набухший полимер – как две находящиеся в равновесии фазы с поверхностью раздела между ними.
Неограниченное набухание самопроизвольно переходит в растворение, что характерно для линейных аморфных полимеров с невысокой степенью полимеризации. Степень набухания, после которой начинается растворение, должна быть достаточной для полной сольватации макромолекул и их отделения от остальной массы набухающего полимера. Вокруг набухающего образца образуется слой раствора полимера. Диффузия макромолекул постепенно выравнивает их распределение по всему объему растворителя с образованием однофазной гомогенной системы (рис.2.29а). В точке а скорость растворения становится равной скорости набухания, а в точке в она начинает превышать скорость набухания, и масса образцов уменьшается. Между этими точками образцы имеют максимальную степень набухания Qмакс в течение времени Δτ. Оба показателя уменьшаются со снижением ММ и разветвленности макромолекул и межмолекулярного взаимодействия в полимере. Ограниченное набухание не сопровождается растворением из-за их низкого термодинамического сродства или химического связывания макромолекул в сетчатую структуру (рис.2.29б). С ростом густоты сетки степень и скорость набухания снижаются. Своеобразный ход кривой 3 объясняется экстракцией из набухающего сетчатого полимера растворимых низкомолекулярных компонентов смеси и их растворением. На участке c-d растворение заканчивается. Степень набухания Q1 соответствует максимуму набухания сетчатого полимера с растворимым компонентом, Q2 – чистого сетчатого полимера, а Q1-Q2 – количеству растворившегося компонента.
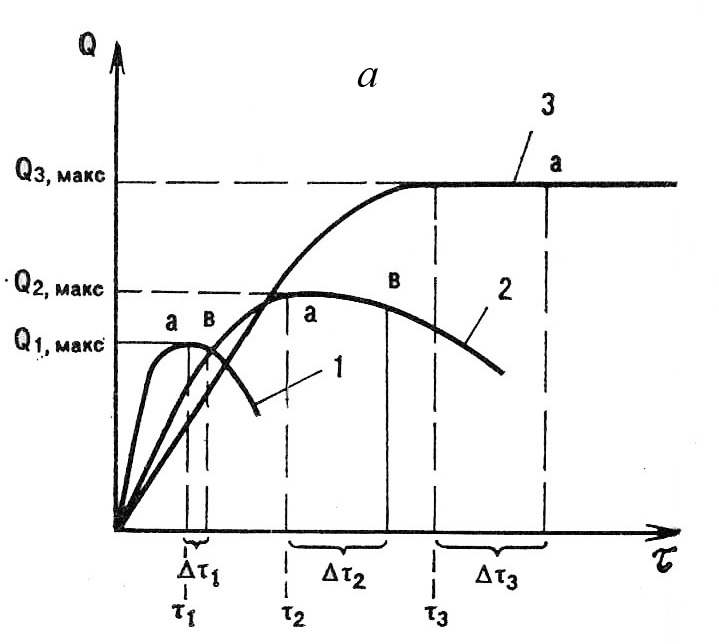
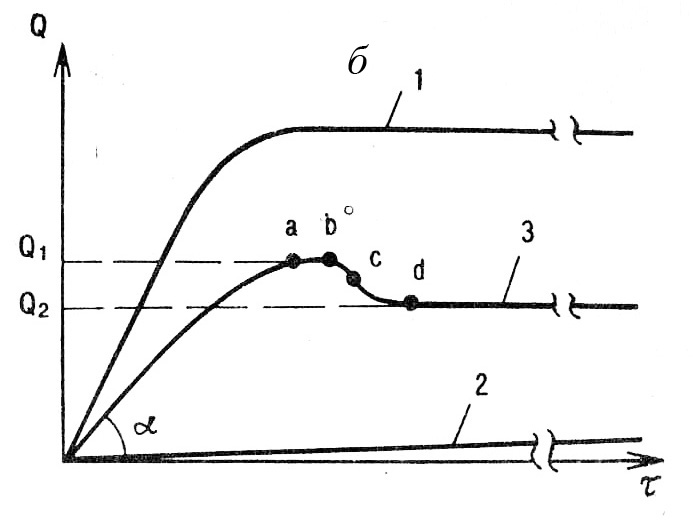
Рис.2.29. Кинетика набухания линейных (а) и сетчатых (б) полимеров: 1а-с небольшой ММ; 2а-с большой ММ или разветвленных; 3а-с большой ММ и сильным межмолекулярным взаимодействием; 1б-редкосетчатых; 2б-густосетчатых;
3б-сетчатых с экстрагируемыми компонентами.
Увеличение объема полярных полимеров при набухании в полярных растворителях сопровождается уменьшением объема (контракцией) всей системы, которое обусловлено ориентацией и уплотнением при сольватации молекул растворителя на поверхности макромолекул, а также заполнением микропор внутри аморфных областей. Контракция V прямо пропорциональна интегральной теплоте набухания qинт, т.е. V/qинт=const, и может быть определена по эмпирическому уравнению: V=αm/(β+m), где m-масса растворителя, поглощенного при набухании 1 г полимера; α и β-константы.
Истинные растворы полимеров и растворы низкомолекулярных веществ различаются не только явлением набухания, но также рядом отклонений от классических законов и уравнений термодинамики. Любое растворение сопровождается уменьшением свободной энергии системы при смешении компонентов. Особенностью же растворения полимеров является очень большая роль энтропии, так как введение растворителя в полимер повышает вероятность изменения конформации макромолекул. Изменение энтропии ΔSсм при растворении определяется уравнением Флори-Хаггинса:
ΔSсм=-R(n1lnφ1+n2lnφ2),
где R-универсальная газовая постоянная; n1 и n2–число молей компонентов; φ1 и φ2- их объемные доли. Теплота смешения ΔНсм при данной концентрации связана с плотностью энергии когезии следующим уравнением:
ΔНсм/(Vφ1φ2)=[(ΔЕ1/V1)1/2-(ΔЕ2/V2)1/2]2,
где V-общий объем смеси; ΔЕ1 и ΔЕ2-изменение энергии когезии в процессе смешения; V1 и V2-объемы компонентов; φ1 и φ2-объемные доли компонентов. Отношение ΔЕ/V называется плотностью энергии когезии (плотностью энергии межмолекулярного притяжения), а величина (ΔЕ/V)1/2 – параметром растворимости δ. Таким образом, ΔН=V1V2(δ1-δ2)2. Если δ1-δ2=0 (δ1=δ2), то ΔН=0, и при растворении главную роль играет энтропийный фактор.
Термодинамическое сродство полимера и растворителя, определяющее способность к растворению и набуханию, зависит от строения макромолекул полимера и молекул растворителя. Эмпирическое правило «подобное растворяется в подобном» подтверждается тем, что обычно неполярные полимеры легко растворяются в неполярных растворителях и не растворяются в полярных, а полярные полимеры растворяются в полярных растворителях. Взаимодействие функциональных групп или атомов приводит к возникновению донорно-акцепторных и иных связей, образующих устойчивые комплексы макромолекул полимера с молекулами растворителя, способные их отделить друг от друга и перевести в раствор. Например, ароматические полимеры вследствие подвижности π-электронов бензольного ядра образуют π-комплексы с молекулами ароматических или хлорсодержащих растворителей. Оценивают термодинамическое сродство компонентов по степени снижения их химических потенциалов, которые определяют путем измерения давления пара растворителя над раствором, осмотического давления, и другими методами.
Абсолютную вязкость растворов (η) можно определить в капиллярном вискозиметре и рассчитать по уравнению Пуазейля: η=πΔРR4τ/8LV, где R и L-радиус и длина капилляра; ΔР-разность давлений на концах капилляра; V-объем шарика с раствором; τ-время истечения раствора. На практике чаще пользуются не абсолютной, а удельной вязкостью, которую рассчитывают по формуле: ηуд=(ηс-ηо)/ηо, где ηс и ηо – вязкость раствора определенной концентрации и растворителя соответственно. Отношение удельной вязкости к концентрации называют приведенной вязкостью. Экстраполяцией прямой зависимости приведенной вязкости (ηуд/с) от концентрации (с) к оси ординат можно найти значение характеристической вязкости [η], под которой понимают вязкость бесконечно разбавленного раствора. Макромолекулы в таком растворе рассматриваются как обособленные, изолированные друг от друга. Зависимость между характеристической вязкостью раствора и молекулярной массой полимера выражается уравнением Марка-Хаувинка-Куна: [η]=КМα, где
К-постоянная, зависящая от температуры и природы полимера и растворителя; α-показатель, характеризующий конформацию макромолекул в растворе.
Различают разбавленные и концентрированные растворы. В разбавленных растворах концентрация с<1/[η], при которой макромолекулы находятся на расстояниях, превышающих их собственные геометрические размеры. В концентрированных растворах с>1/[η], и макромолекулы растворенного полимера могут взаимодействовать друг с другом, что приводит к резкому возрастанию их вязкости. Из-за высокой вязкости к концентрированным растворам относят часто растворы с концентрацией от долей процента (для жесткоцепных полимеров) до 1% (для гибкоцепных полимеров). Появление пространственной сетки из лабильных ассоциатов непрерывно меняющегося состава, взаимосвязанных «проходными» макро-молекулами, приводит не только к аномалии вязкости растворов, но и другим специфическим эффектам, связанным с переходом их в твердое состояние (студни и гели). Например, концентрированные растворы ацетатов целлюлозы представляют собой трехмерную сетку, в ячейках которой находится растворитель. Тип растворителя определяет структуру и густоту сетки. Таким образом, ассоциаты можно рассматривать как зародыши новой фазы.
Аномально высокая вязкость и быстрый ее рост с увеличением концентрации являются отличительной особенностью растворов полимеров. Чем лучше полимер растворяется в жидкости, тем больше уровень его сольватации, снижение межмолекулярного взаимодействия и затруднения к свертыванию макромолекул в плотные клубки. В «плохих» растворителях сольватация выражена слабо, что широко используется на практике для снижения вязкости растворов путем добавления «нерастворителя». Растворы полимеров способны рассеивать свет, что обусловлено непрерывным изменением их концентрации в микрообъемах и соответствующим изменением показателя преломления вследствие образования и распада ассоциатов. По величине светорассеяния разбавленных растворов, в которых макромолекулы свернуты в клубки диаметром менее 0,1 длины волны света, можно определить ММ полимера. Растворы полимеров способны также избирательно поглощать световые лучи. По ультрафиолетовым и инфракрасным спектрам поглощения можно судить о присутствии в полимерах сопряженных двойных связей и определенных атомных групп, характеризующих строение макромолекул.
