
- •Методические указания
- •«Кремний и его соединения»
- •Теоретическая часть I
- •1.1. Кремний Строение и методы получения кремния
- •Физические свойства кремния
- •Химические свойства кремния
- •2.1. Соединения кремния
- •2.1.1. Оксид кремния (IV)
- •2.1.2. Кремниевые кислоты
- •2.1.3. Соли кремниевых кислот (силикаты)
- •2.1.4. Соединения кремния с водородом и галогенами
- •Экспериментальная часть II
Министерство образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
“Ростовский государственный строительный университет”
Утверждено на заседании
кафедры
химии
14.03.11
Методические указания
по курсу общей и неорганической химии
«Кремний и его соединения»
Ростов-на-Дону
2011
УДК 532.6107
Методические указания по курсу общей и неорганической химии «Кремний и его соединения». ― Ростов н/Д: Рост. гос. строит. ун-т, 2011. ― 11 с.
Излагаются теоретические положения по теме “Кремний и его соединения”. Рассчитаны на студентов 1-го курса дневной и заочной форм обучения всех специальностей.
Составители: канд. хим. наук, доц.
М.Н. Мицкая
канд. хим. наук, доц.
Е.А. Левинская
Рецензент д-р хим. наук, проф.
В.Т. Мальцев
Редактор Н.Е. Гладких
Темплан 2011 г., поз. 172
Подписано в печать 8 .09.11. Формат 60x841/16.
Бумага писчая. Ризограф. Уч.-изд. л. 0,5.
Тираж 100 экз. Заказ
Редакционно-издательский центр РГСУ
344022, Ростов-на-Дону, ул. Социалистическая, 162
© Ростовский государственный
строительный университет, 2011
Теоретическая часть I
1.1. Кремний Строение и методы получения кремния
Элемент кремний был открыт Ж. Гей-Люссаком и Л.Тенаром в 1811 году и является вторым по распространенности элементом в земной коре после кислорода (27,6% по массе). В свободном виде он не встречается, но его соединения очень распространены и играют важную роль в неорганическом мире, как углерод в органическом. Кремний встречается в природе в виде SiO2 (кремнезема).
Природный SiO2 служит исходным сырьем для получения всех остальных соединений кремния. В элементарном состоянии кремний может быть выделен восстановлением оксида кремния при высокой температуре такими металлами, как магний
или алюминий, а также углеродом:
;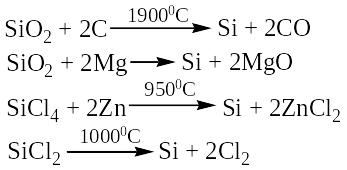
;
;
.
Электронная формула кремния имеет вид: Si 1s22s22p63s23p2.
Физические свойства кремния
Кристаллический кремний представляет собой темно-серое вещество с металлическим блеском, большой твердостью, ρ = 2,33 г/см3, tпл =14150 C; tкип = 2680 0C. Кристаллический кремний имеет алмазоподобную структуру (sp3- гибридизация атомов кремния) и образует прочные ковалентные σ-связи. Кристаллический кремний, как типичный неметалл, инертен.
Аморфный кремний представляет собой бурый гигроскопичный порошок с алмазоподобной структурой, ρ = 2 г/см3. Аморфный кремний является более реакционноспособным, по сравнению с кристаллическим.
Химические свойства кремния
При комнатной температуре кремний взаимодействует лишь с газообразным фтором, со всеми остальными галогенами - лишь при нагревании:
Si + 2Hal2 = SiHal4.
2. При сильном нагревании кремний горит на воздухе с образованием оксида кремния (IV): Si + О2 = SiО2.
3. Кремний непосредственно реагирует с водородом при повышенных температурах с образованием кремнийводородов – силанов:
Si + 2H2 = SiH4 - моносилан.
4. При высокой температуре кремний соединяется с углеродом, с образованием карбида кремния. В промышленности он получил название карборунд, из него изготовляют шлифовальные и точильные камни:
Si + C = SiC.
5. При нагревании кремний соединяется со многими металлами – магнием, кальцием, медью, хромом, марганцем, железом, образуя силициды:
Si + 2Mg = Mg2Si силицид магния.
6. С кислотами кремний не реагирует, а взаимодействует он с расплавами и растворами щелочей:
Si + 2NaOH + H2O = Na2SiO3 + 2H2↑.
Кремний применяется, главным образом, в металлургии и полупроводниковой технике. В металлургии он используется для удаления кислорода из расплавленных металлов и служит составной частью многих сплавов. Важнейшие из них – сплавы на основе железа, меди и алюминия. В полупроводниковой технике кремний используют для изготовления фотоэлементов, усилителей и выпрямителей.
