
- •1. Молекулярна фізика
- •2. Основи термодинаміки
- •1.1.1. Основи молекулярно-кінетичної теорії (мкт)
- •1.1.2 Приклади розв’язування задач
- •1.1.3. Задачі для самостійного розв’язування
- •1.1.4. Основне рівняння молекулярно-кінетичної теорії
- •1.1.5. Приклади розв’язування задач
- •1.1.6 Задачі для самостійного розв’язування
- •1.1.7. Рівняння стану. Ізопроцеси. Закон Дальтона
- •1.1.8. Приклади розв’язування задач
- •1.1.9. Задачі для самостійного розв’язування
- •1.1.10 Зміна агрегатного стану речовини
- •1.1.11. Приклади розв’язування задач
- •1.1.12. Задачі для самостійного розв’язання
- •1.1.13. Поверхневий натяг і деякі властивості рідин
- •2.1.14. Приклади розв’язування задач
- •2.1.15. Задачі для самостійного розв’язання
- •2.2. Основи термодинаміки
- •2.2.1. Робота в термодинаміці. Внутрішня енергія
- •2.2.2. Приклади розв’язування задач
- •2.2.3. Задачі для самостійного розв’язування
- •2.2.4. Тепловий двигун. Ідеальна теплова машина. Цикл Карно
- •2.2.5. Приклади розв’язування задач
- •2.2.6. Задачі для самостійного розв’язування
1.1.6 Задачі для самостійного розв’язування
1. Як зміниться тиск газу, якщо концентрація його молекул збільшиться утричі, а середня швидкість молекул зменшиться утричі?
Відповідь: зменшиться в 3 рази.
2. Обчислити середню кінетичну енергію молекули одноатомного газу під тиском 20кПа. Концентрація молекул цього газу під даним тиском становить 3·1025 м-3.
Відповідь: 10-21 Дж.
3. У скільки разів середня квадратична швидкість молекул кисню менша, ніж середня квадратична швидкість молекул водню, якщо температури цих газів однакові?
Відповідь: 4 рази.
4. Визначити середню кінетичну енергію молекули одноатомного газу і концентрацію молекул при температурі 290К і під тиском 0,8 МПа.
Відповідь: 6· 10-21Дж; 2 · 1026м-3.
5. У скільки разів середня квадратична швидкість молекул повітря в літній день при температурі 30°С більша, ніж у зимовий день при температурі -30°С? Молярна маса повітря становить 0,029 кг/моль.
Відповідь: у 1,12 рази.
Швидкість руху молекул газу
Отримані
формули дозволяють обчислити середню
квадратичну швидкість руху молекул.
Середню
квадратичну швидкість обчислюють: 
Так, за цією формулу середня квадратична швидкість, наприклад, молекул азоту для t = 0 °С, становить 500 м/с, а молекул водню – 1800 м/с. Вперше такі розрахунки були виконані у другій половині XIX ст. і результат виявися настільки неочікуваним, що багато фізиків висловили сумнів щодо правильності молекулярно-кінетичної теорії. Адже відомо, що пахощі поширюються досить повільно – потрібні десятки секунд, щоб запах парфумів, розлитих в одному кутку кімнати, досяг іншого кутка. Наразі це легко пояснити великою кількістю зіткнень між молекулами. Експериментально швидкість теплового руху атомів вперше у 1920 році визначив німецький вчений-фізик О. Штерн (1888–1969).
1.1.7. Рівняння стану. Ізопроцеси. Закон Дальтона
Газ може бути в різних станах, тобто деяка маса газу має об’єм V, тиск p і температуру Т. Величини V, p,Т , що характеризують стан газу, називаються термодинамічними параметрами. Рівняння, що зв’язує параметри стану цього газу ( T V p ) називають рівнянням стану ідеального газу.
Слід зазначати, що задовго до того, як рівняння стану ідеального газу було виведено на основі молекулярно-кінетичних уявлень, закономірності поведінки газів у різних умовах були досить добре дослідженні експериментально. Саме тому рівняння стану ідеального газу можна розглядати як узагальнення експериментальних фактів, що знаходять своє пояснення у молекулярно-кінетичній теорії.
Рівняння Менделєєва–Клапейрона дає змогу визначити один невідомий параметр стану ідеального газу, якщо інші параметри відомі, для газу будь-якого хімічного складу і довільної маси m. Єдина величина у цьому рівнянні, що залежить від виду газу, – це його молярна маса µ.
Якщо врахувати, що густина газу ρ = Vm, то рівняння Менделєєва–Клапейрона матиме вигляд р = µρ RТ.
Процеси, що відбуваються при сталому значенні одного з параметрів стану ( Т, V або p) з певною сталою масою газу, називаються ізопроцесами.
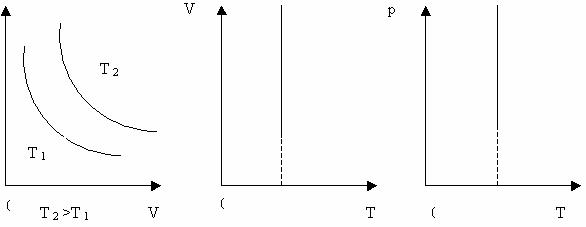
Ізотермічний процес - процес , що відбувається при сталій температурі ( Т= const). За законом Бойля-Маріотта, тиск даної маси газу при сталій температурі обернено пропорційний об’єму газу. Отже,
![]() або
р1V1=р2V2=
const.
або
р1V1=р2V2=
const.
Криву залежності тиску газу від його об’єму при сталій температурі називають ізотермою.
Графік залежності між параметрами газу при Т = const
Ізобаричний процес – процес, який відбувається при сталому тиску ( р= const).
Виходячи із закону Гей-Люссака, відносна зміна об’єму даної маси газу в ізобарному процесі прямо-пропорційна зміні температури t.

Криву залежності об’єму газу від температури при сталому тиску називають ізобарою.
Графік залежності між параметрами при р= const
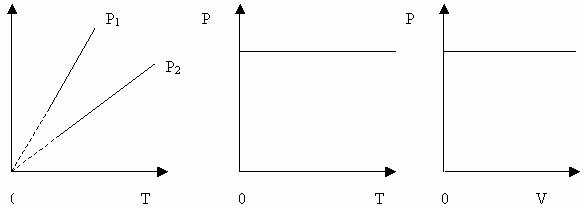
Вищому тиску відповідає нижча ізобара. Штрихи означають, що закон Гей-Люссака в області низьких температур не застосовується. Об’єм не може перетворитися в нуль при температурі – 273 0С.
Ізохоричний
процес
– це
процес , який відбувається при сталому
об’ємі (V
= const).
Виходячи із закону Шарля, тиск даної
маси газу при сталому об’ємі пропорційний
його абсолютній температурі:
![]()
Залежність тиску газу від температури при сталому об’ємі графічно зображається прямою, яка називається ізохорою. Меншому об’ємі відповідає ізохора , що лежить вище.
Графік залежності між параметрами при сталому об’ємі V = const
Р
Змінюючи всі три параметра р, V і Т газу і користуючись газовими законами можна отримати рівняння Клапейрона.
![]() Добуток
тиску даної маси газу на об’єм, поділений
на абсолютну температуру, є величиною
сталою.
Добуток
тиску даної маси газу на об’єм, поділений
на абсолютну температуру, є величиною
сталою.
При t = 00C, р = 1,013 105Па один моль будь-якого газу має об’єм V 0=22,4 10-3м3. Підставивши ці дані в закон Клапейрона, отримуємо значення константи, яка є однакова для будь-якого 1 моля газу. Її називають молярною універсальною газовою сталою.
![]()
Для будь-якої маси газу рівняння Менделєєва – Клапейрона матиме вигляд:
![]()
Якщо в об’ємі V знаходиться суміш газів, які не реагують один з одним, то використавши рівняння Менделєєва – Клапейрона, визначимо тиск:

де ті, Мі – маса і молярна маса і – го газу. Закон Дж. Дальтона:
«Тиск суміші газів дорівнює сумі парціальних тисків газів, з яких складається дана суміш».
Парціальним тиском називається тиск, який був би створений за даних умов (Т,V) окремо одним газом з суміші.
