
- •1. Молекулярна фізика
- •2. Основи термодинаміки
- •1.1.1. Основи молекулярно-кінетичної теорії (мкт)
- •1.1.2 Приклади розв’язування задач
- •1.1.3. Задачі для самостійного розв’язування
- •1.1.4. Основне рівняння молекулярно-кінетичної теорії
- •1.1.5. Приклади розв’язування задач
- •1.1.6 Задачі для самостійного розв’язування
- •1.1.7. Рівняння стану. Ізопроцеси. Закон Дальтона
- •1.1.8. Приклади розв’язування задач
- •1.1.9. Задачі для самостійного розв’язування
- •1.1.10 Зміна агрегатного стану речовини
- •1.1.11. Приклади розв’язування задач
- •1.1.12. Задачі для самостійного розв’язання
- •1.1.13. Поверхневий натяг і деякі властивості рідин
- •2.1.14. Приклади розв’язування задач
- •2.1.15. Задачі для самостійного розв’язання
- •2.2. Основи термодинаміки
- •2.2.1. Робота в термодинаміці. Внутрішня енергія
- •2.2.2. Приклади розв’язування задач
- •2.2.3. Задачі для самостійного розв’язування
- •2.2.4. Тепловий двигун. Ідеальна теплова машина. Цикл Карно
- •2.2.5. Приклади розв’язування задач
- •2.2.6. Задачі для самостійного розв’язування
1.1.2 Приклади розв’язування задач
1. Визначити масу молекули водню.
Розв’язання:
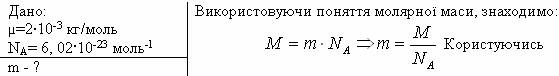
таблицею Менделєєва, знайдемо молярну масу водню:
![]()
Підставивши
числові значення, матимемо:
![]()
Відповідь: m=3,35·10-27кг.
2. В озеро, яке має середню глибину 10м і площу поверхні 20 км2, кинули кристалик кухонної солі масою 0,01г. Скільки молекул цієї солі було у наперснику води об’ємом 2 см3, взятій з озера, якщо вважати, що сіль, розчинившись, рівномірно розподілилась у всьому об’ємі води?
Розв’язання:

Кількість молекул солі в озері:
![]() Отже,
Отже,
![]()
Відповідь: NH = 106.
1.1.3. Задачі для самостійного розв’язування
1. Визначити кількість речовини і кількість молекул, що містяться в 1кг вуглекислого газу. Відповідь: v =22,7 моль, N=1,4·1025.
2. На виріб, площа поверхні якого становить 20 см2, нанесли шар срібла завтовшки 1 мкм. Скільки атомів срібла міститься в покритті? Відповідь: N=1,4·1022.
3. Вважаючи, що діаметр молекул водню становить близько 2,3·10-10м, підрахувати, яку довжину мала б нитка, коли б усі молекули, що містяться в 1 мг цього газу, розташувати в один ряд щільно одна до одної. Порівняти довжину цієї нитки із середньою відстанню від Землі до Місяця (3,8·105 км).
Відповідь: 6,9·1010 м, 180 разів.
4. Густина алмазу 3500 кг/м3. Який об’єм займуть 1022 атомів цієї речовини?
Відповідь: V=5,7·10-8м3.
5. У скільки разів кількість атомів у 12кг вуглецю перевищує кількість молекул в 16кг кисню? Відповідь: у 2 рази.
1.1.4. Основне рівняння молекулярно-кінетичної теорії
Ідеальним називають газ, молекули якого – матеріальні точки, між якими відсутні сили взаємодії. Молекули в такому газі співударяються за законом співударяння пружних куль. Реальні гази поводять себе як ідеальний тоді, коли середня відстань між молекулами у багато разів перевищує їхні розміри, тобто коли розрідження досить велике.Тиск у посудині з газом зумовлений ударами молекул об стінки.
p = 1/3n0m0v2 основне рівняння МКТ -зв’язок між тиском (макроскопічним параметром) з такими мікроскопічними параметрами, як маса однієї молекули і середня квадратична швидкість руху молекул. Це рівняння можна подати й у іншому вигляді , p = 2/3n0E отже тиск ідеального газу пропорційний середній
кінетичній енергії хаотичного руху молекул. Основне рівняння МКТ газів підтверджує той факт, що чим більші маса молекули і їхні швидкості, а також концентрація молекул, тим більший тиск вони чинять на стінки посудини.
Вводячи постійну Больцмана К = 1,38 10-23 Дж/К, можна знайти вираз середньої кінетичної енергії поступального руху молекул через термодинамічну температуру: E = 3/2 kT-рівняння Больцмана для енергії.
Р=
n0
k T,
або n0
=
![]() -при
однаковій
температурі та тиску всі гази утримують
в рівних об'єктах рівну кількість молекул
– число Лошмідта.
-при
однаковій
температурі та тиску всі гази утримують
в рівних об'єктах рівну кількість молекул
– число Лошмідта.
NЛ - молекул в 1м3 газу при нормальних умовах:
Nl
=
![]() =
2,
69 1025
м-3
=
2,
69 1025
м-3
1.1.5. Приклади розв’язування задач
1. Який тиск на стінки посудини створював би ідеальний газ, концентрація молекул якого 1·1020м-3, якщо їх середньоквадратична швидкість 1км/с і маса молекули 3·10-27кг?
Розв’язання:

Відповідь:
![]()
2. Визначити середню квадратичну швидкість молекул газу, густина якого при тиску р = 50кПа становить 4,1·10-2 кг/м3.
Розв’язання:
 Добуток
n0m0
= ρ
- густина газу. Тоді р
=1/3
Добуток
n0m0
= ρ
- густина газу. Тоді р
=1/3![]()
![]() (м/с)
(м/с)
Відповідь: 1910 м/с.
3. Густина газу в балоні газонаповненої електричної лампочки ρ=0,9кг/м3. Коли лампочка світиться, тиск газу в ній зростає з р1=8·104Па до р2=1,1·105Па. На скільки збільшиться при цьому середня квадратична швидкість молекул газу?
Розв’язання:
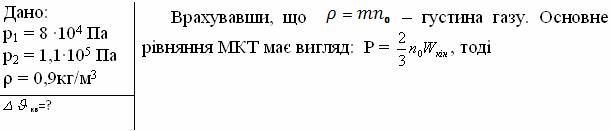
![]()
D![]() кв=
кв2-
кв1=
кв=
кв2-
кв1=![]() 90м/с,
D
90м/с,
D![]()
![]() (
(![]() )=90м/с.
)=90м/с.
Відповідь: 90м/с.
