
- •Методические указания
- •270800.62 – Строительство
- •26.08.2011 Г. Протокол №1
- •Лабораторный практикум
- •Общие правила работы в лаборатории
- •Правила пользования реактивами и приборами
- •Меры предосторожности
- •Оказание первой помощи
- •Техничка лабораторных работ и оборудование Посуда и оборудование
- •Квалификация реактивов
- •Правила работы с химическими реактивами
- •Мытье посуды
- •Измерение объемов
- •Нагревание
- •Измельчение вещества
- •Фильтрование
- •Центрифугирование
- •Сушка в эксикаторе
- •Очистка газов
- •Классы неорганических соединений
- •Лабораторная работа № 1 классы неорганических соединений
- •Требования по технике безопасности
- •4. Возможно получение кислой соли по реакции:
- •Строение атома и периодическая система элементов д.И. Менделеева
- •Химическая связь и строение молекул
- •Химическая термодинамика
- •Тепловые эффекты химических реакций
- •Термохимические уравнения
- •Закон Гесса
- •Термохимические расчеты
- •Решение
- •Решение
- •Лабораторная работа № 2 Определение изменения температуры в калориметре в результате растворения навески кристаллогидрата в воде
- •Устройство калориметра
- •Определение истинного изменения температуры в калориметре при термохимическом процессе
- •Порядок выполнения
- •Скорость химических реакций
- •Смещение химического равновесия при изменении внешних условий
- •Химическое равновесие
- •Способы выражения концентрации растворов
- •Лабораторная работа № 5 приготовление раствора
- •Требования по технике безопасности
- •Растворы электролитов
- •Слабые электролиты. Константа и степень диссоциации
- •Ионное произведение воды. Водородный показатель
- •Реакции обмена в растворах электролитов
- •Лабораторная работа № 6 электролитическая диссоциация реакции обмена в растворах электролитов
- •Степень и константа гидролиза
- •Ступенчатый гидролиз
- •Лабораторная работа № 7
- •Окислительно-восстановительные реакции Степени окисления. Окисление и восстановление
- •Классификация окислительно-восстановительных реакций
- •Окислители и восстановители
- •Составление уравнений окислительно-восстановительных реакций
- •Лабораторная работа № 8 окислительно-восстановительные реакции
- •Требования по технике безопасности
- •Металлы
- •Лабораторная работа № 9 общие свойства металлов
- •Коррозия металлов
- •Защита металлов от коррозии
- •Лабораторная работа № 10 коРрОзИя металлов
- •Неметаллы
- •Лабораторная работа № 11 свойства неметаллов и их соединений
- •Адсорбция
- •Применение процессов сорбции в промышленности
- •Сорбционные методы удаления токсичных веществ из организма
- •Сорбция химических веществ в океане
- •Поглотительная способность почвы
- •Лабораторная работа № 12 Изучение адсорбции веществ из растворов
- •Методика проведения опыта
- •Методика проведения опыта
- •Смачивание
- •Лабораторная работа № 13 Смачивание
- •Методика проведения опыта
- •Методика проведения опыта
- •Элементы органической химии
- •Лабораторная работа № 14 взаимопревращения различных классов органических соединений
- •Список литратуры
Методика проведения опыта
Приготовить исходный 0,4 н раствор СН3СООН и оттитровать его 0,1 н NaOH с фенолфталеином. Приготовить разбавлением исходного раствора по 100 мл растворов следующих концентраций (моль-экв/дм3): 0,2; 0,1; 0,05; 0,025 и 0,0125. В шесть сухих пронумерованных колб с пробками отвесить по 1,5 г активированного угля на технических весах. В каждую колбу влить по 50 мл приготовленных растворов кислоты. Интенсивно взболтать и оставить стоять на 20–30 мин, чтобы установилось равновесие. Взбалтывать растворы каждые 3–5 мин. Приготовить шесть сухих колб с воронками, в которые поместить сухие складчатые фильтры. Растворы отфильтровать, отбрасывая первые порции фильтра (3–5 мл), и фильтрат оттитровать. Титровать каждый раствор до и после адсорбции 2 – 3 раза, используя одинаковые объемы кислоты. Из первых двух растворов с большей концентрацией взять для титрования по 10 мл кислоты, а из последних трех – по 20 мл.
Результаты занести в таблицу по форме:
№ п/п |
До адсорбции |
После адсорбции |
Г, моль/г |
||||
Объем кислоты, мл |
Объем щелочи, мл |
Концентрация кислоты (С1), н |
Объем кислоты, мл |
Объем щелочи, мл |
Концентрация кислоты (С2), н |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Объем кислоты определите по формуле (44)
|
(44) |
Массу адсорбированной кислоты рассчитать по формуле (45):
|
(45) |
где С1 – исходная концентрация кислоты (СН3СООН), н (моль/л, т. к. f(СН3СООН)=1); С2 – равновесная концентрация кислоты, н; V – объем раствора, взятый для адсорбции, л; m – масса адсорбента, г, V(NaOH) – объем щелочи, пошедшей на титрование.
Сделайте вывод о зависимости массы адсорбированной кислоты от концентрации этой кислоты.
Смачивание
К явлению адсорбции близки явления смачивания, также определяющиеся интенсивностью взаимодействия между молекулами различных веществ.
Процессы смачивания играют большую роль в биологических системах, в процессах добычи нефти и газа, при обработке металла и эксплуатации оборудования, при изготовлении и использовании строительных материалов и т. п.
Рассмотрим явления смачивания на примере капли жидкости, нанесенной на поверхность твердого тела, хотя, конечно, можно говорить и о смачивании жидкости жидкостью.
Если молекулы жидкости взаимодействуют с молекулами твердого тела сильнее, чем между собою, то жидкость растекается по поверхности или, как говорят, смачивает ее. Растекание происходит до тех пор, пока жидкость не покроет всю поверхность твердого тела или пока слой жидкости не станет мономолекулярным. Такой случай называется полным смачиванием. Он наблюдается, например, при нанесении капли воды на поверхность чистого стекла.
Если молекулы жидкости взаимодействуют друг с другом значительно сильнее, чем с молекулами твердого тела, растекания не произойдет. Наоборот, жидкость соберется на поверхности в каплю, которая, если бы не действовала сила тяжести, имела бы почти сферическую форму. Случай, близкий к этому, наблюдается при нанесении капли ртути на любую неметаллическую поверхность.
Между этими двумя крайними случаями в зависимости от соотношения интенсивности молекулярных сил, действующих, с одной стороны, между молекулами жидкости и, с другой между молекулами жидкости и твердого тела, возможны переходные случаи неполного смачивания, когда капля образует с поверхностью твердого тела определенный равновесный угол, называемый краевым углом, или углом смачивания.
На рис. 3 изображены капли, образующие на твердой поверхности острый краевой угол (<90°), краевой угол, равный 90°, и тупой краевой угол (>90°).

Рисунок 3 – Различные случаи неполного смачивания:
а < 90°; б = 90о; в > 90°.
Следует иметь в виду, что краевой угол, образуемый каплей на поверхности твердого тела, всегда измеряют со стороны жидкости. Полного не смачивания, т. е. случая, когда краевой угол равен 180°, практически никогда не наблюдается, так как между жидкостью и твердым телом всегда действуют силы притяжения, хотя бы и очень малые.
Ниже приведены значения краевого угла, образуемого водой на поверхности различных твердых тел в атмосфере воздуха:
Кварц |
Малахит |
Галенит |
Графит |
Тальк |
Сера |
Парафин |
0° |
17° |
47° |
55–60° |
69° |
78° |
106° |
Смачивание жидкостью твердого тела можно объяснить как результат действия сил поверхностного натяжения.
Поверхностное натяжение () – определяется особым положением молекул на границе раздела фаз и характеризуется удельной свободной поверхностной энергией (равной работе изотермического и обратимого изменения площади поверхностного слоя в расчете на 1 м2), что равноценно силе действующей тангенциально к поверхности раздела фаз и отнесенной к единице длины этой поверхности
Поверхностные явления вызваны самопроизвольным снижением поверхностной энергии за счет уменьшения поверхностного натяжения и границы раздела фаз.
Свойства дисперсных систем обусловлены дисперсностью и гетерогенностью и связаны с поверхностной энергией.
В гетерогенных дисперсных системах дисперсная фаза и дисперсионная среда ограничены друг от друга поверхностью раздела.
Фаза – это часть системы, однородная по составу и свойствам и отделенная от других частей системы поверхностью раздела (межфазной поверхностью).
Гетерогенные химические системы состоят из двух и более фаз и поэтому имеют межфазную поверхность в отличие от гомогенных систем, состоящих из одной фазы и не имеющих поверхностей раздела. В дисперсных гетерогенных системах различают сплошную фазу, представляющую собой дисперсионную среду, и раздробленную на частицы (диспергированную) фазу, называемую дисперсной фазой. Дисперсная фаза распределена в дисперсионной среде в виде частиц, размер которых превышает ионно-молекулярный уровень.
Реальная межфазовая граница имеет поверхностный слой конечной толщины, не превышающей 1 нм, в пределах которого термодинамические параметры (концентрация компонентов, давление, температура и др.) испытывают резкие изменения. Реальную межфазовую поверхность Гиббс заменил на идеализированную поверхность нулевой толщины, назвав ее разделяющей поверхностью. Значения термодинамических параметров дисперсной фазы и дисперсионной среды сохраняются постоянными вплоть до разделяющей поверхности.
Свойства поверхности раздела фаз дисперсных систем резко отличаются от свойств самой фазы; подобные отличия имеют место на границе раздела любых фаз.
Энергетический аспект поверхностного натяжения определяется удельной свободной поверхностной энергией.
Для того чтобы понять, что собой представляет удельная поверхностная энергия, рассмотрим границу раздела фаз, одна из которых является жидкостью, другая – газом. Взаимодействие молекул жидкости схематически показано на рис. 4.
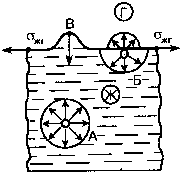

Рисунок
5 – Схема
образования поверхностного натяжения
Рисунок
4 – Схема
образования избытка поверхностной
энергии:
А, Б – молекулы в
объеме и на поверхности жидкости; В –
гребень на поверхности
В глубине жидкости молекула А окружена со всех сторон такими же молекулами/воздействие которых взаимно компенсируется. Молекулы на поверхности одновременно взаимодействуют с молекулами жидкости и газа: Молекула Б поверхностного слоя взаимодействует со своими соседями, находящимися в газовой среде и в жидкости. Воздействие молекул жидкой фазы на молекулу Б значительно превышает воздействие на нее со стороны молекул газовой фазы. У этой молекулы в отношении молекул газовой фазы сохраняется такая же способность к взаимодействию, как в отношении молекул жидкости. Для всех молекул поверхностного слоя нереализованная способность к взаимодействию со стороны одной из фаз (в данном случае газовой) и будет характеризовать свободную поверхностную энергию.
Поверхность раздела фаз обладает избытком нескомпенсированной энергии. Этот избыток в расчете на единицу поверхности и составляет удельную свободную поверхностную энергию. Удельная свободная поверхностная энергия не является особой формой энергии, а обусловлена самим положением молекул на границе раздела фаз. Энергетический аспект поверхностного натяжения определяется работой изотермического и обратимого изменения площади поверхностного слоя в расчете на 1м2.
Жидкость всегда стремится к тому, чтобы площадь ее свободной поверхности была минимальной. Если на поверхности жидкости образуется гребень В (см. рис. 4), то в соответствии с условием минимальной поверхностной энергии гребень исчезает и поверхность жидкости становится идеально гладкой.
Нескомпенсированное межмолекулярное взаимодействие на границе раздела фаз и между молекулами внутри жидкости обусловливает возникновение тангенциальной силы. Такая сила, рассчитанная на единицу длины периметра, ограничивающего поверхность жидкости, определяет силовой аспект поверхностного натяжения. Поверхностное натяжение жидкости на границе с газовой средой обозначено на рис. 4 а.
Рассмотрим, как возникает поверхностное натяжение (рис. 5). Для наглядности на рисунке показаны только три молекулы на поверхности раздела фаз. Молекула 2, которая первоначально может быть расположена несколько выше молекул 1 и 3, в результате взаимодействия с молекулами внутри жидкости будет расталкивать соседние молекулы с силой F. В результате возникает сила, направленная тангенциально поверхности раздела фаз ; эта сила есть поверхностное натяжение.
Удельная свободная поверхностная энергия (энергетический аспект) и тангенциальная сила (силовой аспект поверхностного натяжения) вызваны одной и той же причиной – особым положением молекул на границе раздела фаз и нескомпенсированностью межмолекулярного взаимодействия (см. рис. 4).
Для индивидуальных веществ, например для воды без примесей, когда межмолекулярное взаимодействие и формирование поверхностного слоя осуществляются одними и теми же молекулами, значения поверхностного натяжения в энергетическом и силовом выражении (их обозначают единым символом ) совпадают. В подстрочном индексе указывается, на границе каких фаз рассматривается поверхностное натяжение. Так, жг означает, что речь идет о границе жидкости с газовой средой.
