
- •Кафедра геологии и разработки нефтяных месторождений
- •Газогидраты
- •Оглавление
- •Введение
- •Научные исследования
- •Газогидратные месторождения Российской Федерации и зарубежных стран
- •Лабораторные исследования состава и свойств газогидратов
- •Состав и свойства газовых гидратов
- •Строение гидратов
- •Природные газогидраты. Условия их образования и разложения
- •Геологические исследования газовых гидратов
- •Экспериментальные и теоретические исследования свойств газовых гидратов
- •Перспективы применения в промышленности газогидратных технологий
- •Хранение и транспортировка газогидратов.
- •Способ добычи метана из месторождений газогидратов с помощью свч генератора.
- •Заключение Проблемы и перспективы, связанные с природными газогидратами
- •В области экспериментального изучения фазовых равновесий газовых гидратов
- •В области расчетно-теоретического моделирования гидратообразующих систем
- •В области исследования природных газовых гидратов
- •Литература
Лабораторные исследования состава и свойств газогидратов
Газовые гидраты или клатраты – кристаллические соединения, образующиеся при определенных термобарических условиях из воды и газа. Название «клатраты» (от лат. clathratus — «сажать в клетку»), было дано Пауэллом в 1948 году. Гидраты газа относятся к соединениям переменного состава - нестехиометрическим. Впервые гидраты газов (сернистого газа и хлора) наблюдали еще в конце XVIII в. Дж. Пристли, Б. Пелетье и В. Карстен. В структуре газогидратов молекулы воды образуют ажурный каркас, в котором имеются полости. Эти полости могут занимать молекулы газа. Молекулы газа связаны с каркасом воды ван-дер-ваальсовскими связями. В общем виде состав газовых гидратов описывается формулой M*nH2O, где М – молекула газа-гидратообразователя, n – число, показывающее количество молекул воды, приходящихся на одну молекулу газа (n может изменяться от 5.75 до 17). В настоящее время известно три кристаллические модификации газогидратов.
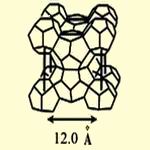
Структура 1
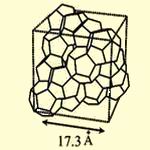
Структура 2

Структура 3
Рис.3 Кристаллические модификации клатратов.
Гидраты газов образуются и существуют при определенных термобарических условиях. Большинство природных газов (CH4, C2H6, C3H8, CO2, N2, H2S, изобутан и т.п.) образуют гидраты. Область существования газовых гидратов приурочена к морским донным осадкам и к областям многолетнемерзлых пород. Преобладающими природными газовыми гидратами являются гидраты метана и диоксида углерода.

Рис4. Фазовая Р,Т-диаграмма системы "метан-вода"
Благодаря своей клатратной структуре единичный объем газового гидрата может содержать до 160-180 см3 чистого газа. Учитывая это, газовые гидраты в настоящее время рассматриваются как один из перспективных источников энергии.
Состав и свойства газовых гидратов
Газовые гидраты (также гидраты природных газов или клатраты) — кристаллические соединения, образующиеся при определённых термобарических условиях из воды и газа.
Впервые гидраты газов (сернистого газа и хлора) наблюдали ещё в конце XVIII века Дж. Пристли, Б. Пелетье и В. Карстен. Первые описания газовых гидратов были приведены Г. Дэви в 1810 году (гидрат хлора). В 1823 г. Фарадей приближённо определил состав гидрата хлора, в 1829 г. Левит обнаружил гидрат брома, а в 1840 г. Вёлер получит гидрат H2S. К 1888 году П. Виллар получает гидраты CH4, C2H6, C2H4, C2H2 и N2O[1].
Клатратная природа газовых гидратов подтверждена в 1950-е гг. после рентгеноструктурных исследований Штакельберга и Мюллера, работ Полинга, Клауссена.
Природные газовые гидраты представляют собой метастабильный минерал, образование и разложение которого зависит от температуры, давления, химического состава газа и воды, свойств пористой среды и др.[4]
Морфология газогидратов весьма разнообразна. В настоящее время выделяют три основных типа кристаллов:
Массивные кристаллы. Формируются за счёт сорбции газа и воды на всей поверхности непрерывно растущего кристалла.
Вискерные кристаллы. Возникают при туннельной сорбции молекул к основанию растущего кристалла.
Гель-кристаллы. Образуются в объёме воды из растворённого в ней газа при достижении условий гидратообразования.
В пластах горных пород гидраты могут быть как распределены в виде микроскопических включений, так и образовывать крупные частицы, вплоть до протяжённых пластов многометровой толщины.
Благодаря своей клатратной структуре единичный объём газового гидрата может содержать до 160—180 объёмов чистого газа. Плотность гидрата ниже плотности воды и льда (для гидрата метана около 900 кг/мі).
При повышении температуры и уменьшении давления гидрат разлагается на газ и воду с поглощением большого количества теплоты. Разложение гидрата в замкнутом объёме либо в пористой среде (естественные условия) приводит к значительному повышению давления.
Кристаллогидраты обладают высоким электрическим сопротивлением, хорошо проводят звук, и практически непроницаемы для свободных молекул воды и газа. Для них характерна аномально низкая теплопроводность (для гидрата метана при 273 К в пять раз ниже, чем у льда).
Для описания термодинамических свойств гидратов в настоящее время широко используется теория Ван-дер-Ваальса (внук)—Платтеу[5]. Основные положения данной теории:
Решётка хозяина не деформируется в зависимости от степени заполнения молекулами-гостями либо от их вида. В каждой молекулярной полости может находиться не более одной молекулы-гостя. Взаимодействие молекул-гостей пренебрежимо мало.К описанию применима статистическая физика.
Несмотря на успешное описание термодинамических характеристик, теория Ван-дер-Ваальса — Платтеу противоречит данным некоторых экспериментов. В частности, показано, что молекулы-гости способны определять как симметрию кристаллической решётки гидрата, так и последовательность фазовых переходов гидрата. Помимо того, обнаружено сильное воздействие гостей на молекулы-хозяева, вызывающее повышение наиболее вероятных частот собственных колебаний.
