
- •Програма з предмету «Хімія» для студентів 2 курсу всіх спеціальностей
- •Лекція №1
- •2. Основні закони хімії
- •3. Розв’язування вправ та задач
- •4. Домашнє завдання :
- •Лекція №2
- •2. Загальна характеристика будови атома
- •3. Принципи заповнення орбіталей
- •4. Фізичний зміст хімічної періодичності
- •5. Хімічний зв'язок. Види хімічного зв'язку
- •5.1Ковалентний зв'язок.
- •5.2 Йонний зв'язок
- •5.3 Водневий зв'язок
- •Висновки до теми :
- •6. Домашнє завдання:
- •Лекція №3
- •1. Елементи хімічної термодинаміки. Основні поняття теми.
- •2. Внутрішня енергія і ентальпія системи. Робота. Теплота. Перший закон термодинаміки.
- •6. Підсумок
- •6. Домашнє завдання :
- •Лекція №4
- •1. Швидкість хімічної реакції
- •2. Основні фактори, що впливають на швидкість хімічної реакції:
- •3. Узагальнення знань. Розв’язування вправ та задач
- •4. Підсумок
- •5. Домашнє завдання: м.Л. Глінка «Загальна хімія», стор. 173-178. Срс № 5 лекція №5
- •1. Оборотні та необоротні реакції
- •2. Хімічна рівновага
- •Чинники, що впливають на стан хімічної рівноваги. Принцип Ле Шательє.
- •4. Розв’язування задач на зміщення хімічної рівноваги
- •5. Підсумок.
- •Лекція №6
- •1. Поняття розчин.
- •1. Поняття розчин
- •2. Поняття розчинності речовини (насичені та ненасичені розчини)
- •3. Фактори розчинності
- •4. Способи вираження концентрації розчинів
- •5. Розв’язування задач на обчислення масової частки і маси розчиненої речовини в розчині
- •Лекція №7
- •1. Рівноважний електродний потенціал
- •2. Рівняння Нернста. Стандартний електродний потенціал
- •3. Ряд напруження металів
- •4. Гальванічні елементи
- •5. Електрорушійна сила (ерс) гальванічного елементу
- •Стандартні потенціали по відношенню до нормального водневого електрода
- •6. Розв’язування вправ та задач. Дайте відповіді на тестові запитання:
- •7. Домашнє завдання
- •Лекція №8
- •1. Суть електролізу
- •2. Електроліз розчинів та розтопів електролітів
- •Продукти електролізу водних розчинів на нерозчинних анодах
- •Застосування електролізу
- •4. Підсумок
- •5. Домашнє завдання
3. Ряд напруження металів
Якщо розташувати метали в ряд в порядку зростання їх стандартних електродних потенціалів, то отримаємо електрохімічний ряд напруження металів.
З електрохімічного ряду слідує:
1) Чим лівіше в ряду напруження стоїть метал, тим він активніший, тим легше він віддає електрони –окислюється; тим складніше його йони приєднують електрони – відновлюються.
2) Кожний метал витісняє всі, що стоять за ним в електрохімічному ряду із розчинів їх солей. Виключення складають метали, розташовані в ряду напруження лівіше магнію, так як вони взаємодіють з водою з витісненням водню.
3) Метали, що стоять в ряду напруження лівіше водню, витісняють його з розчинів кислот-неокисників (хлоридна, розбавлена сульфатна, оцтова та ін.)
4) Метали, що стоять в ряду напруження після водню, не витісняють його з розчинів кислот-неокисників (хлоридна, розбавлена сульфатна, оцтова та ін.)
4. Гальванічні елементи
Частіше енергію, що виділяється в
будь-якій мимовільній окислювально-відновній
реакції, можна безпосередньо використовувати
для виконання електричної роботи. Це
здійснено в гальванічному елементі, що
представляє собою пристрій, у якому
перенос електронів відбувається по
зовнішньому шляху, а не безпосередньо
між реагентами.Гальванічний елемент
уперше створив італійський учений А.
Вольта і назвав його на честь свого
співвітчизника Л. Ґальвані .Якщо шматочок
цинку помістити в розчин, що містить
іони Cu2+. При протіканні цієї
реакції блакитне фарбування розчину,
характерна для іонів Cu2+ (водн.),
зникає, і на поверхні цинку починає
осаджуватися металева мідь. Одночасно
відбувається розчинення цинку.
 мал.1
мал.1
42
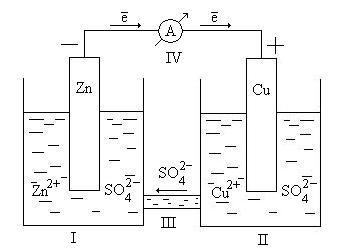
На мал.1 показаний гальванічний елемент, у якому використовується окислювально-відновна реакція між Zn і Cu2+.
Два металевих елементи, що з'єднані зовнішнім ланцюгом, називаються електродами. По визначенню електрод, на якому відбувається окислювання, називається анодом, а електрод, на якому відбувається відновлення, називається катодом. У розглянутому прикладі Zn є анодом, а Cu – катодом:
Окислювання на аноді Zn (тв.) - 2е–
![]() Zn2+ (вoдн.)
Zn2+ (вoдн.)
Відновлення на катоді Cu2+ (водн.) + 2е– Cu (тв.)
Cu2+ може відновлюватися тільки в результаті перетіканню електронів по дроту, що з'єднує Zn і Cu (тобто по зовнішньому ланцюгу).При окислюванні металевого цинку на аноді виникають вільні електрони. Вони перетікають по зовнішньому ланцюгу до катода, де відбувається їхнє поглинання в процесі відновлення Cu2+ (водн.). Електрони мимовільно переміщаються від негативного електрода до позитивного, отже, анод є негативним електродом, а катод – позитивним.Ці перетворення описуються рівнянням:
Zn(тв.) + Cu2+(водн.) Zn2+(водн.) + Cu(тв.)
Цинковий електрод поступово розчиняється, на мідному виділяється металічна мідь.
Схема елемента запишеться так:
анод(-) Zn![]() ZnSO4
CuSO4
Cu
катод(+)
ZnSO4
CuSO4
Cu
катод(+)
З часом гальванічні елементи стають непридатними до роботи, і їх не можна використати вдруге. А от інший тип хімічних джерел електричного струму — електричні акумулятори — можна використовувати багаторазово.
