
- •Общая и неорганическая химия учебно-методическое пособие
- •Введение
- •Основные теории и законы химии
- •Часть I общая химия
- •1. Основные закономерности протекания химических процессов
- •1.1. Энергетика, направление и глубина протекания химических реакций. Химическое равновесие.
- •1.2. Окислительно-восстановительные реакции
- •1.2.1. Типы окислительно-восстановительных реакций.
- •1.2.2. Направление самопроизвольного протекания окислительно-восстановительных реакций
- •1.3. Учение о растворах
- •1.3.1.Растворимость газов
- •1.3.2. Коллигативные свойства растворов
- •1.3.3. Теория электролитической диссоциации.
- •1.3.4. Теория растворов сильных электролитов.
- •1.3.5. Равновесие между раствором и осадком малорастворимого сильного электролита.
- •1.3.6. Ионизация воды. Ионное произведение воды. Водородный показатель. РН растворов сильных кислот и оснований.
- •1.3.7. Растворы слабых электролитов.
- •1.3.8. Теории кислот и оснований.
- •2. Строение вещества
- •2.1. Строение атома
- •2.1.1. Распределение электронов по орбиталям.
- •2.1.2 Периодический закон.
- •Основные характеристики атомов элементов.
- •Химическая связь.
- •Квантово-механическое описание химической связи.
- •2.2. Комплексные соединения
- •2.2.1. Международная (Женевская) номенклатура комплексных соединений
- •2.2.2. Классификация комплексных соединений.
- •2.2.3. Изомерия комплексных соединений.
- •2.2.4. Свойства комплексных соединений.
- •2.2.5. Образование комплексных соединений.
- •2.2.6. Разрушение комплексных соединений.
- •Часть II химия элементов
- •3.1. Водород
- •3.1.1 Вода как важнейшее соединение водорода.
- •4.1.1. Общая характеристика элементов iiiб группы.
- •4.1.2. Общая характеристика элементов ivб и vб групп.
- •Хром и его соединения.
- •Молибден и вольфрам.
- •4.2.3. Биологическая роль d-элементов VI группы и применение в медицине.
- •4.3.1. Марганец и его соединения.
- •4.4.1. Железо и его соединения.
- •4.4.2. Кобальт и никель.
- •4.4.3. Семейство платины (общая характеристика).
- •4.4.4. Биологическая роль d-элементов VIII группы и применение в медицине.
- •4.5.1. Медь и ее соединения.
- •4.5.2. Серебро и его соединения.
- •4.5.3. Золото и его соединения.
- •4.5.4. Биологическая роль d-элементов I группы и применение в медицине.
- •4.6.1. Цинк и его соединения.
- •4.6.2. Кадмий и его соединения.
- •4.6.4. Ртуть и ее соединения.
- •4.6.4. Биологическая роль d-элементов II группы и применение в медицине.
- •Бор и его соединения.
- •Алюминий и его соединения.
- •Биологическая роль р-элементов III группы и применение в медицине.
- •5.2.1. Углерод и его соединения.
- •5.2.2. Кремний.
- •5.2.3. Элементы подгруппы германия и их соединения.
- •5.2.4. Биологическая роль р-элементов IV группы и применение в медицине.
- •5.3.1. Азот и его соединения.
- •5.3.2. Фосфор и его соединения.
- •5.3.3. Химические свойства важнейших соединений мышьяка, сурьмы и висмута.
- •5.3.4. Биологическая роль р-элементов V группы и применение в медицине.
- •5.4.1. Кислород.
- •5.4.2. Сера и ее соединения.
- •5.4.3. Селен и теллур.
- •5.4.4. Биологическая роль р-элементов VI группы и применение в медицине.
- •5.5.1. Галогены и их соединения.
- •5.5.2. Биологическая роль р-элементов VII группы и применение в медицине.
- •Рекомендуемая литература Основная:
- •Дополнительная:
- •Содержание
2.2.2. Классификация комплексных соединений.
I тип: комплексные соединения с одинаковыми лигандами называются однородными, а с разными лигандами – неоднородными.
II тип: за основу берётся химическая природа комплекса [комплексы катионные, анионные, нейтральные].
III тип: наиболее распространена классификация по химической природе лигандов.
2.2.3. Изомерия комплексных соединений.
1. Гидратная (сольватная) изомерия обусловлена различным расположением молекул воды и анионных лигандов между внутренней и внешней сферами. Например, CrCl3∙6H2O существует по крайней мере в трех изомерных формах:
[Cr(H2O)6]Cl3 – трихлорид гексааквахрома (III+) – фиолетового цвета,
[CrCl(H2O)5]Cl2∙H2O – моногидрат дихлорид пентааквахлорохрома (III+) – сине-зеленого цвета,
[CrCl2(H2O)4]Cl∙2H2O – дигидрат хлорид тетрааквадихлорохрома (III+) – зеленого цвета.
Эти изомеры по-разному реагируют с раствором AgNO3. При действии AgNO3 фиолетовое соединение выделяет в осадок весь хлор, сине-зеленое – 2/3, а зеленое – только 1/3 хлора, имеющегося в соединении.
Ионизационная изомерия характеризуется различным распределением ионов между внешними и внутренними сферами комплексных соединений и, как следствие этого, различным характером диссоциации на ионы. Например, для соединения CoBrSO4∙5NH3 известны два изомера: [CoBr(NH3)5]SO4 – красно-фиолетового цвета и [CoSO4(NH3)5]Br – красного цвета.
Координационная изомерия заключается в различном распределении лигандов во внутренних координационных сферах. По-разному взаимодействуют с AgNO3 два изомера – [Co(NH3)6]∙[Cr(CN)6] и [Cr(NH3)6]∙[Co(CN)6]. Первое соединение дает осадок Ag3[Cr(CN)6], а второе – осадок Ag3[Co(CN)6].
Геометрическая изомерия (цис-транс изомерия) состоит в различном пространственном расположениии лигандов вокруг центрального атома. Примером комплексного соединения, имеющего цис- и транс-изомеры, может служить дихлородиамминплатина(II) [PtCl2(NH3)2]. Цис-изомер используется в онкологической практике.
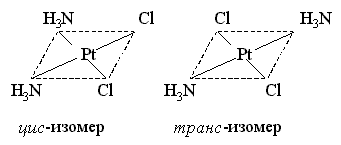
оранжевый светло-зелёный
2.2.4. Свойства комплексных соединений.
Комплексное соединение общего вида [MLn]Xm диссоциирует следующим образом:
[MLn]Xm ↔ [MLn] m+ + m X .
Сам комплексный ион также способен диссоциировать, но уже как слабый электролит. Комплекс под действием растворителя последовательно теряет лиганды (диссоциация протекает ступенчато), и в конечном итоге этот npoцecc можно выразить следующим образом:
[MLn] m+ ↔ M m+ + n L.
Количественно это равновесие характеризуется общей константой нестойкости комплекса:
 .
.
Чем больше Кнест, тем менее устойчив комплексный ион.
2.2.5. Образование комплексных соединений.
Реакции в растворах всегда протекают в направлении наиболее полного связывания ионов, в том числе за счет образования комплексных соединений, в которых в результате донорно-акцепторного взаимодействия возникает устойчивая внутренняя сфера:
FeCl3 + 6KCNS =K3[Fe(CNS)6] + 3KC1
2.2.6. Разрушение комплексных соединений.
Трансформация или разрушение комплексного соединения происходит в тех случаях, когда компоненты его внутренней сферы, вступая во взаимодействие с добавленным реагентом, связываются или трансформируются вследствие образования: а) более устойчивого комплекса; б) малодиссоциирующего соединения; в) малорастворимого соединения; г) окислительно-восстановительных превращений.
Эффективность донорно-акцепторного взаимодействия лиганда и комплексообразователя, а, следовательно, и прочность связи между ними определяются их поляризуемостью, т. е. способностью трансформировать свои электронные оболочки под внешним воздействием. По этому признаку реагенты подразделяются на "жесткие", или малополяризуемые, и "мягкие" – легкополяризуемые. Чем меньше радиус и число электронов у частицы, тем менее она поляризуема. Мягкость комплексообразователя и лиганда растет, соответственно в ряду: Na+, K +, Mg 2+, Ca 2+, Mn 2+ , Fe 2+ Zn 2+, Cd 2+, Pb 2+, Hg 2+ и F- , OH-, H2O, Cl-, RCOO- , NH3, RSH, CN-.
B соответствии с общим принципом "подобное в подобном" и спецификой донорно-акцепторного взаимодействия наиболее прочная и устойчивая к диссоциации ковалентная связь возникает между мягкими комплексообразователями и мягкими лигандами. С учетом того, что белки, включая ферменты, содержат мягкие легкополяризуемые группы RCOO- , NH3, RSH становится понятным, почему все "металлы жизни", относящиеся к d-элементам, в организме встречаются практически только в виде комплексов с биосубстратами. С другой стороны, ясно, почему катионы тяжелых металлов Cd2+, РЬ2+, Hg2+ сильно токсичны. Эти катионы очень "мягкие", особенно катион Hg2+, и поэтому они активно образуют прочные комплексы с жизненно важными белоксодержащими субстратами, нарушая их метаболизм. Особенно легко в реакцию комплексообразования вступают белки, содержащие группу —SH:
2RSH + 2Hg2 + → [R—S—Hg—S—R] + 2H+
Склонностью к комплексообразованию объясняется также токсичность цианидов, так как анион CN- — очень мягкий лиганд – активно взаимодействует с катионами d-металлов в комплексах, замещая в них биосубстраты и тем самым инактивируя эти биокомплексы.
В организме постоянно происходит образование и разрушение жизненно необходимых биокомплексов. Нарушение металлолигандного баланса происходит по разным причинам:
долговременное непоступление в организм катионов биометаллов или поступление их в значительно меньших количествах, чем необходимо для жизнедеятельности;
поступление катионов биометаллов в количествах заметно больших, чем необходимо для жизнедеятельности.
Более серьезные нарушения в метаболизме организма вызываются поступлением катионов металлов-токсикантов или лигандов-токсикантов, а иногда образованием не свойственных ему лигандов (лигандная патология).
Детоксикацию организма от металлов токсикантов можно проводить при помощи лиганд-препаратов на основе полидентантных лигандов, которые образуют с токсикантами прочные водорастворимые комплексы (хелатотерапия). Для детоксикации организма при отравлении металлами-токсикантами можно использовать EDTA, однако при больших дозах этот препарат начнет связывать еще и ионы кальция, что вызывает расстройство многих функций. Поэтому для выведения свинца, ртути, кадмия, урана используют препарат тетацин-калъций (кальцийдинатриевая соль EDTA), имеющий низкое сродство к ионам кальция. Универсальным антидотом при различных отравлениях является тиосульфат натрия, содержащий тиосульфат-ион, активный лиганд в отношении металлов-токсикантов.
Вопросы для самоконтроля:
Как называется способность занимать определенное число мест около центрального атома?
Что является характеристикой устойчивости комплексного соединения?
Справедливы ли утверждения: комплексное соединение будет тем устойчивее, чем:
а) меньше его константа нестойкости;
б) больше его константа устойчивости;
С каким лигандом Zn2+ образует более прочное соединение: глицином, лизином или гистидином по мере увеличения их устойчивости, если константы нестойкости Кн1=1,110-10, Кн2=2,5110-8, Кн3=1,3210-13?
На чем основана сильная токсичность катионов тяжелых металлов?
Почему «металлы жизни» в организме встречаются практически только в виде комплексов.
Какие комплексы железа в организме Вам известны? Какие функции выполняют эти комплексы в организме?
Рассчитайте молярную массу гемоглобина, учитывая, что одна его молекула содержит 4 атома железа, а массовая доля железа равна 0,335%.
Почему в качестве антидота при отравлении металлами-токсикантами используют ЭДТА? Чем вреден избыток этого препарата?
Какой из комплексообразователей (Na+, Mg2+, Sn2+, Fe2+) будет образовывать более прочные комплексы с одинаковыми лигандами?
Объясните, почему координационное число Al3+ с F- равно шести, а с Cl- - четыре?
