
- •1 Вопросы лекции:
- •2 Литература.
- •3 Краткое содержание вопросов
- •3.2 Конструктивные особенности теплоэнергетических установок и их классификация.
- •3.3 Атомные реакторы.
- •3.4 Электродные котлы.
- •3.5 Гелиоустановки.
- •3.6 Геотермальные установки.
- •3.8 Энергосберегающие технологии в теплоэнергетических установках и системах.
- •3 Краткое содержание вопросов
- •3 Краткое содержание вопросов
- •3 Краткое содержание вопросов
- •3 Краткое содержание вопросов
- •Крышка; 2 - сальник с уплотнением для вывода проводов; 3 - зажимы: 4 - колодка;
- •Основание;2 -резиновая трубка; 3, 4-измерительные трубки; 5 - шкала;
- •3 Краткое содержание вопросов
- •3 Краткое содержание вопросов
- •3 Краткое содержание вопросов
- •3 Краткое содержание вопросов
- •Гравитационные пылеуловители
- •Пылеуловители и фильтры контактного действия
- •Инерционные пылеуловители
- •Электрические пылеуловители и фильтры
- •3 Краткое содержание вопросов
- •3 Краткое содержание вопросов
- •3 Краткое содержание вопросов
- •3 Краткое содержание вопросов
- •3 Краткое содержание вопросов
- •3 Краткое содержание вопросов
- •3 Краткое содержание вопросов
- •3 Краткое содержание вопросов
- •3 Краткое содержание вопросов
- •- Питательные трубопроводы
- •3 Краткое содержание вопросов
3 Краткое содержание вопросов
3.1 Физико-химические характеристики воды.
Источниками водоснабжения для питания котлов являются пруды, реки, озера, используются также фунтовые или артезианские воды, вода из городского или поселкового водопровода. В составе природных вод имеются механические примеси минерального или органического происхождения, растворенные химические вещества и газы, поэтому без предварительной очистки природные воды непригодны для питания котлов.
Воду, используемую в паровых и водогрейных котлах, в зависимости от участка технологической цепи, на котором она используется, называют по-разному. Так, вода, поступающая в котельную или ТЭЦ от возможных источников водоснабжения, называется исходной, или сырой, водой. Как правило, эта вода требует предварительной химической подготовки перед использованием ее для питания котлов.
Вода, поступающая для питания котлов, называется питательной. Вода, подаваемая для восполнения потерь пара или расходов воды в тепловых сетях, называется подпиточной. Воду, находящуюся в испарительной системе котла, называют котловой.
Пар, получаемый в промышленных котлах, направляют в различные теплоиспользующие устройства, конденсат из которых возвращается неполностью либо он настолько загрязнен, что не может быть непосредственно использован. Кроме того, часть пара и воды при наличии неплотностей теряется. В связи с этим необходимо систематически добавлять в тепловые сети некоторое количество воды извне. В водогрейные котлы также приходится добавлять воду из-за ее утечек в системе теплоснабжения или использования потребителями.
Качество исходной, подпиточной, питательной и котловой воды характеризуется содержанием взвешенных частиц, сухим остатком, общим солесодержанием, жесткостью, щелочностью, содержанием кремниевой кислоты, концентрацией водородных ионов и содержанием коррозионно-активных газов.
К взвешенным веществам относятся механические примеси, удаляемые из воды путем фильтрования; содержание взвешенных частиц вычисляют в миллиграммах на килограмм (мг/кг). Общее солесодержание определяется по величине сухого остатка примесей, получающегося после испарения 1 кг профильтрованной воды и подсушивания этого осадка при температуре 105 °С. Общее солесодержание измеряется также в мг/кг.
Находящиеся в воде соли обладают той или иной степенью растворимости, означающей, что в воде при каждой данной температуре без остатка может растворяться определенная максимальная масса соли, которую выражают в граммах на литр (г/л). Различают хорошо растворимые (более 10 г вещества в 1 л Н2О). малорастворимые (от 0,01 до 10 г/л) и практически не растворимые (менее 0,01 г/л) соли. К хорошо растворимым следует отнести соли щелочных металлов, хлориды (СаС12, MgCl2) и т.д. Растворимость солей зависит от температуры.
Жесткость воды обусловлена присутствием в ней солей кальция и магния. Различают общую Жо, карбонатную Жк и некарбонатную Жик жесткость.
Карбонатная жесткость Жк характеризуется содержанием в воде гидрокарбонатов кальция Са(НСО3)2 и гидрокарбонатов магния Mg(HCO3)2. Карбонатная жесткость удаляется нагреванием воды, поэтому ее называют также временной жесткостью. При нагревании воды гидрокарбонаты Са(НСО3)2 и Mg(HCO3)2 постепенно переходят в малорастворимую форму солей — карбонаты СаСО3 и MgCO3, выпадающие в виде рыхлых осадков (шлама) и удаляемые при периодической продувке. Уравнения этих реакций следующие:
![]()
![]()
Количественно карбонатная жесткость равна концентрации ионов Са2+ и Mg2+. которая соответствует удвоенной концентрации гидрокарбонат-ионов НСО3.
Некарбонатная жесткость вызвана наличием в воде всех остальных, помимо гидрокарбонатов, солей кальция и магния (например, хлоридов СаСЬ, MgCl2, сульфатов CaSO4, MgSO4, нитратов Ca(NO3)3, Mg(NO,)2, различных силикатов и фосфатов кальция и магния и т.д.). Некарбонатная жесткость является неустранимой, она сохраняется при нагревании и кипячении, поэтому ее называют постоянной жесткостью. Соли постоянной жесткости образуют плотные отложения накипи. Количественно некарбонатная жесткость равна концентрации ионов Са2+ и Mg2+ за вычетом временной (карбонатной) жесткости. В качестве анионов выбраны (условно) сульфат-ионы SO4, хотя в воде могут также находиться, как бы по отмечено, хлориды, нитраты, различные си ликаты и фосфаты кальция и магния. Так как некарбонатную жесткость определяют через содержание CaSO4 и MgSO4, ее называют также сульфатной жесткостью.
Общая жесткость Жо характеризуется суммарным содержанием в воде всех солей кальция и магния (хлоридов, сульфатов, гидрокарбонатов, нитратов, силикатов), т.е. складывается из карбонатной (временной) и некарбонатной (постоянной) жесткости:
Жо = Жк + Жнк.
Количественно общую жесткость воды характеризуют через суммарное содержание ионов Са2+ и Mg2+, выраженное в ммоль/кг. По жесткости все природные воды делятся на мягкие (общая жесткость менее 2 ммоль/кг) и жесткие со средней степенью жесткости (2... 10 ммоль/кг) и высокой степенью жесткости (более 10 ммоль/кг). Для перевода количества вещества п, моль, в его массу m, кг, используют формулу пМ = т, где М — молярная масса конкретного вещества, кг/моль. Для рассматриваемых солей жесткость соответствует M(Са) = 40,08 кг/моль, M(Mg) = 24,32 кг/моль. Так как в химических процессах вещества реагируют и образуются в эквивалентных количествах, то на практике до сих пор широко используется понятие грамм-эквивалента — количество вещества в граммах, численно равное его химическому эквиваленту. Химический эквивалент — безразмерная величина, численно равная для водных растворов солей молярной концентрации ионов Са2+ и Mg2+, приходящейся на вдвое большую молярную концентрацию НСО]. Таким образом, если используют единицу измерения жесткости мг-экв/кг (миллиграмм-эквивалент на 1 кг воды), то она соответствует содержанию в воде 20,04 мг иона Са2+ или 12,16 мг иона Mg2+.
Щелочность характеризуется наличием в воде щелочных соединений (NaOH — едкий натр, Na2CO3 — кальцинированная сода. NaHCO3 — гидрокарбонат натрия, Na3PO4 — тринатрий-фосфат и др.).
Общая щелочность Що складывается из суммы Щг (гидратная щелочность), Щ[К (гидрокарбонатная), Щк (карбонатная), т.е.
Щелочность воды, как и ее кислотность, определяется водородным показателем рН. Вода является очень слабым электролитом, и ее диссоциация происходит по реакции Н2О↔ Н+ + ОН . При температуре 25 0С в чистой воде концентрация ионов водорода Сн+ равна концентрации гидроксид-ионов Сон-, и в свою очередь они равны: Сн+ = Сон = 10-7 моль/л. Такая среда называется нейтральной. Десятичный логарифм концентрации ионов водорода, взятый с обратным знаком, назван водородным показателем рН, т.е. рН = -Ig[H+]. Таким образом, для нейтральной среды рН = -lg| 10-7| = 7.
В кислой среде С н+ > Сон- и рН < 7, а в щелочной среде СН+<СОН- и рН > 7.
Окисляемость воды характеризуется наличием в ней органических соединений. С достаточной степенью точности ее можно определить также по потере массы сухого остатка, сожженного при 800 0С. Важное значение для характеристики качества воды имеет также наличие кремнийсодержащих ионов. Присутствие растворенных в воде газов О2 и СО2 определяет в основном ее коррозионные свойства.
Вода, подготовленная для питания котла, не должна давать отложений шлама и накипи, разъедать внутренние стенки труб поверхностей нагрева, а также вспениваться.
3.2 Влияние качества воды на работу котла.
Наличие примесей в питательной воде приводит к явлениям, существенно усложняющим работу котельного агрегата. В первую очередь следует выделить накипеобразование, загрязнение пароперегревателей и турбин, внутреннюю коррозию в трубах.
Накипеобразование на внутренней поверхности обогреваемых труб относится к наиболее нежелательным явлениям. При появлении накипи толщиной δН на внутренней поверхности труб повышается температура стенки tст на наружной обогреваемой поверхности металла по причине низкой теплопроводности накипи λH.
Даже весьма небольшой слой накипи приводит к весьма существенному повышению температуры металла труб и их разрыву из-за потери механической прочности, что считается тяжелой аварией в котлоагрегате.
Растворение веществ в воде приводит к полной или частичной их диссоциации с образованием соответствующих ионов. Питательная вода содержит в основном следующие ионы: катионы Na+, Са2+. Mg2+ и анионы ОН- , Сl-, SO2- СО2-3, (HSiO3)-. Ион натрия Na+ легко образуется при растворении в воде многих природных соединений, в их числе соли — хлорид натрия (поваренная соль) NaCl, сульфат натрия (глауберова соль) Na2SO4, карбонат натрия (кальцинированная сода) Na2CO3, гидроксид натрия (каустическая сода, натровый щелок) NaOH и др.
При соприкосновении воды с горячей стенкой трубы в поверхностном слое вследствие испарения воды достигается состояние насыщения, и избыток вещества выпадает из раствора в осадок, образуя на стенке трубы твердые и плотные отложения — накипь. Очень твердую накипь дают силикаты CaSiO3, и сульфаты CaSO4 кальция.
Внутренние загрязнения на трубах пароперегревателей и лопатках турбин появляются при выносе солей из барабана котла с часточками влаги и вследствие растворимости некоторых солей в паре. Особая роль в загрязнении пароперегревателя и турбин принадлежит кремнекислотам (их общая формула mSiO2·nH2O). С увеличением давления растворимость в паре кремнекислот возрастает. Поэтому с повышением давления пара более 10 МПа значительно возрастают требования к чистоте воды и пара по их содержанию, например по содержанию ортокремниевой кислоты H4SiO4, молекулы которой образуют цепи, давая сначала вязкий осадок в виде геля (со временем формируется пористое вещество — силикагель).
В барабанах котлов и экранных трубах наблюдается щелочная коррозия, определяемая концентрацией щелочи NaOH, достигающей опасных значений при выпаривании котловой воды. Особенно активно коррозия протекает под слоем непрочных отложений (накипи и шлама).
Распространенным видом коррозии является кислородная коррозия. Свободный кислород, содержащийся в воде, электрохимически взаимодействует с металлом и вызывает его разрушение. Наиболее подвержены кислородной коррозии внутренние поверхности труб экономайзеров.
3.3 Основные нормы качества воды.
Водно-химический режим работы котла должен обеспечивать надежность всей системы, включая питательный тракт, без повреждения элементов из-за отложений накипи и шлама, повышения относительной щелочности (т.е. доли свободного едкого натра NaOH в общем солевом составе котловой воды) до опасных пределов или коррозии металла.
Все паровые котлы с естественной и многократной принудительной циркуляцией паропроизводительностью 0,7 т/ч и более, все паровые прямоточные котлы, а также все водогрейные котлы должны быть оборудованы установками для докотловой обработки воды. Выбор способа обработки воды для питания котлов осуществляет проектная организация.
На основании теплотехнических испытаний котлов и длительного опыта их эксплуатации установлены нормы качества питательной воды для водотрубных котлов с естественной циркуляцией (табл. 9.1), сетевой и подпиточной воды водогрейных котлов (табл. 9.2).
Качество подпиточной и сетевой воды водогрейных котлов должно удовлетворять требованиям, указанным в табл. 9.2.
Нормы качества котловой воды, необходимый режим ее коррекционной обработки, режимы непрерывной и периодической продувок принимаются на основании инструкции предприятия изготовителя котла, типовых инструкций по ведению водно-химического режима и других ведомственных нормативных документов или на основании результатов теплотехнических испытаний.
Качество пара зависит от его влажности и концентрации загрязняющих котловую воду веществ. Насыщенный пар должен отвечать нормам, приведенным в табл. 9.3. В паре ограничивается содержание растворимых соединений натрия, а также свободной углекислоты Н2СОЪ которая легко распадается на СО2 и Н2О.
Таблица 9.1 Нормы качества питательной воды водотрубных промышленных паровых котлов
Показатель |
Рабочее давление, МПа |
||||
|
0,9 |
1,4 |
2,4 |
4,0 |
10 |
Прозрачность по шрифту, см, не менее |
30 |
40 |
40 |
40 |
- |
Обшая жесткость, мкг-экв/кг |
30/40 |
15/20 |
10/15 |
5/10 |
1/3 |
Содержание соединений железа (в перссчете на Fe), мкг/кг |
Не нормируется |
300/Не нормируется |
100/200 |
5/100 |
20/30 |
Содержание соединений меди (в пересчете на Си), мкг/кг |
Не нормируется |
10/Не нормируется |
5 5 |
||
Содержание растворенного кислорода (для котлов с паропроизводительностью 2 т/ч и более), мкг/кг |
50/100 |
30/50 |
20/50 |
20/50 |
10/10 |
Значение рН при 25 °С |
8,5... 10,5 |
9,1±0,1 |
|||
Содержание нефтепродуктов, мг/кг |
5 |
3 |
3 |
0,5 |
0,3 |
Примечание. В числителе указаны значения для котлов, работающих на жидком топливе, в знаменателе — на других видах топлива.
Таблица 9.2 Нормы качества сетевой и подпиточной воды водогрейных котлов
Показатель |
Система теплоснабжения |
|||||||
открытая |
закрытая |
|||||||
Температура сетевой воды, "С |
||||||||
115 |
150 |
200 |
115 |
150 |
200 |
|||
Прозрачность по шрифту, см, не менее |
40 |
40 |
40 |
30 |
30 |
30 |
||
Карбонатная жесткость, mkг-экв/кг,при рН не более 8,5 |
800 700 |
750 600 |
375 300 |
800 700 |
750 600 |
375 300 |
||
Карбонатная жесткость, мкг-экв/кг, при рН более 8,5 |
Не допускается |
По расчету ГОСТ 108.030.47—81 |
||||||
Содержание растворенного кислорода, мкг/кг |
50 |
30 |
20 |
50 |
30 |
20 |
||
Содержание соединений железа (в пересчете на Fe), мкг/кг |
300 - |
200 250 |
250 200 |
600 500 |
500 400 |
375 300 |
||
Значение рН при 25 0С |
7...8.5 |
7... И |
||||||
Содержание нефтепродуктов, мг/кг |
1,0 |
|||||||
Таблица 9.3 Предельные значения содержания примесей в насыщенном паре котлов с естественной циркуляцией
Показатель |
Давление в котле, МПа |
||||
промышленном |
энергетическом |
||||
|
ТЭЦ |
кэс |
|||
1,4 |
2,4 |
4,0 |
4,0 |
4,0 |
|
Солесодержание (в пересчете на NaCl), мкг/кг |
1000 |
500 |
300 |
300 |
200 |
Содержание свободной углекислоты, мкг/ki |
20 |
20 |
20 |
20 |
10 |
Содержание свободного аммиака, не связанного углекислотой |
Не допускается |
||||
3.4 Удаление механических примесей и коллоидных веществ из вод.
В природной воде наряду с растворенными могут находиться минеральные и органические примеси, значительно различающиеся по крупности частиц. Для удаления веществ, находящихся во взвешенном состоянии, используют методы отстаивания, фильтрования, коагуляции. Отстаивание проводят в отстойниках, длительность процесса зависит от плотности частиц, их размера и формы. Объем отстойника обычно соответствует полуторной или удвоенной часовой производительности. Скорость осаждения мелких частиц невелика, и поэтому воду после отстаивания подвергают дальнейшему осветлению — фильтрованию.
Фильтрование заключается в пропускании воды через слой мелкозернистого материала (кварцевого песка, мрамора, доломита, антрацита) с размером частиц 0,6... 1мм, которым заполняют закрытые напорные фильтры.
Значительно быстрее и полнее процессы отстаивания и фильтрования протекают при коагуляции, сущность которой заключается в укрупнении наиболее мелких коллоидных частиц и выделении их наряду со взвесями в осадок при добавлении к воде специальных реагентов-коагулянтов.
Наиболее эффективными коагулянтами являются соли алюминия и железа - сульфат алюминия Al2(SO4)3, сульфат железа FeSO4·7H2O и хлорное железо FeCl3·6H2О.
Доза коагулянта составляет, например, для сульфата алюминия 30...150 г коагулянта на 1 м3 воды. Коагуляция протекает наиболее полно при температуре воды 35...40°С. В результате коагуляции содержание органических веществ в воде может быть снижено на 60...80%, а кремниевой кислоты — на 25...40%.
Осветлительный фильтр представляет собой цилиндрический металлический резервуар с эллиптическими днищами, в котором на дренажном расширительном устройстве располагается слой фильтрующего материала. Вода после предварительного отстаивания и коагуляции или непосредственно в смеси с коагулянтом поступает в верхнюю часть фильтра через дырчатое распределительное устройство. Просачиваясь со скоростью 12...15 м/ч через фильтрующий материал с высотой слоя 800...1200 мм, вода оставляет на его наружной поверхности и поверхности фильтра в толще взвешенные вещества и хлопья коагулянта, осветляется, после чего через дренажную систему она отводится в бак. В процессе фильтрации (обычно в течение 5...6 ч) фильтрующий материал загрязняется осадком, т.е. требуется его периодическая очистка. Фильтрацию через зафязненный фильтр приостанавливают и промывают его потоком чистой отфильтрованной воды, направленным снизу вверх. Для улучшения качества промывки фильтрующего материала его «взрыхляют» сжатым воздухом, подаваемым снизу под фильтрующий материал. Осветлительный фильтр имеет два люка для загрузки фильтрующего материала, осмотра и ремонта фильтра.
3.5 Основные методы умягчения и обессоливание воды.
Умягчение воды проводят методом осаждения и методом ионного обмена. Метод осаждения заключается в том, что присутствующие в обрабатываемой воде в растворенном состоянии накипеобразующие катионы (Са2+, Mg2+) в результате химического взаимодействия их с вводимыми в воду реагентами (известь, сода и т.д.) или в результате термического их разложения образуют новые соединения, малорастворимые в воде и поэтому выделяющиеся из нее в твердом состоянии. Образованные таким путем вещества удаляют затем из воды в процессе отстаивания и фильтрования. При умягчении воды методом, получившим название «содово-известковый», не удается получить достаточно глубокого умягчения воды, поэтому в настоящее время наибольшее распространение получил метод ионного обмена.
Обработка воды методом ионного обмена осуществляется в фильтрах через слой зернистого материала — ионита. В процессе фильтрования ионы солей, содержащихся в воде, заменяются ионами, которыми насыщен ионит. В качестве обменных ионов в практике водоподготовки применяются катионы натрия Na+, водорода Н+, аммония NH4+, а также гидроксильные ОН- и хлоридные Cl- анионы.
Если зернистый материал ионита содержит катионы, он называется катионитом, а фильтрация воды через слой катионита — катионированием воды. При содержании в зернистом фильтрующем материале анионов его называют анионитом, а обработку воды — анионированием.
В зависимости от вида обменного катиона различают Na-катионирование и Н-катионирование.
При Na-катионитовом умягчении воды в результате реакций ионного обмена соли жесткости удаляются из воды, и в умягченную воду переходят соли натрия, обладающие высокой растворимостью.
В качестве катионита на установках умягчения воды в настоящее время используются относительно дешевые сульфированные угли (сульфоугли) и более дорогие синтетические смолы. Сульфоуголь получают при обработке бурого или каменного угля высококонцентрированной серной кислотой. Широкое распространение получил катионит КУ-2 на основе полистирольного синтетического материала.
Так, полная обменная способность сульфоугля составляет 500...600 г-экв/м3, а катионита КУ-2 - 1500...1700 г-экв/м3. Обычно рабочий цикл умягчения в катионитном фильтре продолжают до момента «проскока» в фильтрат солей жесткости, затем фильтрацию приостанавливают с целью регенерации фильтра.
Катионитный фильтр (рис. 9.1) состоит из цилиндрического корпуса 3 co сферическими днищами. Загрузку катионита в фильтр ведут через верхний люк 4, а выгрузку — через нижний 5. Высота слоя катионита в зависимости от жесткости исходной воды может достигать 3...4 м. На бетонной подушке 7 устанавливается дренажное устройство 6, предназначенное для равномерного распределения воды, проходящей по всему сечению фильтра. Оно состоит из коллекторов и системы труб, к которым приварены патрубки с резьбой. На них навинчиваются пластмассовые либо фарфоровые колпачки с отверстиями или щелями. Для равномерного распределения по поверхности катионита вода подается в фильтр через воронку 1, обращенную широким концом вверх. Регенерирующий раствор поступает в фильтр через кольцевую трубу 2, в которой имеется множество мелких отверстий.
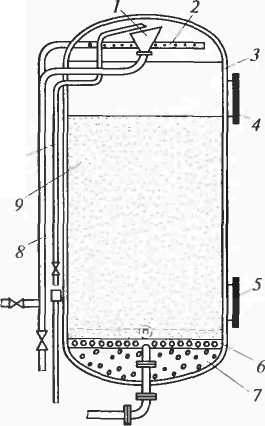
10
Рис. 9.1. Кагионитный фильтр:
1 - воронка; 2 - кольцевая дырчатая трубка; 3 - корпус; 4 - верхний люк;
5 - нижний люк; 6 - дренажное устройство; 7- бетонная подушка;
8 - трубопровод для подачи воды на умягчение или раствора соли на регенерацию;
9 - катионит; 10 - трубка для отбора проб
Для регенерации фильтра предполагается выполнение следующих операций: взрыхление катионита, собственно регенерация и отмывка катионита.
Взрыхление проводят током воды снизу вверх с целью устранения спрессованное™ катионита, образовавшейся под давлением массы воды при ее фильтровании. Непосредственно регенерация заключается в пропуске сверху вниз регенерирующего раствора через слой катионита. При Na-катионировании регенерацию проводят 8... 10%-ым раствором поваренной соли NaCl. Ионы Na+, содержащиеся в регенерирующем растворе, вытесняют ионы Са2+ и Mg2+, которые были задержаны в процессе фильтрования. Вытесненные ионы переходят в раствор, а катионит, обогащаясь катионами Na+, восстанавливает свою обменную способность.
Отмывка катионита заключается в том, что током воды сверху вниз катионит очищается от избытка регенерирующего раствора и от продуктов регенерации, вытесняемых из катионита.
Регенерацию катионитных фильтров в зависимости от качества воды проводят 1—3 раза в сутки. Во время регенерации, которая занимает около 2 ч, воду пропускают через резервный фильтр.
Чистое Na-катионирование применяют только при умягчении воды с небольшой карбонатной жесткостью. Для умягчения воды с большой карбонатной жесткостью применяют совместное Na-H-катионирование.
Под обессоливанием воды понимают удаление из нее катионов и анионов растворенных веществ. Обессоливание воды по методу ионного обмена связано с использованием процесса анио-нирования наряду с рассмотренным ранее катионированием. Анио-ниты представляют собой искусственно приготовленные материалы. Они делятся на слабооснбвные и сильнооснбвные. Слабооснбвные аниониты способны к поглощению анионов только сильных кислот (SO2-4 Cl-, NО3-); анионы слабых кислот (HSiO3-, HCO3-) ими практически не задерживаются. Сильнооснбвные аниониты могут извлекать из водных растворов анионы сильных и слабых кислот.
При ионно-обменном способе обессоливания обрабатываемая вода проходит ряд ступеней очистки, каждая из которых предназначена для выполнения определенной функции. Число ступеней зависит от степени обессоливания воды. Анионирование может осуществляться при разных значениях рН обрабатываемой воды. Однако наиболее эффективно оно происходит в кислой среде, когда в воде присутствуют ионы водорода. Поэтому для достижения глубокого удаления анионов обрабатываемую воду обычно фильтруют через Н-катионит, а затем через анионит.
Регенерация анионитовых фильтров проводится фильтрованием через слой анионита раствора щелочи NaOH.
На рис. 9.2 приведены две схемы с частичным (а) и глубоким полным (б) обессоливанием: первая находит применение на электростанциях, оборудованных барабанными котлами высокого (10, 14 МПа) давления, вторая является основной для современных блочных электростанций с прямоточными котельными агрегатами сверхкритического давления. В схеме частичного обессоливания (см. рис. 9.3, а) вода поступает в механический фильтр М, затем на катиоиигные (водородные) фильтры первой Н1, и второй Н2 ступеней для удаления катионов (Са2+, Mg2+. Na+, NH4+ и др.), после которых воду направляют в декарбонизатор Д. Из декарбо-низатора вода поступает в анионитный фильтр А2, заряженный сильноосновным анионитом.
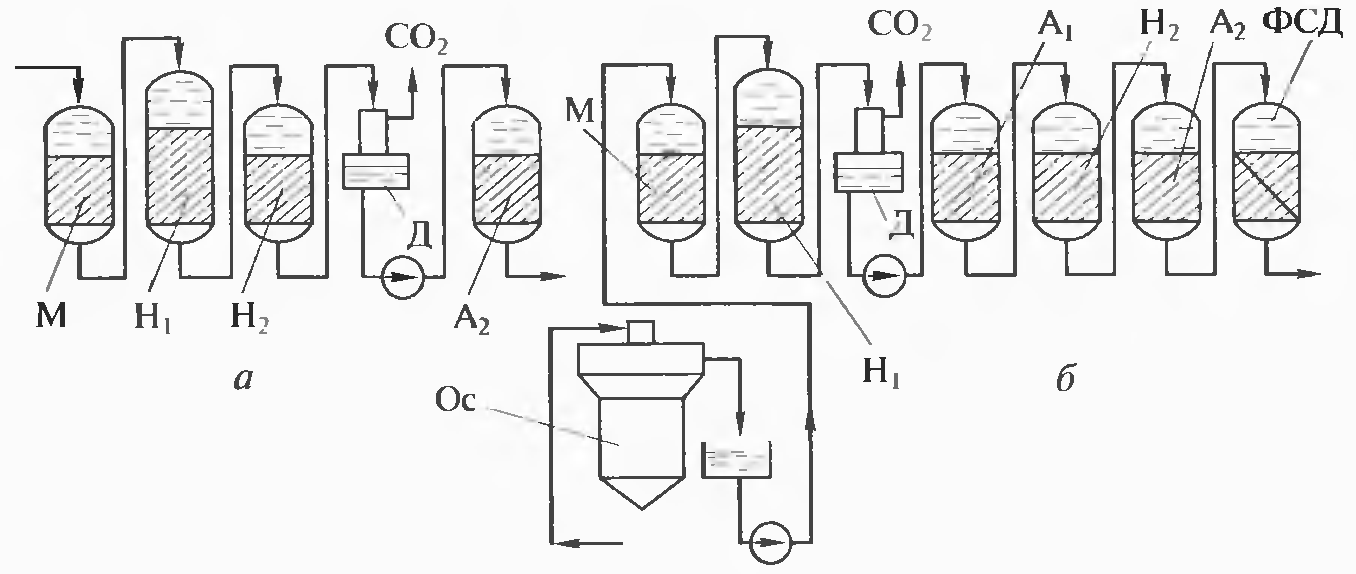
Рис. 9.3. Установки с частичным (а) и полным (б) обессоливанием:
М, Н1, Н2 - механический, водородный первой и второй ступеней фильтры;
Д — декарбонизатор; А1, А2 - анионитные фильтры первый и второй; СО2 - удаление газа (диоксида углерода); ФСД - фильтр смешанного действия; Ос - осветлитель
В фильтры Н1 большей частью загружают сульфоуголь СК-1, а в фильтры Н2 - катионит КУ-2. Анионитные фильтры А1, заполняют слабоосновным анионитом АВ-31, а А2 - анионитом АВ-17.
В схеме с полным обессоливанием (см. рис. 9.3, б) вода поступает в осветлитель Ос, из которого далее направляется в сборный бак. Из бака воду насосом подают в механический фильтр М, а затем в Н1-катионитный фильтр и декарбонизатор Д.
Из декарбонизатора насосом воду подают в последовательно расположенные слабооенбвный анионитный фильтр А1, Н2-катионитный фильтр и сильнооенбвный анионитный фильтр А2. В данной схеме предусмотрена третья ступень очистки в фильтре смешанного действия ФСД, заменяющего соответственно Н3-катионитный и А3-анионитный фильтры.
Лекция №10 (2 часа)
Тема: «Питательные устройства и арматура»
1 Вопросы лекции:
1.1 Центробежные насосы.
1.2 Инжекторы.
1.3 Классификация арматуры котельного агрегата.
1.4 Запорная арматура.
1.5 Предохранительные, обратные и регулирующие клапаны.
1.6 Водоуказательные приборы.
2 Литература.
2.1 Основная
2.1.1 Амерханов Р.А., Бессараб А.С., Драгонов Б.Х., Рудобашта С.П., Шмшко Г.Г. Теплоэнергетические установки и системы сельского хозяйства/ Под ред. Б.Х. Драганова. – М.: Колос-Пресс, 2002. – 424 с.: ил. – (Учебники и учебные пособия для студентов высш. учеб. заведений).
2.1.2 Фокин В.М. Теплогенерирующие установки систем теплоснабжения. М.: «Издательство Машиностроение-1», 2006. 240 с.
2.2 Дополнительная
2.2.1 Соколов Б.А. Котельные установки и их эксплуатация. – 2-е изд., испр. М.: Издательский центр «Академия», 2007. – 423 с.
2.2.2 Белоусов В.Н., Смородин С.Н., Смирнова О.С. Топливо и теория горения. Ч.I. Топливо: учебное пособие/ СПбГТУРП. – СПб., 2011. -84 с.: ил.15.
2.2.3 Зах, Р.Г. Котельные установки. – М.: Энергия, 1968. – 352 с.
2.2.4 Щеголев, М.М. Котельные установки : учебник для вузов / М.М. Щеголев, Ю.Л. Гусев, М.С. Иванова. – М.: Стройиздат, 1972. – 384 с.
2.2.5. Эстеркин, Р.И. Промышленные парогенерирующие установки. – Л.: Энергия. Ленингр. отд-ние, 1980. – 400 с.
