
- •Содержание
- •Введение
- •1. Теоретические основы потенциометрии
- •2. Стандартный потенциал электрода
- •3. Классификация электродов
- •4. Применение потенциометрии в фармацевтическом анализе
- •4.1. Определение рН растворов
- •4.2. Потенциометрическое титрование
- •Порядок работы pH-метра-милливольтметра
- •Приложение № 2
- •Приложение № 3 Потенциометрическое определение препаратов согласно монографий приведенных в нфу и I дополнении
- •Литература
Содержание
Введение 2
1. Теоретические основы потенциометрии 3
2. Стандартный потенциал электрода 8
3. Классификация электродов 10
4. Применение потенциометрии в фармацевтическом анализе 17
4.1. Определение рН растворов 17
4.2. Потенциометрическое титрование 18
Приложение № 2 31
Приложение № 3 35
Введение
Фармацевтический анализ – наука о химической характеристике и измерениях биологической активности веществ. Данный вид анализа используется на всех этапах (стадиях) изготовления лекарственных средств от исходного сырья к конечному продукту, к изучению стабильности и установления сроков годности. В зависимости от поставленных задач фармацевтический анализ осуществляется разными методами подхода к контролю качестве лекарственных средств и содержит в себе:
официнальный анализ;
постадийный контроль производства лекарственных средств;
внутриаптечный (экспресс-анализ) анализ и анализ качества лекарственных форм готовых и индивидуального изготовления в условиях контрольно-аналитических лабораторий.
Современный уровень развития промышленности и техники требует использования высокочувствительных методов анализа, которыми и являются физико-химические и инструментальные методы.
Физико-химические методы анализа лекарственных средств имеют ряд преимуществ перед классическими химическими методами. Они основаны на физико-химических свойствах веществ и в большинстве случаев отличаются экспрессностью, избирательностью, высокой чувствительностью, возможностью унификации и автоматизации.
Одним из таких методов является потенциометрия (как прямая, так и потенциометрическое титрование).
Основными достоинствами метода потенциометрического титрования являются высокая точность, высокая чувствительность. Достоинством метода является также возможность определения несколько веществ в одном растворе без предварительного разделения и титрования что особенно важно в мутных и окрашенных растворах.
Значительно расширяется область практического применения потенциометрического титрования при использовании неводных растворителей (см. приложение № 3). Метод позволяет определить содержание компонентов, которые в водном растворе раздельно не титруются, провести анализ веществ, нерастворимых или разлагающихся в воде и т.д.
Немаловажным достоинством потенциометрии является также возможность автоматизировать процесс титрования.
Определение рН растворов (прямая потенциометрия) необходимо проводить при изготовлении инъекционных растворов до и после стерилизации (см. приложение № 2), а также многих лекарственных препаратов согласно требованиям ГФУ (см. приложение № 3).
Настоящее пособие рекомендовано для студентов фармацевтических высших учебных заведений и факультетов, провизоров-аналитиков аптек и аналитических лабораторий, преподавателей, интернов, слушателей курсов повышения квалификации.
1. Теоретические основы потенциометрии
Потенциометрические методы основаны на измерении потенциалов различных электродов.
Электродные процессы представляют собой совокупность окислительно-восстановительных реакций, протекающие на электродах. В ходе этих реакций происходит переход электрических зарядов из одной фазы в другую, в результате чего в одной фазе сосредоточиваются отрицательные заряды, в другой – положительные, а в итоге на границе раздела фаз создается двойной электрический слой, которому соответствует определенный скачок потенциала.
Электропроводящая твердая фаза (металл, графит и пр.), вместе с раствором или расплавом электролита образует полуэлемент. Из двух полуэлементов получают электрохимическую цепь (гальванический элемент).
Абсолютную разность электрических потенциалов, или скачок потенциала между двумя различными фазами, определить нельзя.
Можно лишь экспериментально измерить электродвижущую силу [ЭДС (Е)] электрохимической цепи, которая отвечает разности потенциалов 2-х элементов. В электрохимической цепи скачки потенциала возникают на границе любых фаз, которые встречаются на пути прохождения тока.
Рассмотрим природу возникающих скачков на примере цепи, изображенной на рис. 1
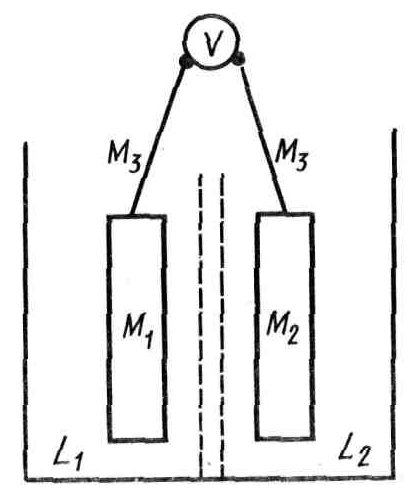
Рис. 1. Схема правильно разомкнутой цепи
Оба выхода вольтметра V сделаны из одного и того же металла М3. Высокоомный вольтметр измеряет разность потенциалов между двумя металлическими электродами М1 и М2, опущенными соответственно в растворы L1 и L2. Через вольтметр идет ничтожно малый ток, т.е. сопротивление вольтметра бесконечно больше. Поэтому можно допустить, что между клеммами 1 и 2 находится вакуум. Согласно закону Кирхгофа, сумма всех скачков потенциала в замкнутой цепи равна нулю:
![]() (1)
(1)
где,
ЭДС (Е) – разность
потенциалов (электродвижущая сила),
измеренная вольтметром, а остальные
слагаемые представляют собой скачки
потенциала на границе фаз вакуум –
металл М3
и металл М3
– вакуум (![]() и
и
![]() )
называются поверхностными.
Они равны по величине и противоположны
по знаку, поэтому взаимно компенсируются.
Сумма скачков потенциала
)
называются поверхностными.
Они равны по величине и противоположны
по знаку, поэтому взаимно компенсируются.
Сумма скачков потенциала
![]() и
и
![]() равна
равна
![]() .
Последний называют контактным
потенциалом (Еконт.).
Скачки потенциала на границе металл
1–раствор 1 и раствор 2–металл 2 (
.
Последний называют контактным
потенциалом (Еконт.).
Скачки потенциала на границе металл
1–раствор 1 и раствор 2–металл 2 (![]() и
и
![]() )
являются электродными
потенциалами Е+
и Е–
(гальвани-потенциалами). Они
не одинаковы по величине и противоположны
по знаку. Скачок потенциала на границе
двух растворов (
)
являются электродными
потенциалами Е+
и Е–
(гальвани-потенциалами). Они
не одинаковы по величине и противоположны
по знаку. Скачок потенциала на границе
двух растворов (![]() )
называют жидкостным
потенциалом (диффузионным).
Контактный и диффузионный потенциалы
по своей природе могут быть положительными
и отрицательными. С учетом сделанных
определений скачков и их знаков уравнение
(1) можно записать в форме:
)
называют жидкостным
потенциалом (диффузионным).
Контактный и диффузионный потенциалы
по своей природе могут быть положительными
и отрицательными. С учетом сделанных
определений скачков и их знаков уравнение
(1) можно записать в форме:
![]() (2)
(2)
Согласно уравнению (2) ЭДС электрохимической цепи включает диффузионный потенциал. Однако расчет и экспериментальное определение диффузионного потенциала затруднительны, поэтому Едифф. стараются свести к минимальной величине. Для этого заполняют электролитический (солевой) мостик, представляющий собой П-образную трубку, насыщенным раствором электролита с близкими подвижностями ионов (обычно KCl). Электролитический мостик располагают между растворами, поэтому вместо одной жидкостной границы возникают две. Так как концентрация ионов в растворе электролитического мостика выше, чем в растворах, то через жидкостные границы диффундируют практически только ионы К+ и Cl-. На обеих границах возникают малые и противоположные по знаку диффузионные потенциалы, которые взаимно компенсируются.
Осмотическая теория электродного потенциала была предложена В. Нернстом в 1890 году. Она основана на трех положениях:
Электродный потенциал определяется скачком потенциала по границе металл-раствор.
Электродный потенциал возникает только в результате обмена ионами между металлом и раствором.
Движущими силами обмена ионами являются осмотическое давление π растворенного вещества и электрохимическая упругость растворения металла (Р).
Согласно теории Нернста, при погружении металла в раствор, содержащий его ионы, сразу же начинается обмен ионами между металлом и раствором. В зависимости от природы металла и состава раствора возможны три случая:
1) π>Р; 2) π<Р; 3) π=Р.
В первых двух случаях происходит преимущественный переход ионов из раствора в металл (π>Р), или из металла в раствор (π<P). Так как ионы заряжены, то их преимущественный переход в какую-либо сторону сразу приводит к появлению в ней положительного заряда, в то время как другая среда зарядится отрицательно.
То есть, при π>Р металл заряжается положительно, а раствор – отрицательно и величина электродного потенциала Е должна быть положительна. При π<Р электродный потенциал отрицателен. При π=Р скачок потенциала равен нулю.
Исходя из вышесказанного, уравнение Нернста для электродного потенциала имеет следующий вид:
![]()
![]()
R – газовая постоянная:
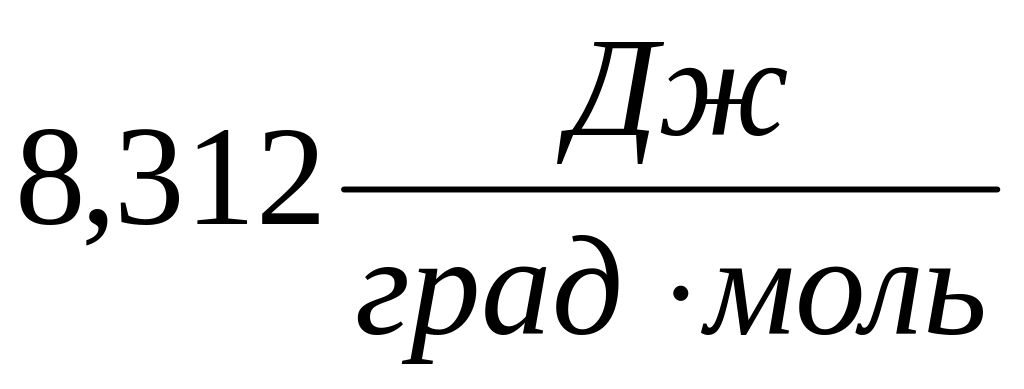 ;
;
Т – температура по Кельвину, 298 0K;
F – число Фарадея, (96500 Кл);
Z – число электронов, принимающих участие в электродной реакции.
аокисл., авосст. – активности, соответственно, окисленной и восстановленной форм редокс - системы;
[окисл.] и [восст.] – молярные концентрации;
γокисл. и γвосст. – коэффициенты активности.
Е0 – стандартный потенциал редокс - системы.
Подставляя численные значения констант в уравнение, получают для 25 0С:
![]()
В электрохимической цепи различают внешнюю и внутреннюю цепь. Внешняя цепь – это выводы электродов и прибор для измерения ЭДС. Внутренняя цепь представляет собой гальванический элемент.
Измерение ЭДС гальванического элемента производят при условии отсутствия тока в цепи. Если позволить току протекать через внешнюю цепь, то внутри элемента будет проходить реакция, в результате которой концентрация ионов изменяется, а поэтому изменится ЭДС.
Следовательно, ЭДС элемента должна изменяться при постоянно заданном составе раствора. Для ее измерения используют высокоомный вольтметр. Благодаря большому внутреннему сопротивлению вольтметра через него проходит ничтожно малый ток, поэтому система практически не изменяется и находится в термодинамическом равновесии.
Для измерения ЭДС элементов, в которых одним из электродов является стеклянный электрод, применяют электронные потенциометры, получившие название рН-метров.
Между растворами отдельных электродов устанавливают контакт с помощью электролитического мостика, заполненного насыщенным раствором KCl. Электролитический мостик обеспечивает электрическую проводимость между растворами, но препятствует их взаимной диффузии.
В гальваническом элементе сами по себе разновесные электроды образуют неравновесную систему. Причиной неравновесности является разница плотностей электронов в металлах и, следовательно, стремление их переходить от одного металла к другому по внешней цепи. Одновременно во внутренней цепи происходит перенос ионов. В качестве примера может служить цинковый элемент Якоби-Даниэля (рис. 2).
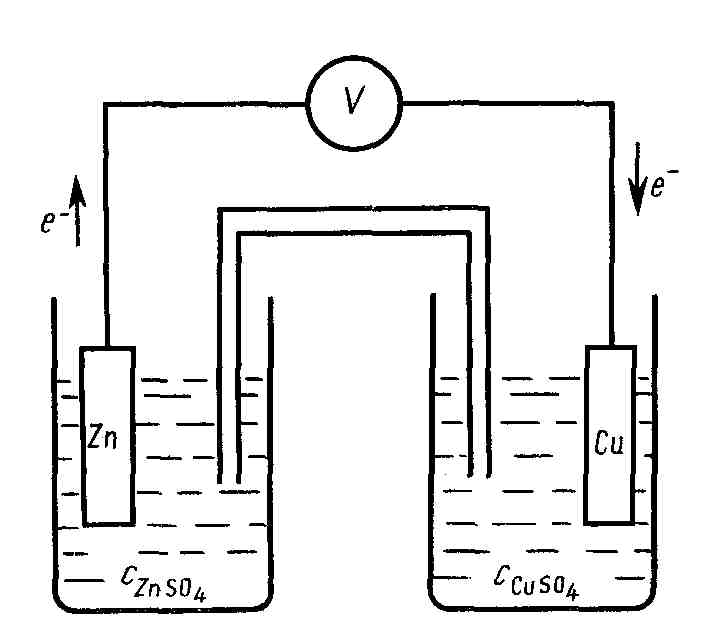
Рис. 2. Схематическое изображение гальванического элемента
Якоби-Даниэля
Разомкнутый элемент находится в заторможенном неравновесном состоянии и может пребывать в этом состоянии как угодно длительно.
Замыкание электродов металлическим проводником снимает торможение. На Zn-электроде (М1) (электрохимически более активном) протекает необратимый процесс окисления (т. е. Zn отдает свои электроны):
![]() (окисление)
(окисление)
![]()
На Cu-электроде необратимый процесс восстановления (т. е. Cu2+ забирает электроны):
![]() (восстановление)
(восстановление)
![]()
Суммарный токообразующий процесс выражается уравнением:
![]()
![]()
В практике применяются концентрационные гальванические элементы, которые состоят из двух одинаковых электродов (например, серебряных), опущенных в растворы одного и того же электролита (например, AgNO3), но разных концентраций. Источником электрического тока в таком элементе служит работа переноса электролита из более концентрированного в более разбавленный раствор.
Концентрационный гальванический элемент, состоящий из двух серебряных электродов, опущенных в растворы AgNO3 разных концентраций, изображают следующим образом:
![]()
Если С1 < С2, то левый электрод посылает в раствор ионы Ag+ и заряжается отрицательно. На правом электроде ионы Ag+ разряжаются, сообщая электроду положительный заряд.
В выражение для
ЭДС концентрационного элемента
![]() не входит значение ЭДС Е0,
так как оба электрода и их стандартные
потенциалы одинаковы, поэтому:
не входит значение ЭДС Е0,
так как оба электрода и их стандартные
потенциалы одинаковы, поэтому:
![]()
Химический гальванический элемент принято обозначать схемой:
![]()
Сплошными линиями разделяют поверхности фаз (Zn0 | Zn2+ и Cu2+ | Cu0), штриховыми – поверхности раздела двух растворов (положение электролитического мостика).
Электрод вместе с раствором, в который он погружен, называют полуэлементом. Полуэлементы изображают следующим образом: Zn0 | ZnSO4; Cu0 | CuSO4 и т.д.
При замыкании гальванического элемента возникает ЭДС, равная разности потенциалов полуэлементов.
Если электрод не обменивает ионов с раствором, то его символ заключается в скобки. Например, электрод из платины, насыщенный водородом, погруженный в раствор HCl (водородный электрод) обозначают (Pt) H2 | HCl.
