
- •Введение
- •Занятие №1
- •1. Тема: Определение качества лекарственных веществ и лекарственных форм рефрактометрическим и поляриметрическим методами.
- •3. Целевые задачи:
- •Определение концентрации этилового спирта в спирто-водных растворах методом рефрактометрии.
- •4. План и организационная структура занятия:
- •5. Задание для самоподготовки студентов:
- •Учебные вопросы для самоподготовки студентов:
- •5.3. Проработать тестовые задания:
- •6. Лабораторная работа.
- •7. Наглядные пособия, тс (технические средства) обучения и контроля:
- •Занятие № 2-3
- •1. Тема: Определение качества лекарственных веществ и лекарственных форм с использованием фотометрии (фэк и сф).
- •3. Целевые задачи:
- •Причины несоблюдения закона Бугера-Ламберта–Бера
- •Спектры поглощения
- •Методы определения концентраций в фэк и сф
- •Фэк и выбор условий фотометрических определений
- •Применение фотометрии в фармацевтическом анализе
- •4. План и организационная структура занятия:
- •5. Задание для самоподготовки студентов:
- •Учебные вопросы для самоподготовки студентов:
- •5.3. Проработать тестовые задания.
- •6. Лабораторная работа.
- •7. Наглядные пособия, тс обучения и контроля:
- •Занятие № 4
- •1. Тема: Определение качества лекарственных веществ и лекарственных форм с использованием хроматографиии и потенциометрии.
- •3. Целевые задачи:
- •Ионообменная хроматография
- •Подготовка сорбента
- •Подготовка колонки
- •Хроматографирование и определение содержания анализируемого вещества
- •Регенерация сорбента
- •Тонкослойная хроматография
- •Оборудование
- •Методика
- •Горизонтальное элюирование
- •Визуальная оценка
- •Теория хроматографического разделения вжх, вгжх
- •Теоретические основы потенциометрии
- •2. Стандартный потенциал электрода
- •3. Классификация электродов
- •Применение потенциометрии в фармацевтическом анализе
- •4.1. Определение рН растворов
- •4.2. Потенциометрическое титрование
- •4. План и организационная структура занятия:
- •5. Задание для самоподготовки студентов:
- •Учебные вопросы для самоподготовки студентов:
- •5.3. Проработать тестовые задания.
- •6. Лабораторная работа.
- •7. Наглядные пособия, тс обучения и контроля:
- •Занятие №5
- •6. Тестовые задания к итоговому занятию
6. Лабораторная работа.
При выполнении лабораторной работы необходимо строго соблюдать правила техники безопасности работы в химической лаборатории.
Каждый студент анализирует:
а) рефрактометрически: одну сложную лекарственную форму и 3 раствора лекарственных веществ неизвестной концентрации;
б) поляриметрически: один раствор лекарственного вещества неизвестной концентрации.
УИРС:
По указанию преподавателя определить концентрацию раствора глюкозы в лекарственной форме:
Раствора глюкозы 5% - 100 мл
Натрия бромида 2,0
рефрактометрически и поляриметрически. Сравнить результаты определений.
Примечание: список лекарственных форм и лекарственных веществ прилагается.
Форма ведения протокола:
Дата
Протокол №1
Тема: «Определение качества лекарственных веществ и лекарственных форм рефрактометрическим и поляриметрическим методами»
Изложение сущности метода
Экспериментальная часть
а) измерение определяемых показателей;
б) вычисление концентрации ингредиентов в задачах;
в) вывод;
г) подпись.
7. Наглядные пособия, тс (технические средства) обучения и контроля:
7.1. Табличный фонд по теме занятия;
7.2. Набор образцов лекарственных веществ и лекарственных форм;
набор реактивов и титрованных растворов согласно НФУ и другой АНД;
рефрактометр, поляриметр;
набор пробирок, колб, пипетки, бюксы стеклянные, водяные бани, газовые горелки, цилиндры, разновес технический, аналитический, аналитические весы, электроплитки, фарфоровые чашки.
Учебные пособия;
Государственная фармакопея Украины;
ТС обучения контроля:
карточки для выяснения исходного уровня знаний и умений;
контрольные вопросы и тесты.
Занятие № 2-3
1. Тема: Определение качества лекарственных веществ и лекарственных форм с использованием фотометрии (фэк и сф).
2. ЦЕЛЬ: Овладеть фотоэлектроколориметрическим и спектрофотометрическим методами анализа лекарственных веществ и лекарственных форм.
3. Целевые задачи:
3.1. Знать классификацию инструментальных методов анализа;
3.2. Изучить физические процессы, лежащие в основе методов фотометрии;
3.3. Изучить устройство и принцип работы приборов;
3.4. Научиться проводить анализ качества лекарственных веществ и лекарственных форм, используя методы фотометрии;
3.5. Давать правильную оценку полученным результатам анализа и делать вывод о качестве анализируемых лекарственных веществ и лекарственных форм;
3.6. Изучить технику безопасности при работе в химической лаборатории и с приборами.
В фармации наибольшее распространение получили абсорбционные (СФ, ФЭК, ИК) методы анализа основанные на взаимодействии излучения с однородными системами. При этом происходит избирательное поглощение света анализируемым веществом. Это значит, что поглощается только такое излучение, которое способно вызвать определенные изменения в молекуле данного вещества, т.е. лучи определенной волны (), и соответствующей им энергии (Е). Поэтому при пропускании через раствор вещества полихроматического света, т.е. света с широким интервалом длин волн, поглощается излучение только определенной длины волны, а остальные лучи проходят через раствор .
При взаимодействии со световой энергией в атомах поглощающего вещества происходит переход электронов на более удаленные от ядра орбиты.
Электронные переходы, вызванные поглощением строго определенных квантов световой энергии, характеризуются наличием строго определенных полос поглощения в электронных спектрах поглощающих атомов или молекул.
Энергия излучения обычно характеризуется электромагнитным спектром (рис. 1).
Электромагнитные излучения различных длин волн (или частот) составляют электромагнитный спектр.
Ультрафиолетовая область |
Видимая область |
Инфракрасная область |
Микроволны |
Радиочастота |
Электронное возбуждение |
Молекулярные колебания |
Молекулярные вращения |
Ядерный процесс |
|
185-400 нм |
400-800нм |
800нм-1мм |
10-2-10см |
>100cм |
- длина волны; 1мк = 1мкм =1 10-6м = 1 10-4 см; 1нм = 1ммк =1 10-9м)
( -волновое число = 1/).
Рисунок 1. Электромагнитный спектр излучения.
В зависимости от используемой аппаратуры в фотометрическом анализе различают спектрофотометрические методы, основанные на поглощении монохроматического света [излучение, в котором все волны имеют одинаковую частоту (или длину волны ), называется монохроматическим] и фотоколориметрические - анализ по поглощению полихроматического (немонохроматического света). Оба метода основаны на общем принципе - существования пропорциональной зависимости между светопоглощением и концентрацией поглощающего вещества .
Точность фотоколориметрических определений лежит в пределах 1 - 2 отн. %, спектрофотометрических 0,1- 0,5 отн.%.
Основной закон поглощения излучения.
При прохождении потока монохроматического света через раствор выполняется закон Бугера-Ламберта-Бера (основной закон светопоглощения ), который формулируется следующим образом:
Поглощение монохроматического света раствором прямо пропорционально концентрации поглощающего свет вещества, толщине слоя раствора, через который он проходит.
Закон Бугера-Ламберта-Бера лежит в основе большинства фотоколориметрических методов анализа. Математически он выражается следующим образом
![]() или
или
![]() (1)
(1)
Где I, Io - интенсивность прошедшего и падающего светового потока.
k - коэффициент поглощения , отвечает величине обратной толщине слоя , которая ослабляет интенсивность светового потока в 10 раз;
С- концентрация вещества; l- толщина слоя.
Уравнение (1) используют для вычисления концентрации С, предварительно оно преобразовывается и упрощается следующим образом:
Прологарифмируем
его:
![]()
Поменяем
знаки на обратные:
![]()
Где
![]() -
логарифм поглощения,
который
называется погашением, оптической
плотностью или экстинкцией и обозначают
буквой D.
-
логарифм поглощения,
который
называется погашением, оптической
плотностью или экстинкцией и обозначают
буквой D.
![]() ,
тогда
,
тогда
![]() =kcl
(2)
=kcl
(2)
откуда
![]()
Из уравнения (2) следует , что оптическая плотность раствора при прочих условиях прямо пропорциональна концентрации вещества . В этом случае зависимость A(D) от С имеет прямолинейный характер (1) (рис.2).
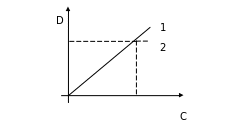
Рисунок 2. Зависимость оптической плотности от концентрации раствора.
Отношение
![]() называется
пропусканием или прозрачностью, т.к.
показывает, какая часть монохроматического
света пропускается (не поглощается)
раствором. Ее обозначают буквой Т.
Величина
Т, характеризующая пропускание слоя
толщиной 1 см, называется коэффициентом
пропускания.
Оптическая плотность и пропускание
связаны между собой уравнением:
называется
пропусканием или прозрачностью, т.к.
показывает, какая часть монохроматического
света пропускается (не поглощается)
раствором. Ее обозначают буквой Т.
Величина
Т, характеризующая пропускание слоя
толщиной 1 см, называется коэффициентом
пропускания.
Оптическая плотность и пропускание
связаны между собой уравнением:
A(D) = - lgT.
Из уравнения (2) следует, что плотность раствора прямо пропорциональна коэффициенту поглощения К, значение которого зависит от способа выражения концентрации раствора.
Если концентрация раствора выражена в молях , она называется молярным коэффициентом поглощения , обозначается и равен оптической плотности одномолярного раствора при толщине слоя 1 см, A(D) = Сl, так как l =1 см , С = 1 моль/л , то A(D) = .
Величина молярного коэффициента светопоглощения зависит от природы растворенного вещества и природы растворителя , но не зависит от толщины поглощающего слоя и концентрации растворенного вещества. Этот коэффициент характеризует способность вещества поглощать монохроматический свет. Чем больше его величина тем больше поглощение.
Если
концентрация раствора выражена в % или
количестве граммов вещества в
определенном объёме, то коэффициент
поглощения называют удельным
![]() ,
где
С концентрация вещества в
%.
,
где
С концентрация вещества в
%.
Он численно равен оптической плотности раствора, содержащего 1 г вещества в 100 мл при толщине слоя 1 см.
Между молярным и удельным коэффициентом поглощения существует следующее соотношение:
![]() ,
где М - молекулярная масса определяемого
вещества .
,
где М - молекулярная масса определяемого
вещества .
Для количественного анализа очень важно, чтобы коэффициент поглощения оставался постоянным, остается постоянным только в определенных пределах концентраций, когда соблюдается пропорциональная зависимость между A(D) и С ( т.е. на графике это прямая, выходящая из начала координат (рис. 2)).
