
- •Введение
- •Занятие №1
- •1. Тема: Определение качества лекарственных веществ и лекарственных форм рефрактометрическим и поляриметрическим методами.
- •3. Целевые задачи:
- •Определение концентрации этилового спирта в спирто-водных растворах методом рефрактометрии.
- •4. План и организационная структура занятия:
- •5. Задание для самоподготовки студентов:
- •Учебные вопросы для самоподготовки студентов:
- •5.3. Проработать тестовые задания:
- •6. Лабораторная работа.
- •7. Наглядные пособия, тс (технические средства) обучения и контроля:
- •Занятие № 2-3
- •1. Тема: Определение качества лекарственных веществ и лекарственных форм с использованием фотометрии (фэк и сф).
- •3. Целевые задачи:
- •Причины несоблюдения закона Бугера-Ламберта–Бера
- •Спектры поглощения
- •Методы определения концентраций в фэк и сф
- •Фэк и выбор условий фотометрических определений
- •Применение фотометрии в фармацевтическом анализе
- •4. План и организационная структура занятия:
- •5. Задание для самоподготовки студентов:
- •Учебные вопросы для самоподготовки студентов:
- •5.3. Проработать тестовые задания.
- •6. Лабораторная работа.
- •7. Наглядные пособия, тс обучения и контроля:
- •Занятие № 4
- •1. Тема: Определение качества лекарственных веществ и лекарственных форм с использованием хроматографиии и потенциометрии.
- •3. Целевые задачи:
- •Ионообменная хроматография
- •Подготовка сорбента
- •Подготовка колонки
- •Хроматографирование и определение содержания анализируемого вещества
- •Регенерация сорбента
- •Тонкослойная хроматография
- •Оборудование
- •Методика
- •Горизонтальное элюирование
- •Визуальная оценка
- •Теория хроматографического разделения вжх, вгжх
- •Теоретические основы потенциометрии
- •2. Стандартный потенциал электрода
- •3. Классификация электродов
- •Применение потенциометрии в фармацевтическом анализе
- •4.1. Определение рН растворов
- •4.2. Потенциометрическое титрование
- •4. План и организационная структура занятия:
- •5. Задание для самоподготовки студентов:
- •Учебные вопросы для самоподготовки студентов:
- •5.3. Проработать тестовые задания.
- •6. Лабораторная работа.
- •7. Наглядные пособия, тс обучения и контроля:
- •Занятие №5
- •6. Тестовые задания к итоговому занятию
3. Классификация электродов
Электроды, составляющие гальванический элемент, делятся на обратимые и не обратимые. По принципу применения электроды делятся на индикаторные и электроды сравнения.
Обратимоработающие элементы – это такие элементы, в которых после размыкания цепи на каждом электроде устанавливается равновесие. В обратимом элементе реакцию можно прекратить, присоединив к нему внешний источник тока с таким же значением ЭДС, но противоположного направления. Если увеличить ЭДС внешнего источника тока на малую величину, то реакция пойдет в обратном направлении. Если после размыкания цепи процесс на электродах продолжается, а при изменении направления электрического тока протекают другие реакции, не обратные друг другу, то элемент является необратимым. Примером обратимого элемента является элемент Якоби-Даниеля, в котором при изменении направления тока реакция Zn0 + Сu ↔ Сu0 + Zn2+ меняет направление.
Все обратимые электроды, в свою очередь, делятся на следующие группы: электроды первого и второго рода, окислительно-восстановительные и ионселективные.
Электроды первого рода. Водородный газовый электрод.
К электродам первого рода относят металлические электроды, обратимые относительно катионов, и металлоидные, обратимые относительно анионов. Обратимость электрода относительно тех или других ионов означает зависимость его потенциала от концентрации данных ионов. Примерами металлических электродов типа М | М2+ являются рассмотренные ранее Zn0 | Zn2+ ; Cu0 | Cu2+ ; Ag0 | Ag+ и др. Электродный потенциал их определяется уравнением:
![]()
И он зависит только от концентрации (активности) одного вида ионов металла.
Для электродов, обратимых относительно анионов, применяют уравнение:
![]()
К электродам первого рода относят также газовые электроды, которые могут быть обратимы по отношению к катиону или аниону. Их создают по схеме (металл) газ/раствор. Металл в газовых электродах необходим как переносчик электронов и для создания поверхности, на которой протекает реакция. Металл должен быть инертным по отношению к веществам, находящимся в растворе.
Типичным примером газового электрода является водородный электрод (Pt) H2| H+. Он состоит из платиновой пластинки, опущенной в раствор кислоты с активностью иона водорода, равной единице (стандартный водородный электрод) (рис. 13).

Рисунок 13. Стандартный водородный электрод.
Водородный электрод, применяемый на практике, с аН+ ≠ 1 может иметь разные конструкции. Наиболее простая конструкция (рис. 14) представляет собой платиновую пластинку, электролитически покрытую платиновой чернью для увеличения поверхности, погруженную в раствор с определенной активностью ионов водорода. Платиновая пластинка омывается током водорода.

1,3 – стеклянные трубки;
2 – патрубок для ввода водорода;
4 – платиновый электрод;
5 – сосуд с исследуемым раствором.
Рисунок 14. Водородный электрод: (аН+ ≠ 1)
Механизм возникновения потенциала на водородном электроде заключается в следующем: молекулярный водород адсорбируется платиной, распадается на атомы, которые окисляются; образовавшиеся ионы гидратируются молекулами воды, переходят в раствор подобно тому, как они переходят из кристаллической решетки металла; ионы водорода могут также переходить из раствора на поверхность платины, образуя двойной электрический слой с соответствующим скачком потенциала.
Электроды второго рода. Каломельный и хлорсеребряный электрод.
Электроды второго рода состоят из металла, труднорастворимой соли этого металла и второго соединения, хорошо растворимого и с тем же анионом, что и первое соединение. Условное обозначение таких электродов М | МА | AgZ-. Представителями электродов второго рода являются хлорсеребряный и каломельный электроды.
Благодаря простоте изготовления и отличной воспроизводимости потенциала их широко применяют в качестве электродов сравнения при составлении разнообразных гальванических элементов, а также вместо СЭВ (стандартный водородный электрод) при определении потенциалов других электродов.
Хлорсеребряный электрод: Ag | AgCl | KCl (рис. 15)

1 – серебряная проволока;
2 – слой AgCl;
3 – раствор KCl;
4 – микрощель.
Рисунок 15. Хлорсеребряный электрод
Хлорсеребряный электрод представляет собой серебряную проволоку, покрытую слоем AgCl, опущенную в насыщенный раствор KCl, находящийся в сосуде с микрощелью для контакта с исследуемым раствором. Основному химическому процессу Ag + ē ↔ Ag (1)
сопутствует реакция растворения или осаждения соли AgCl:
AgCl = Ag+ + Cl- (3)
Суммарный процесс:
AgCl + e- = Ag+ + Cl- (4)
Определяет вид уравнения для расчета потенциала электрода, обратимого относительно аниона:
![]()
Хлорсеребряный электрод обратим относительно Cl- (хлорид-ион), полученных при диссоциации KCl, равновесие (3) сильно сдвинуто влево, концентрация ионов Ag+ становится весьма малой, а концентрация ионов Cl- можно считать равной концентрации растворенного KCl.
К аломельный
электрод .(Pt).Hg° | Hg2Cl2
| KCl
(рис. 16)
аломельный
электрод .(Pt).Hg° | Hg2Cl2
| KCl
(рис. 16)
1 – платина
2 – медный проводник
3 – стеклянная трубка
4 – раствор KCl
5 – паста
6 – ртуть.
Рисунок 16. Каломельный электрод
Каломельный электрод представляет собой смесь Hg° и Hg2Cl2, помещенную в сосуд, в дно которого впаяна платина, приваренная к медному проводнику. С целью изоляции на медную проволоку надевают стеклянную трубку, которую припаивают к сосуду и в которой проволоку закрепляют неподвижно. Платина в каломельном электроде служит переносчиком электронов. В сосуд наливают ртуть так, чтобы платина была ею покрыта. На ртуть помещают пасту, полученную растиранием ртути с каломелью в насыщенном растворе KCl, а затем насыщенный раствор KCl. Сосуд закрывают пробкой с отверстием для солевого мостика. Для каломельного электрода:
![]()
Окислительно-восстановительные электроды (редокс-электроды).
Поскольку все потенциалопределяющие процессы протекают с участием электронов, каждый электрод может быть назван окислительно-восстановительным. Однако окислительно-восстановительными условились называть такие электроды, металл которых не принимает участия в окислительно-восстановительной реакции, а являются только переносчиком электронов, процесс же окисления-восстановления протекает между ионами, находящимися в растворе. Чаще применяют платиновый или золотой электроды.
Хингидронный электрод. Pt | C6H4O2, C6H4(OH)2, H+ или (Pt) | X, H2X, H+
Состоит из платиновой пластинки (или проволоки), погруженной в насыщенный раствор хингидрона.
Хингидрон
представляет собой комплексное
соединение, образованное из хинона
C6H4O2
(Х) и его восстановленной формы гидрохинона
C6H4(OH)2
(H2X)
гидрохинона. При диссоциации хингидрона
H2X
*
![]() H2X+X
образуется эквимолекулярная смесь
хинона и гидрохинона. Хингидрон трудно
растворим в воде и в кислых растворах,
поэтому легко получается насыщенный
раствор.
H2X+X
образуется эквимолекулярная смесь
хинона и гидрохинона. Хингидрон трудно
растворим в воде и в кислых растворах,
поэтому легко получается насыщенный
раствор.
На хингидронном электроде протекает реакция:
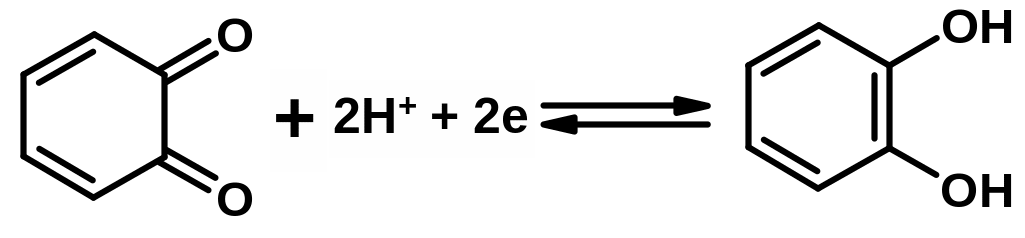
Его потенциал равен:
![]()
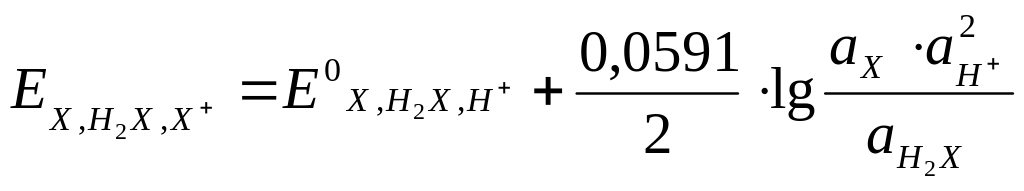
В
кислой среде реакция восстановления
хинона смещается вправо и X, H2X,
H+
имеет положительный заряд. В щелочной
среде указанная реакция идет в обратном
направлении и
![]() имеет
отрицательное значение.
имеет
отрицательное значение.
При рН > 8 хингидронный электрод применять невозможно из-за наличия побочной реакции, нарушающей эквимолекулярность между Н2Х и Х:
C6H4(OH)2 + 2ОН- = C6H4O22- + 2Н2О,
Его нельзя применять для исследования щелочных растворов и в присутствии посторонних окислителей и восстановителей.
Ионнообменные электроды (ионселективные). Стеклянный электрод.
К ионнообменным относят такие электроды, которые состоят из двух фаз: ионита и раствора, а потенциал на границе раздела фаз возникает за счет ионообменного процесса, в результате которого поверхности ионита и раствора приобретают электрические заряды противоположного знака. Иониты обладают повышенной избирательной способностью по отношению к определенному виду ионов, находящихся в растворе, поэтому электроды называют также ионселективные.
Ионселективные электроды позволяют определять концентрации различных ионов в прямой потенциометрии. В настоящее время их используется несколько сотен, а наиболее часто применяют стеклянный электрод, обратимый относительно ионов натрия, калия, кальция и др. (рис. 17).

1 – внутренний электрод
2 – внутренний раствор – 0,1 М р-р НCl
3 – стеклянная мембрана
4 – сосуд с исследуемым раствором.
Рисунок. 17. Стеклянный электрод
Стеклянный электрод [ Ag | AgCl | HCl (c = 0,1 моль/л) | стекло | H+ ] представляет собой тонкостенный шарик из специального сорта тонкопроводящего стекла, наполненный раствором НCl концентрации 0,1 моль/л. В раствор НCl погружен вспомогательный хлорсеребряный электрод, который служит внешним выводом к одному из полюсов прибора для измерения потенциала.
Стеклянный электрод помещают в исследуемый раствор с неизвестной концентрацией определяемых ионов, в который помещают также электрод сравнения (хлорсеребряный или каломельный). Электрод сравнения присоединяют к другому полюсу. Таким образом, гальванический элемент, в котором один из электродов стеклянный, включает два электрода сравнения (внутренний и внешний).
Применение стеклянного электрода, как индикаторного, основано на том, что содержащиеся в структуре стекла катионы K+, Na+, Li+ могут обмениваться с катионами раствора (Н+), в то время как анионы, составляющие прочную основу стекла, в обмене с анионами раствора участвовать не могут. Обмен катионов между стеклом и раствором происходит в соответствии с равновесными отношениями их концентраций в стекле и растворе, которые характеризуются коэффициентами распределения.
Чтобы стекло электрода функционировало, как рН-электрод, оно должно быть гидратировано. Гидратирование осуществляется путем выдерживания электрода в течение нескольких часов в воде, а затем в 0,1 М растворе HCl. В итоге на внешней поверхности стеклянного шарика создается насыщенный слой адсорбированных ионов водорода, создающих определенный и постоянный заряд. Его можно измерить благодаря наличию электрода сравнения.
Стеклянный электрод применяют и как электрод сравнения (табл. 5) так как в раствор 0,1 моль/л HCl погружен хлорсеребряный электрод.
