
- •Курсовая работа
- •Введение
- •1 Краткая характеристика фенола
- •1.1 Физические и химические свойства
- •1.2 Токсичность фенола
- •1.3 Методы получение фенола
- •1.4 Применение фенола
- •2 Краткая характеристика ацетона
- •2.1 Физические и химические свойства ацетона
- •2.2 Токсичность ацетона
- •2.3 Пожароопасность ацетона
- •2.4 Методы получения
- •3 Совместное получение фенола и ацетона
- •1 Стадия – получение кумола
- •2 Стадия – каталитическое окисление
- •3.1 Характеристика используемого сырья
- •3.2 Описание процесса
- •3.3 Описание технологического процесса
- •3.4 Преимущества и недостатки метода
- •3.5 Отходы производства и их утилизация
- •Заключение
- •Список использованной литературы
3 Совместное получение фенола и ацетона
Кумольный метод получения фенола совместно с ацетоном включает стадии: алкилирование бензола в кумол (ИПБ), окисление кумола в гидропероксид кумола (ГПИПБ) и последующее его разложение на фенол и ацетон:
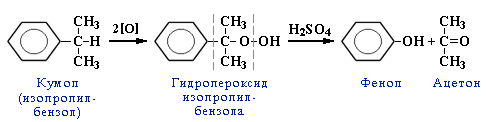
1 Стадия – получение кумола
C6H6 + CH3-CH=CH2 t,kat-AlCl3→ C6H5-CH-CH3
│
CH3
(изопропилбензол – кумол)
2 Стадия – каталитическое окисление
CH3
│
C6H5-CH-CH3 + O2130,kat → [C6H5- C- O-O-H ] 65,H2SO4→ C6H5-OH + CH3-C-СН3
│ │ ║
CH3 CH3 О
Неустойчивое соединение фенол ацетон
Впервые этот метод был открыт и разработан в СССР, группой химиков, в которую входили П.Г. Сергеев, Р.Ю. Удрис и Б.Д. Кружалов [3].
На Западе кумольный метод был разработан в конце 40-х годов и известен как процесс Хока по имени немецкого учёного, независимо открывшего кумольный метод синтеза фенола-ацетона. В промышленном масштабе этот метод стал впервые использоваться в США в начале 50-х годов [1].
3.1 Характеристика используемого сырья
Для совместного производства фенола и ацетона является изопропилбензол и кислород воздуха [4].
Изопропилбензол C6H5CH(CH3)2, иначе называемый кумолом, представляет собой бесцветную горючую жидкость, практически нерастворимую в воде (менее 0,01 %), смешивается со спиртом, эфиром, бензолом. Температура кипения — 152,4 °C. Его получают жидкофазным (катализатор: хлорид алюминия(III)) или парофазным (катализатор: цеолиты, фосфорная кислота на кизельгуре) алкилированием бензола пропиленом:
С6Н6 + СН3-СН=СН2 → С6Н6-СН(СН3)2.
Первоначально изопропилбензол применяли в качестве высокооктановой добавки к моторным топливам, а в настоящее время основным его потребителем является химическая промышленность. Изопропилбензол перерабатывают в а-метилстирол С6Н6-С(СН3)=СН2 (мономер для синтетического каучука) и особенно в больших количествах - в изопропилфенилгидропероксид (гидропероксид кумола) С6Н5-С(СН3)2-ООН, из которого получают фенол и ацетон.
3.2 Описание процесса
Процесс производства фенола и ацетона кумольным методом состоит из следующих стадий: алкилирование бензола, окисление изопропилбензола, выделение гидропероксида, разложение гидропероксида, нейтрализация гидропероксида, выделение фенола, выделение ацетона (рис.1) [2].
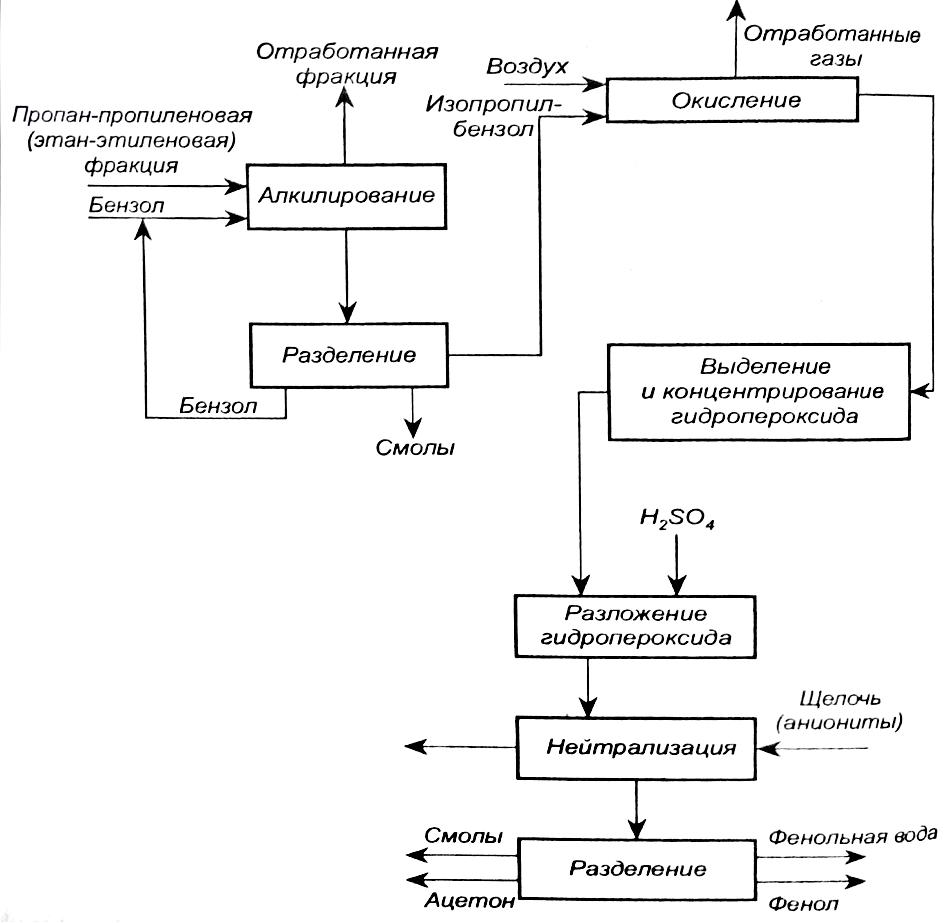
Рис.1. Блок схема совместного производства фенола и ацетона.
1. Алкилирование бензола пропиленом
Для окисления используется изопропилбензол, полученный алкилированием бензола пропиленом в присутствии хлористого алюминия, что обусловлено требованиями, предъявляемыми к его чистоте. В частности,
C6H6 + CH3-CH=CH2 → C6H6(CH3)2CH
изопропилбензол, полученный на этом катализаторе, не содержит непредельных углеводородов [5].
2. Окисление изопропилбензола
Реакция окисления изопропилбензола:
C6H6(CH3)2CH +O2 → C6H5(CH3)2COOH
протекает по механизму сложных цепных реакций с вырожденным разветвлением цепи. Получить 100 %-ную селективность по гидропероксиду в реакции окисления изопропилбензола невозможно, так как параллельно с основным образуются такие побочные продукты, как диметилфенилкарбинол, ацетофенон, муравьиная кислота, в незначительной степени пероксидные продукты типа дикумилпероксида.
В промышленных условиях в настоящее время селективность стадии окисления изопропилбензола по гидропероксиду составляет 91-95% (мол.). Такая селективность обеспечивается конструктивным оформлением реактора, использованием оптимальных концентраций гидропероксида в реакционной массе (15-25%), оптимальной температуры (100-120 °С) и наиболее активного катализатора.
Окисление можно проводить как в жидкой, так и паровой фазе на разных катализаторах. Наиболее широко в качестве катализаторов процесса, проходящего в жидкой фазе при температурах выше 100 °С (100-120°С), применяются резинаты и нафтенаты кобальта и марганца. Используют и инициаторы, например сами гидропероксиды, которые добавляют в шихту в количестве 2,5-3,5%.
Образующийся гидропероксид изопропилбензола частично подвергается термическому разложению. С повышением температуры скорость распада гидропероксида возрастает. Основными продуктами распада гидропероксида изопропилбензола являются диметилфенилкарбинол, ацетофенон и метиловый спирт:
С6H5 (СH3)2 COOH → C6H5(CH3)2COH
С6H5 (СH3)2 COOH → C6H5COCH3 + CH3OH
Образующийся метанол окисляется в формальдегид и муравьиную кислоту, являющуюся ингибитором процесса окисления изопропилбензола.
Как уже отмечалось, на выход гидропероксида влияют температура и продолжительность окисления (рис.2). Однако чрезмерное понижение температуры уменьшает скорость реакции. Так, за 1 час при t=120 °С выход гидропероксида составляет 8-10, а при t=100 °С - 2-3 % (мас.) [2].
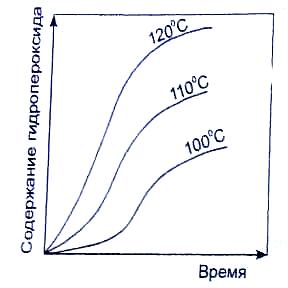
Рис.2. Зависимость содержания гидропероксида в реакционной массе от продолжительности окисления при различной температуре.
Распад гидропероксида начинает заметно протекать при его концентрации в реакционной массе 18% и выше. При повышенных температурах его распад сопровождается взрывом. Даже при оптимальной концентрации пероксида в оксидате содержится от 0,5 до 5% продуктов распада. Процессу окисления благоприятствует щелочная среда (рН=7,5), так как нейтрализуются кислоты-ингибиторы, образующиеся в процессе окисления. В этом случае осуществляется совмещенный процесс, так как параллельные реакции нейтрализации позволяют ускорять основную реакцию. В связи с этим окисление иногда ведут кислородом воздуха в водно-щелочной эмульсии (1%-ный раствор Na2CO3) при интенсивном перемешивании и в присутствии поверхностно-активных веществ.
Таким образом, процесс окисления чаще всего проводят при 120-130 °С, Р= 0,5-1 МПа, рН = 8,5-10,5. В этих условиях конечное содержание гидропероксида составляет около 25 %.
Известен также способ получения ГП ИПБ окислением изопропилбензола молекулярным кислородом в присутствии катализатора - нанопорошка железа с удельной поверхностью от 4,7 до 6,9 м2/г, полученного электровзрывом проводника в атмосфере азота, при температуре 50-60°С [6].
Для проведения процесса окисления применяются следующие реакторы (рис.3): колонного типа; с перемешивающим устройством (каскад реакторов); эрлифтового типа [2].
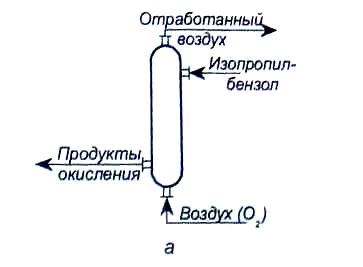
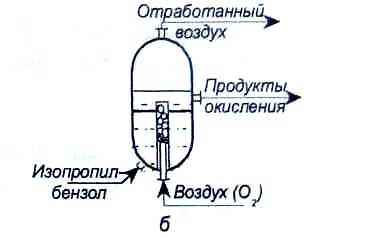
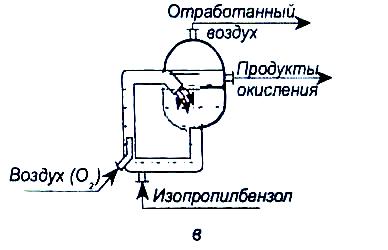
Рис.3. Реакторы окисления: а - колонного типа: б- с перемешивающим устройством; в - эрлифтового типа.
В колонных аппаратах для отвода тепла устанавливаются змеевики (отводится 1967 кДж на 1 кг превращенного изопропилбензола). Реактор колонного типа является компактным. Каскад аппаратов с перемешивающими устройствами или каскад реакторов эрлифтового типа требуют использования большого количества арматуры. Управлять процессом в таких реакторах сложно.
Учитывая то, что в оксидате содержится около 25 % пероксида, а на дальнейшую переработку должен подаваться концентрированный раствор, проводят его концентрирование в мягких условиях (в вакууме, при низких температурах). Наиболее широко для этой цели используют вакуумную ректификацию (чаще всего на двухколонной установке). Получаемый технический гидропероксид имеет следующий состав (в %): гидропероксид изопропилбензола - 90-91; диметилфенилкарбинол - 5-7; ацетофенон - 1,0-1,5; дикумилпероксид - 0,4-0,6; муравьиная кислота - 0,01-0,04.
3. Разложение гидропероксида изопропилбензола
Технический гидропероксид изопропилбензола направляют на сернокислотное разложение, в результате которого образуется фенол и ацетон, а также побочные продукты: а - метилстирол, кумол-фенол, димеры а – метилстирола и смолы:
С6Н5(СН3)2СООН H2SO4 → С6Н5ОН + СН3СОСН3
Веществом, ответственным за образование 80-85% побочных продуктов, является присутствующий в техническом гидропероксиде изопропилбензола диметилфенилкарбинол. Ацетофенон в условиях окисления практически не превращается в другие продукты, в то время как 30-40% диметилфенилкарбинола превращается в а-метилстирол, последний выделяют в виде товарного продукта или в виде углеводородной фракции совместно с изопропилбензолом.
Механизм разложения гидропероксида может быть представлен следующим образом:
1) образование оксониевого иона и его дегидратация:
CH3 CH3 CH3
│ │ │
C6H5-C-OOH + H+ = C6H5-C-OOH2 = C6H5-C-O+ + H2O
│ │ │
CH3 CH3 CH3
2) перегруппировка образовавшегося иона с миграцией фенильной группы к кислородному атому:
CH3 CH3
│ │
C6H5-C-O+ → С6H5O-С+
│ │
CH3 CH3
3) взаимодействие иона карбония с молекулой гидропероксида:
CH3 CH3 CH3 CH3
│ │ │ │
C6H5-+C + C6H5-C-OOH → C6H5O-C-OH + C6H5-C-O+
│ │ │ │
CH3 CH3 CH3 CH3

C6H5OH + CH3-CO-CH3
Разложение гидропероксида проводят в присутствии раствора серной кислоты в ацетоне. Разложение в присутствии слабых кислот (щавелевая, метафосфорная и др.) протекает при высоких температурах (100-120 °С) и с низкими выходами фенола и ацетона. Максимальные выходы фенола и ацетона достигаются при концентрации H2SO4, равной 0,07-0,1 % от массы гидропероксида.
Выходы целевых продуктов зависят также от температуры. Так, при повышении температуры процесса разложения с 50 °С до 80 °С выход ацетона снижается с 98-99 % до 89 % (что составляет ≈ 10 %), а фенола - с 98 до 80-82 %. Вместе с тем при низких температурах (≈ 30 °С) резко возрастает продолжительность процесса и в реакционной массе остается неразложившейся гидропероксид. Поэтому оптимальной для процесса разложения является температура 50-60 °С. На разложение чаще всего подают разбавленный (в том числе и продуктами реакции) гидропероксид, чтобы избежать взрыва.
Разложение проводят в реакторах трех типов, отличающихся способом отвода тепла реакции. Так, в адиабатических реакторах (рис.4, а) тепло отводится за счет циркуляции реакционной массы. В проточно-циркуляционной установке (рис.4, б) тепло отводят, охлаждая - водой трубчатый реактор: При этом часть реакционной смеси отводится на дальнейшую переработку, а остальная часть - на рециркуляцию. В этом случае рециркуляция повышает выход побочных веществ.
Более совершенным является изотермический реактор (рис.4, в), в котором тепло отводится за счет испарения избытка ацетона. Такой реактор можно секционировать поперечными перегородками, что снижает выход побочных продуктов за счет уменьшения времени контакта. Выход фенола и ацетона в этом реакторе может достигать 98% от теоретического.
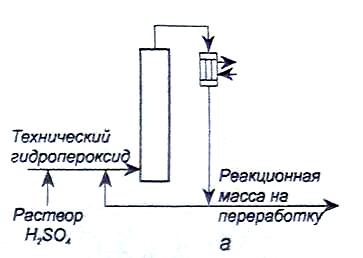
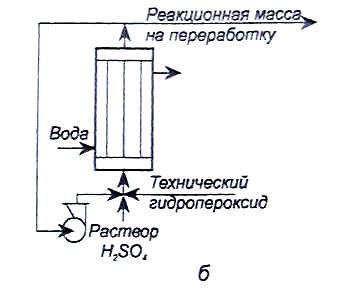

Рис.4. Реакторные узлы для разложения гидропероксида изопропилбензола: а – адиабатический реактор;
б – проточно-циркуляционный реактор;
в – изотермический реактор.
Гидроперекись выделяют двумя способами. Первый способ — обработка реакционной массы 30—35%-ным водным раствором едкого натра, образующим с гидроперекисью натриевую соль
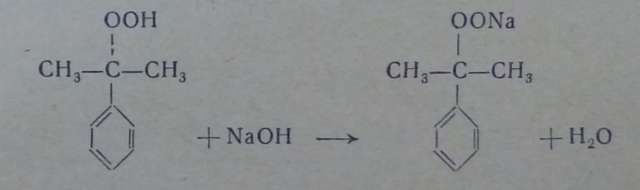
легко отделяющуюся от углеводородного слоя. Для выделения свободной гидроперекиси через водный раствор этой соли пропускают двуокись углерода:
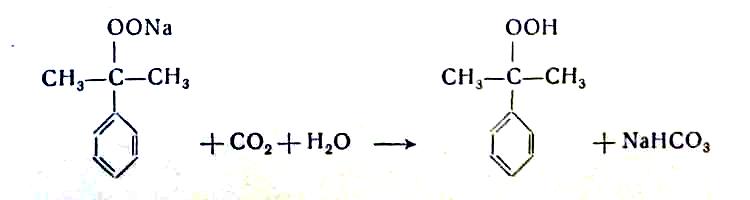
Этот способ дает возможность получать гидроперекись высокой чистоты, но требует больших затрат щелочи и двуокиси углерода.
