
- •Курсовая работа
- •Введение
- •1 Краткая характеристика фенола
- •1.1 Физические и химические свойства
- •1.2 Токсичность фенола
- •1.3 Методы получение фенола
- •1.4 Применение фенола
- •2 Краткая характеристика ацетона
- •2.1 Физические и химические свойства ацетона
- •2.2 Токсичность ацетона
- •2.3 Пожароопасность ацетона
- •2.4 Методы получения
- •3 Совместное получение фенола и ацетона
- •1 Стадия – получение кумола
- •2 Стадия – каталитическое окисление
- •3.1 Характеристика используемого сырья
- •3.2 Описание процесса
- •3.3 Описание технологического процесса
- •3.4 Преимущества и недостатки метода
- •3.5 Отходы производства и их утилизация
- •Заключение
- •Список использованной литературы
2.2 Токсичность ацетона
Считается, что ацетон малотоксичен, также считается, что он не вызывает хронических болезней при использовании основных методов предосторожностей при работе с ним. Ацетон обладает возбуждающим и наркотическим действием (что особенно хорошо проявляется при хроническом воздействии на людей, часто работающих с ацетоном как с растворителем), поражает центральную нервную систему, способен накапливаться в организме, в связи с чем токсическое действие зависит не только от его концентрации, но и от времени воздействия на организм. ЛД50 для мышей при вдыхании в течение 4-х часов — 44 г/м³. Для человека ЛД50 оценивается в 1,159 г/кг. Предельно допустимая концентрация ацетона в воздухе рабочей зоны равна 200 мг/м³, предельно допустимая концентрация ацетона максимально – разовая равна 0,35 мг/м³, предельно допустимая концентрация ацетона среднесуточная равна 0,35 мг/м³.
Ацетон при высоких концентрациях (при более чем кратковременном воздействии) раздражает органы дыхания и вызывает жжение в глазах, при более длительном воздействии происходит кратковременный глазной отёк. Вероятно, способен вызывать головокружение, тошноту и дезориентацию при воздействии паров высоких концентраций.
В природные воды ацетон поступает со сточными водами фармацевтических, лесохимических производств, производства лаков и красок, пластмасс, кинопленки, ацетилена, ацетальдегида, уксусной кислоты, оргстекла, фенола, ацетона.
В концентрациях 40-70 мг/дм3 ацетон придает воде запах, 80 мг/дм3 — привкус. В воде ацетон малостабилен — при концентрациях 20 мг/дм3 на 7 сутки исчезает.
Для водных организмов ацетон сравнительно малотоксичен. Токсические концентрации для молодых дафний 8300, для взрослых 12900 мг/дм3; при 9300 мг/дм3 дафнии гибнут через 16 часов.
ПДКв – 2,2 мг/дм3 (лимитирующий показатель вредности – общесанитарный), ПДКв – 0,05 мг/дм3 (лимитирующий показатель вредности – токсикологический) [1].
2.3 Пожароопасность ацетона
Одна из основных опасностей при работе с ацетоном — его легковоспламеняемость. Температура 465 °C, температура вспышки − 19 °C. Воздушные смеси, содержащие от 2,5 % до 12,8 % (по объёму) взрывоопасны. С этим необходимо считаться, так как ацетон быстро испаряется, и образующееся облако может распространиться до места воспламенения (нагрев или искра) вдали от места работы с ним [1].
2.4 Методы получения
1. Брожение крахмала. Метод ферментативного брожения является самым старым методом получения ацетона, используемым в промышленных масштабах. В результате жизнедеятельности некоторых видов бактерий крахмал превращается в ацетон и н-бутиловый спирт. В качестве сырья для этого процесса чаще всего применяют кукурузную муку.
2. Производство ацетона из изопропилового спирта.
а) каталитическое дегидрирование изопропилового спирта.
Метод каталитического дегидрирования изопропилового спирта в ацетон осуществляется в промышленности США с 1923 г. и получил широкое распространение в других странах.
Процесс протекает в одну стадию по реакции:

В качестве катализатора используется главным образом окись цинка, осаждённая на пемзе.
Выход ацетона составляет около 90%. На 1т ацетона расходуется 1,1 – 1,2т изопропилового спирта или около 0,9т пропилена.
б) Неполное окисление изопропилового спирта в паровой фазе.
Реакция неполного окисления изопропилового спирта:
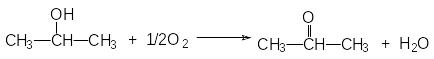
Она протекает в присутствии металлических катализаторов – меди, серебра, никеля и т д.
Высокий выход ацетона достигается при использовании серебра, осаждённого на пемзе, или серебряной сетки. Температура реакции может изменяться в широких пределах (450-650 0C ) и выбирается в зависимости от применяемого катализатора, объёмной скорости паров спирта и воздуха и других факторов.
в) Неполное окисление изопропилового спирта в жидкой фазе. Этот метод, применяемый для производства перекиси водорода, осуществляется с 1957 года на заводе фирмы «Shell Chemical Co.» в США.
Процесс протекает по схеме:

Протекает автокаталитически при 90-140 0C под давлением, позволяющим удерживать смесь в жидкой фазе. В качестве окислителя можно применять как воздух, так и кислород.
Выход ацетона составляет 95% от теоретического, выход перекиси водорода около 87%.
3. Производство ацетона из уксусной кислоты. Процесс проводят путём пропускания паров уксусной кислоты над окисью церия при 400-450 0C и атмосферном давлении:

Выход ацетона достигает 95% от теоретического
4. Прямым окислением пропена в жидкой фазе в присутствии PdCl2 в среде растворов солей Pd, Cu, Fe при температуре 50-120 °C и давлении 50-100 атм:
CH3CH=CH2 + PdCl2 + H2O → CH3C(O)CH3 + Pd + 2HCl
Pd+2HCl + 0.5O2 → PdCl2 + H2O
2.5 Применение ацетона
Ацетон применяется как сырьё для синтеза многих важных химических продуктов, таких как уксусный ангидрид, диацетоновый спирт, окись мезитила, метилизобутилкетон, метилметакрилат, дифенилпропан, изофорон, и др.; пример:
(CH3)2CO + 2 C6H5OH → (CH3)2 C(C6H4OH)2 + H2O.
Ацетон также является популярным растворителем, значительно превосходящим в плане безопасности бензин, скипидар и отчасти керосин. В частности как растворитель используется он:
в производстве лаков
в производстве взрывчатых веществ
в производстве лекарственных препаратов
в составе клея для киноплёнок как растворитель ацетата целлюлозы и целлулоида;
компонент для очистки поверхностей в различных производственных процессах;
как очиститель инструмента и поверхностей от монтажной пены — в аэрозольных баллонах.
Без ацетона невозможно хранить в компактном (сжиженном и в баллоне) состоянии ацетилен, который не может храниться под давлением в чистом виде из-за опасности взрыва. Для этого используют ёмкости с пористым материалом, пропитанные ацетоном. 1 литр ацетона растворяет до 250 литров ацетилена [1].
Из рассмотренных методов получения фенола и ацетона можно сделать вывод:
При получении фенола через бензолсульфокислоту необходимо расходовать большие количества таких веществ, как серная кислота, едкий натр, сернистый газ; аппаратура подвергается интенсивной коррозии, целый ряд процессов оформляется периодически, условия проведения отдельных стадий процесса весьма жестки.
Синтез фенола омылением хлорбензола связан с расходом значительных количеств хлора, щелочи, соляной кислоты. Использование в процессе сильно агрессивных веществ требует применения дорогих антикоррозионных материалов. Недостатком является также работа под высоким избыточным давлением (до 300 ат).
Метод Рашига характеризуется использованием в процессе больших количеств хлористого водорода, коррозией, жесткими условиями проведения реакции и низкой конверсией за один проход, что обусловливает высокие энергозатраты.
Методы синтеза ацетона из пропилена через изопропиловый спирт включают производство изопропилового спирта, при получении которого сернокислотной гидратацией пропилена необходимо применять и подвергать упарке большие количества серной кислоты. Превращение изопропилового спирта в ацетон протекает в жестких условиях с использованием дорогих катализаторов.
Кумольный метод выгодно отличается от перечисленных методов мягкими условиями проведения всех стадий процесса, применением значительно меньших количеств серной кислоты и щелочи, отсутствием хлора и соляной кислоты. Коррозия аппаратуры, возникающая при алкилировании вследствие гидролиза катализатора (хлористого алюминия) и при окислении в результате побочно образующейся муравьиной кислоты, менее интенсивна и предотвращается легче, чем коррозия аппаратуры при работе по указанным методам [2].
Метод совместного получения фенола и ацетона через изопропилбензол является наиболее экономичным из применяемых в настоящее время в промышленности методов синтеза фенола и ацетона.
