
- •Отримання та властивості колоїдних систем. Колоїдні пар. Харчові емульсії Основні питання:
- •Колоїдні пар
- •Іоногенні колоїдні пар:
- •Емульсії – мікрогетерогенні системи, що складаються з двох рідин, що взаємно не змішуються.
- •Типи емульсій:
- •Молоко – полідисперсна система
- •Майонез
- •Маргарин ‑ емульсія типу в/м:
Отримання та властивості колоїдних систем. Колоїдні пар. Харчові емульсії Основні питання:
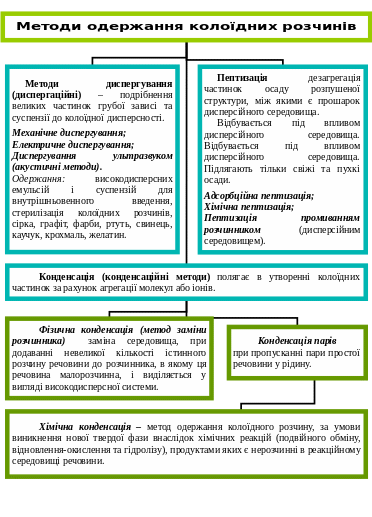
Отримання та властивості колоїдних систем.
Колоїдні ПАР.
Застосування ПАР у харчовій промисловості (емульгатори).
Харчові емульсії.
Дисперсні системи – системи, що складаються з дисперсної фази та дисперсійного середовища.


Метод вільного електрофорезу, оснований на різниці у швидкостях руху (рухомості) білків в електричному полі, що визначається величиною заряду білка при певних значеннях рН і іонної сили розчину. Останнім часом найбільше поширення одержали методи зонального електрофорезу білків на різних носіях, зокрема на твердих середовищах: гелях крохмалю і поліакриламіду, целюлозі.
Переваги: виключається розмивання межі поділу білок-розчинник, не потребує налаштування складної апаратури для визначення положення границі; для аналізу необхідна незначна кількість білка.
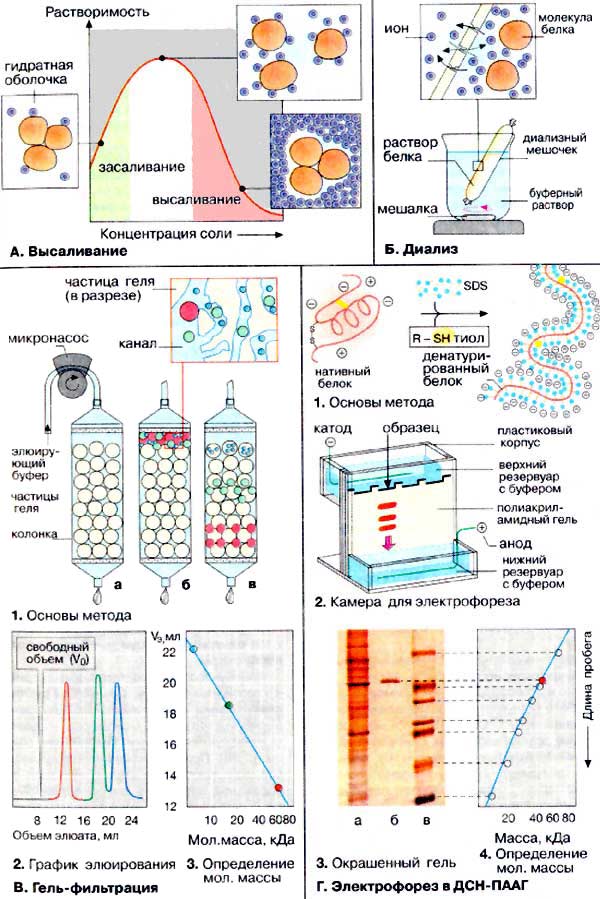
Очистка білків від низькомолекулярних домішок
Для повного очищення білків від низькомолекулярних домішок використовують методи діалізу, гель хроматографії, кристалізації, ультрафільтрації. При діалізі використовують напівпроникні мембрани (целофан, колодійна плівка), діаметр пор, яких змінюється в широких межах. Білки, як правило, не дифундують через таку мембрану, але низькомолекулярні речовини легко проникають через неї у зовнішнє середовище..
Метод кристалізації білків оснований на досягненні критичної точки початку осадження білка з розчину сульфату амонію при повільному підвищенні температури. Уже отримані сотні кристалічних білків.
Найкращі результати при вивільненні білків від низькомолекулярних домішок одержують за допомогою гель хроматографії та ультрафільтрації
Метод ультрафільтрації базується на продавлюванні розчинів білка через спеціальні мембрани, які затримують білкові молекули, і дозволяють не тільки звільнити білкові розчини від низькомолекулярних домішок але і концентрувати їх.
Частинки в розчині осаджуються (седиментація), якщо їх густина вища за густину розчину, або спливають (флотація), якщо їх густина нижча, ніж густина розчину. Чим більша різниця в густинах, тим швидше проходить розділення часточок. Якщо густини часточок і розчину однакові, то часточки залишаються нерухомими і їх можна розділити тільки в центрифузі, яка створює відцентрову силу, що набагато перевищує силу земного тяжіння.

|
При очищенні білків від домішок широко використовують метод молекулярних сит (гель-хроматографія). При обробці декстрину (полісахарид) епіхлоргідрином утворюються повздовжні зв’язки, які приводять до формування крупних гідрофільних зерен, нерозчинних у воді (сефадекс). Сефадекс попередньо замочують у воді, утвореним гелем заповнюють хроматографічну колонку. Розділення цим методом базується на тому, що великі молекули не проникають у внутрішню водну фазу гелю (стаціонарна), і залишаються в рухомій фазі і рухаються разом з нею вздовж колонки. А невеликі молекули вільно дифундують в зерна, утворюючи рівноважну систему між рухомою і стаціонарною фазами і відповідно з меншою швидкістю рухаються вздовж колонки. Спочатку виходять молекули з більшими молекулярними масами і розмірами. |
Гель-хроматографія на колонці з сефадексом |
|

