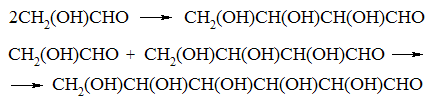- •Органічна хімія Опорні лекції Оксигенвмісні органічні сполуки
- •Реакції атома Гідрогену гідроксигрупи (реакції заміщення):
- •Реакції окислення:
- •Реакції радикала спирту
- •Окремі представники спиртів
- •Двоатомні та триатомні спирти. Багатоатомні спирти
- •Сн2он – сн (сн3) – снон ‑ сн2он
- •Окремі представники двоатомних, триатомних і багатоатомних спиртів
- •Дегідратація спиртів за допомогою мінеральних кислот:
- •Взаємодія алкоголятів з галогеналкілами:
- •Окремі представники етерів
- •Тіоспирти та тіоетери
- •Кумольний (кумельний) метод:
- •Одержання з ароматичних сульфосолей
- •Окремі представники фенолів
- •Альдегіди
- •Суміш вуглеводів
- •Окремі представники альдегідів
- •Окремі представники кетонів
- •Карбонові кислоти та їх похідні
- •Залежно від кількості карбоксильних груп:
- •Залежно від насиченості:
- •Одноосновні насичені кислоти
- •Реакції заміщення гідроксилу карбоксильної групи:
- •Реакції заміщення атому Гідрогену в α-положенні:
- •Реакції окислення:
- •Окремі представники одноосновних карбонових кислот
- •Двоосновні насичені кислоти
- •Окремі представники двоосновних насичених кислот
- •Ненасичені одноосновні кислоти
- •Окремі представники одноосновних ненасичених кислот
- •Ароматичні карбонові кислоти
- •Солі карбонових кислот. Мила. Миючі засоби
- •Гідроліз (омилення) жирів при наявності лугів:
- •Дією соди на вищі жирні кислоти:
- •Класифікація мийних засобів
- •Естери (складні ефіри)
- •Окремі представники естерів
- •Гідроксикислоти
- •Реакції, що характерні для карбоксильної групи:
- •Утворення хлорангідридів:
- •Утворення амідів:
- •Реакції, що характерні для спиртових гідроксилів:
- •3. Реакції, що характерні лише для гідроксикислот:
- •Окремі представники гідроксикислот
- •С6н12о6 → 2сн3 – снон – соон
- •Оптична (дзеркальна) ізомерія
заміщення на атом галогену:
СН3 – СН2 – CH2 ‑ COH + СІ2 → СН3 – СН2 – CHСІ – CОН + НСІ
бутаналь 2-хлорбутаналь
реакція заміщенняОксигену карбонільної групи ‑ взаємодія з пентахлоридом фосфору РСІ5:
СН3 – СН =О + РСІ5 → СН3 – СНСІ2 + РОСІ3
етаналь 1,1-дихлоретан
Реакції конденсації.
альдольно-кротонова конденсація. Альдегіди під дією лугів і карбонатів лужних металів вступають в реакції ущільнення молекул за рахунок рухливих атомів гідрогену, які знаходяться в α-положенні. Реакція розроблена видатним російським хіміком і композитором О.П.Бородіним (1872). Проміжний продукт – альдоль ( містить карбонільну і гідроксильну групи). Кінцевим продуктом реакції є кротоновий альдегід. В реакцію вступають альдегіди, що мають у α-положенні атом Гідрогену.
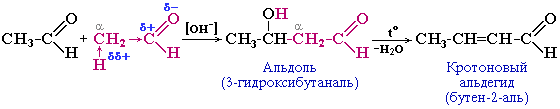
*самоконденсація альдегіду з утворенням вуглеводу (реакція О.М.Бутлерова). В 1861р. О.М.Бутлеров здійснив перший повний синтез вуглеводів (CnH2nOn). Встановив, що формальдегід H2C=O під дією гідроксидів лужноземельних металів, Рb або Sn вступає в реакцію самоконденсації з утворенням суміші вуглеводів:
Суміш вуглеводів
*Схема реакції:
Реакція ‑ ступінчаста і автокаталітична. Утворений гліколевий альдегід CH2(OH)CHO, при подальшій взаємодії з формальдегідом, перетворюється в гліцериновий альдегід:
![]()
Альдегіди конденсуються, утворюючи альдози (полігідроксиальдегіди). В умовах реакції (лужне середовище) альдози здатні до ізомеризації з утворенням кетоз (полігідроксикетонів), які також утворюються з проміжних продуктів. Так, гліцериновий альдегід (найпростіша альдоза) ізомеризується в дигідроксиацетон (кетозу) СН2(ОН)СОСН2ОН:
|
|
|
|
Конденсація за участю ди- і полігідроксикетонів призводить до утворення вищих кетоз. |
|
*формальдегідокарбамідна конденсація
Формальдегід взаємодіє з сечовиною по типу нуклеофільного приєднання. Нуклеофіл – молекула сечовини, що містить дві групи -NH2 з неподіленою парою електронів на атомі Нітрогену. В надлишку формальдегіду реагують обидві групи з утворенням диметилолсечовини (метилол – група ‑CH2OH).

Поліконденсація диметилолсечовини з утворенням лінійного полімеру.
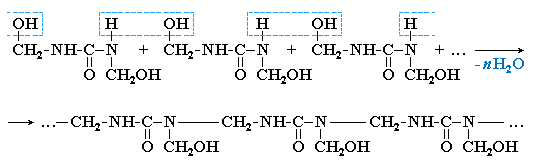
При формуванні виробів лінійний полімер нагріваючи перетворюють у сітчастий (трьохмірний). Це відбувається за рахунок утворення повздовжніх міжланцюгових зв’язків (містків) ‑ CH2 – внаслідок відщеплення води від груп ‑ CH2OH и –NH ‑, розміщених в різних ланцюгах.
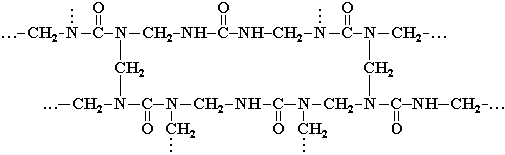
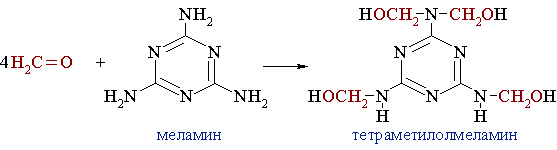
*формальдегідомеламінова конденсація. При конденсації формальдегіду з меламіном у присутності лужних або кислотних каталізаторів утворюються гідроксиметильні похідні, що містять від 1 до 6 метилольних груп ‑ CH2OH.
Формальдегід взаємодіє з меламіном по типу нуклеофільного приєднання. Нуклеофіл – молекула меламіну, містить три групи ‑ NH2 з неподіленою парою електронів на атомі Нітрогену. Приєднання перших трьох молекул СН2О до меламіну відбувається швидко:
Конденсація метилольних похідних меламіну завершується утворенням термореактивних олігомерів:

При формуванні виробів олігомери твердіють (нагріванням в нейтральному і лужному середовищах, або за кімнатної температури — в кислому середовищі), перетворюючись при цьому в нерозчинні та неплавкі сітчасті полімери. Продукти твердіння мають високу міцність, дуго–, тепло–, водо–, зносо– и світлостійкість, добру здатність до закрашування.
Використовують меламіно-формальдегідні смоли як зв’язуючи компонент у виробництві амінопластів (прес-порошків, прес-матеріалів, декоративних паперово шаруватих пластиків, азбопластиків, штучного мармуру), для просочування паперу, картону і тканин з метою надання їм здатності не змочуватися водою, не зминатися , для зниження усадки.
Увага! Посуд, виготовлений з меламіно-формальдегідних полімерів (часто неправильно називають "меламіном"), як правило ярко оформлений, токсичний і дуже шкідливий для здоров’я.
Реакції полімеризації – особливий вид полімеризації альдегідів, при якому зв'язок між альдегідними мономерами встановлюється через атоми Карбону і Оксигену. Розрізняють два види полімеризації альдегідів – лінійну та циклічну.
лінійна полімеризація – полімеризація, при якій розривається подвійний зв'язок карбонільної групи. При цьому атом Оксигену однієї молекули з’єднується з атомом карбонільного Карбону іншої молекули. Внаслідок цього відбувається подовження ланцюга лінійного полімеру. Наприклад при тривалому зберіганні 40%-го водного розчину формаліну на дні посудини випадає білий осад лінійного полімеру параформу (поліоксиметилену), де n = 10 – 50:
![]()
Формальдегід може утворювати також ВМС – поліформальдегід (n = 1000). Одержують полімеризацією абсолютно чистого сухого формальдегіду в безводному середовищі в присутності карбонілу феруму (каталізатор). Поліформальдегід застосовують для одержання СВ та інших продуктів органічного синтезу.
|
|
Наприклад, при нагріванні формальдегіду з розведеними кислотами утворюється циклічний триоксиметилен. Триоксан використовують для одержання поліформальдегіду (полиоксиметилену) з високою молекулярною масою підвищеної стабільності та механічної міцності: |
|
Методи одержання
гідратація ацетилену (реакція Кучерова):
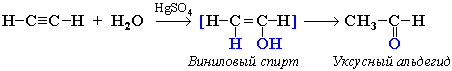
окислення первинних спиртів розчинами перманганату калію, хромова суміш, кисень повітря (каталізатори – Pt або Cu):
альдегід нестійкий алкандіол альдегід карбонова кислота
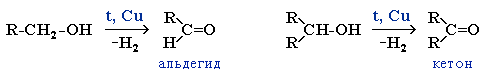
окислення етилену:
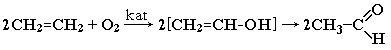
гідроліз дигалогенопохідних вуглеводнів:
СН3 – СН2 ‑ СН2 ‑ СН ‑СІ2 + 2КОН → СН3 – СН2 ‑ СН2 – СОН + 2КСІ
1,1-дихлорбутан бутаналь
суха перегонка кальцієвих солей карбонових кислот:
СН3 – СОО – Са – СОО – СН3 + НСОО – Са – СООН → 2 СН3 – СОН + 2СаСО3
кальцій етаноат кальцій метаноат етаналь
оксосинтез продуктів переробки нафти (каталізатори Nі і СО, 100 – 2000 С, 105Па):
СН3 – СН = СН2 + СО + Н2 → СН3 – СН2 – СН2 ‑ СОН
пропен бутаналь
Окремі представники альдегідів
Метаналь (формальдегід, мурашиний альдегід) НСОН, 40%-ий водний розчин формальдегіду – формалін. Використовують для дезинфекції тваринних приміщень, як дезодоруючий засіб, дубитель у шкіряній промисловості, фіксатор в анатомічній і гістологічній техніці. Формалін – вихідна сполука для одержання багатьох речовин: уротропіну, фенол формальдегідних смол, СК, штучної вовни.
Етаналь (ацетальдегід, оцтовий альдегід) СН3СОН – безбарвна рідина, летка, має різкий запах прілих яблук або зеленого листя. Змішується з водою та органічними розчинниками. Використовують для одержання оцтової кислоти, етанолу, етилацетату, оцтового ангідриду, хлоралю, смол, пластмас та інших речовин.
Пропаналь (акриловий альдегід, акролеїн) СН2 = СН – СОН – рідина з задушливим запахом, розчиняється у воді та органічних розчинниках. Одержують окисленням пропену киснем повітря (каталізатор МоВr2):
СН2 = СН – СН3 + [О] → СН2 = СН – СОН + Н2О
Невеликі кількості акролеїну утворюються при нагріванні жирів і олій внаслідок розкладу їх на гліцерин і ВМЖ кислоти з подальшим окисленням гліцерину та його дегідратацією. Застосовують для синтезу метіоніну, гліцерину, піридину, багатьох медикаментів, співполімерів.
Кротоновий альдегід (2-бутеналь) СН3 – СН = CH – COH – рідина з різким запахом, погано розчиняється у воді, добре – в органічних розчинниках. Застосовується в органічному синтезі (для одержання кротонової кислоти).
Бензойний альдегід (бензальдегід) С6Н5СНО – безбарвна рідина із запахом гіркого мигдалю, погано розчиняється у воді, добре – в органічних розчинниках. Міститься в багатьох ефірних оліях, кісточках слив, персиків, абрикос, гіркого мигдалю. Застосовують для одержання запашних речовин –жасминальдегіду і коричного альдегіду, в парфумерній та харчовій промисловості, як вихідну речовину для одержання арил метанових барвників.
Коричний альдегід (β-фенілакролеїн, 3-фенілпропен-2-аль-1) С6Н5СН = СН – СНО –рідина з приємним запахом погано розчиняється у воді, добре ‑ в спиртах, ацетоні. Міститься в багатьох ефірних оліях. Одержують з бензальдегіду і ацетальдегіду. Застосовують як запашну речовину в парфумерній і харчовій промисловостях, а також для одержання коричного спирту.
Кетони
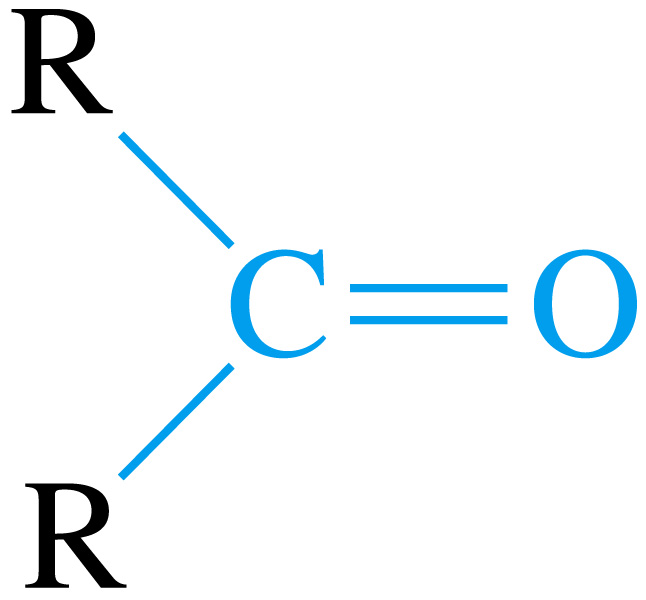
Кетони – оксосполуки, в яких обидві валентності атому карбону карбонільної групи зв’язані з однойменними або різнойменними радикалами: |
|
|
|
кетон |
|||
|
|
модель ацетону |
|
Класифікація:
ациклічні (насичені і ненасичені) та циклічні (похідні циклопарафінів, аренів);
за кількістю карбонільних груп – моно- і дікетони.
Номенклатура
раціональна: радикали називаються за «старшинством» і додається слово «кетон».
ІЮПАК: при найменуванні кетонів за основу береться назва алкану, до якої додається суфікс –он (нумерацію карбонового ланцюга починають від атома Карбону, де розміщена карбонільна група). Наприклад:
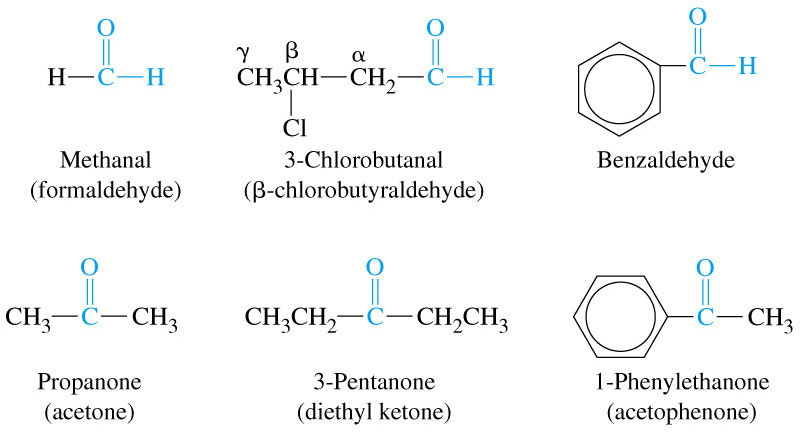
диметилкетон диетилкетон ацетофенон
пропанон 3-пентанон 1-фенілетанон
Ізомерія
ізомерія карбонового ланцюга (з нормальним і розгалуженим):
СН3 – СН2 ‑ СН2 ‑ СН2 – С – СН3 СН3 – СН ‑ СН2 – С – СН3
║ │ ║
О СН3 О
2-гексанон 4-метил-2-пентанон
метамерія: СН3СН2СОСН2СН3 та СН3СОСН2СН2СН3
3-пентанон 2-пентанон
ізомерія гомологічних рядів (альдегіди ізомерні кетонам, ненасиченим спиртам і простим етерам):
|
|
Зі збільшенням радіусів радикалів реакційна здатність оксосполук зменшується. тому альдегіди в хімічних реакціях більш активні, ніж відповідні ним кетони, оскільки в їх молекулах лише одна валентність зв’язана з радикалом, а в молекулах кетонів обидві валентності карбонільної групи зв’язані з радикалами:
формальдегід > альдегід > кетон
Хімічні властивості
Відновлення кетонів воднем в момент виділення (атоми Гідрогену здатні приєднуватися до карбонільної групи, перетворюючи їх на вторинні спирти):
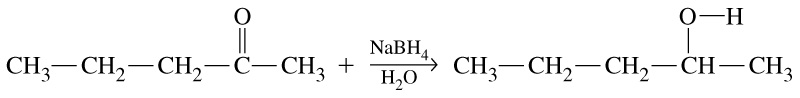
вторинний спирт
Приєднання аміаку до кетонів:
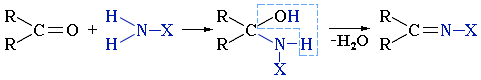
Приєднання синільної кислоти (утворюється ціангідрин):
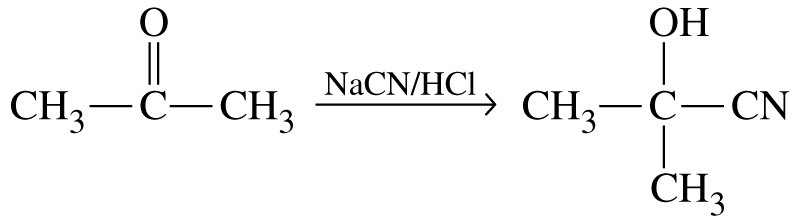
Приєднання магнійорганічних сполук до кетонів відбувається з утворенням третинних спиртів:
кетон реактив Гріньяра алкоголят третинний спирт
Окиснення сильними окислювачами. Кетони окислюють важче, ніж альдегіди. В молекулі кетонів карбонільна група не має рухливого Гідрогену. Процеси окислення кетонів відбуваються за правилом Попова-Вагнера. При взаємодії кетонів з сильними окислювачами (біхроматом калію, перманганатом калію) при нагріванні карбоновий ланцюг по обох боках карбонільної групи розривається так, що карбонільна група залишається зв’язаною з більш коротким радикалом:
СН3 – СН2 – СО – СН2 – СН3 [О] → СН3 – СН2 – СООН + СН3 – СООН
2-бутанон пропіонова кислота оцтова кислота
Реакції заміщення атома Гідрогену в α-положенні по відношенню до карбонільної групи (взаємодія з галогенами), утворюються галогенопохідні оксосполук (рухливий атом Гідрогену в α-положенні до карбонільної групи заміщується на атом галогену):
СН3 ‑ СН2 – СО – СН3 + СІ2 → СН3 ‑ СНСІ – СО – СН3 + НСІ
2-бутанон 3-хлор-2-бутанон
Реакції заміщення Оксигену карбонільної групи (взаємодія з пентахлоридом фосфору РСІ5):
СН3 – СО – СН3 + РСІ5 → СН3 – ССІ2 – СН3 + РОСІ3
ацетон 2,2-дихлорпропан
Йодоформна проба (йодування ацетону в лужному середовищі). Реакція відбувається з утворенням жовтих кристалів йодоформу СН3І. Використовується для визначення ацетону в сечі при хворобі «цукровий діабет».
СН3 – СО – СН3 І2 + ОН- СН3І↓ + СН3СОО-
 ацетон
йодоформ
ацетон
йодоформ
Конденсація кетонів: низькомолекулярні кетони здатні вступати в особливий вид конденсації, що призводить до утворення в молекулі продукту реакції двох функціональних груп: карбонільної та ненасиченої вуглеводневої ( ‑ СН = СН ‑ ):
СН3 – СО – СН3 + СН3 – СО – СН3 → СН3 – С (СН3) – СН2 – С – СН3 →
ацетон │ ║
→ СН3 ‑ С = СН – С –СН3 ОН О
│ ║ 4-окси-4-метил-2-пентанон
СН3 О
4-метил-3-пентен -2-он
Методи одержання кетонів
Відновлення вторинних спиртів. Окисники: розчини КМnО4, хромова суміш, кисень повітря, каталізатор ‑ Pt, або Сu.
Кумельний метод:
Гідроліз дигалогенопохідних вуглеводнів:
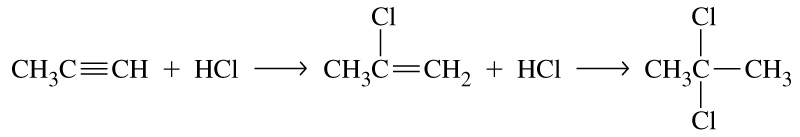
![]()
2,2-дихлорпропан ацетон
Гідратація гомологів алкінів за умов реакції Кучерова:
суха перегонка кальцієвих солей карбонових кислот (для одержання кетону беруть сіль однієї карбонової кислоти):
НСОО – Са – СООН → СН3 – СО – СН3 + СаСО3
кальцій метаноат ацетон
Окремі представники кетонів
Ацетон (диметилкетон, пропанон) СН3 – СО – СН3 ‑ безбарвна рідина з приємним запахом, добре розчинна у воді та органічних розчинниках, ацетон – відмінний органічний розчинник, застосовують як розчинник для фарб, у виробництві нітро- і ацетилцелюлози, як вихідну речовину для одержання кетену, йодоформу, ізопрену, естерів, метакрилової кислоти.
Кетен СН2=С=О – газ з неприємним запахом, розчиняється у багатьох розчинниках, погано – у воді. Застосовують як ефективний ацетилюючий агент (при виробництві ацетатів целюлози), для синтезу ацетатної кислоти, ацетилхлориду, ацетил ацетату, консервантів та інших речовин.
Ацетофенон (метилфенілкетон) С6Н5СОСН3 – безбарвна кристалічна речовина із запахом черемшини, не розчиняється у воді, добре розчиняється в органічних розчинниках. Міститься в деяких ефірних оліях і кам’яновугільній смолі. Застосовують для одержання стирену, полістирену, СКБ, термоелектропластів, хлорацетофенону. Використовується як запашна речовина (запах черемшини) у парфумерній промисловості та як вихідна речовина для синтезу медикаментів.
Карбонові кислоти та їх похідні
Карбонові кислоти – органічні сполуки, що мають у складі своїх молекул одну або кілька карбоксильних груп – СООН.
Карбонові кислоти – похідні вуглеводнів, у молекулах яких один або кілька атомів Гідрогену заміщені на групи –СООН. Карбоксильна група (карбоксил) – одновалентна атомна група, яку можна розглядати як поєднання карбонільної =С = О та гідроксильної ‑ОН груп. |
|
Класифікація карбонових кислот
Залежно від природи радикала:
|
|
|
Залежно від кількості карбоксильних груп:
одноосновні;
двоосновні;
багатоосновні.

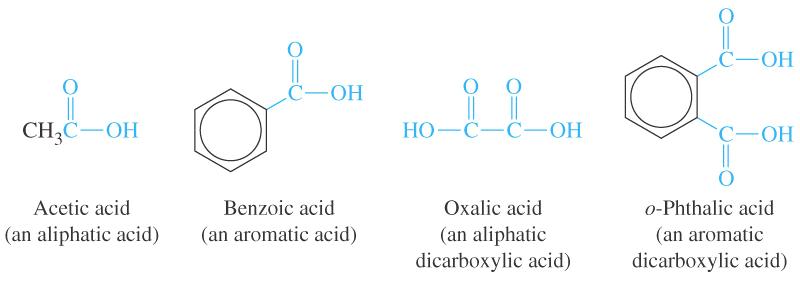
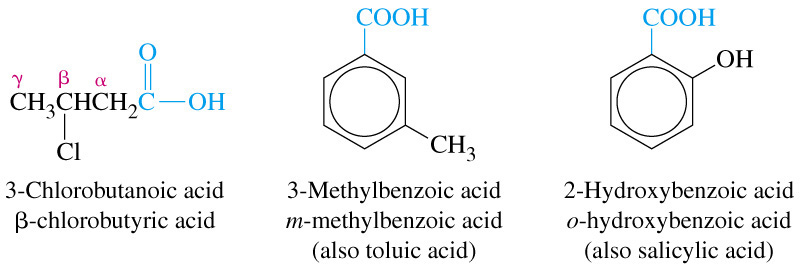
Залежно від насиченості:
насичені: СН3 – СН2 – СН2 ‑ СООН ‑ бутанова (масляна) кислота
ненасичені карбонові кислоти: СН3 – СН = СН ‑ СООН ‑ кротонова кислота
Крім карбоксильних груп у молекулах карбонових кислот можуть бути інші функціональні групи, які зумовлюють їх специфічні властивості.
Назва функціональної групи |
Назва класу |
Формула кислоти |
Назва |
Альдегідна група ‑ СОН |
альдегідокислоти |
О = СН ‑ СООН |
Гліоксилова кислота |
Кетонна група = С =О |
кетокислоти |
СН3 – СО ‑ СООН |
Піровіноградна кислота |
Амінна група – NH2 |
амінокислоти |
NH2 ‑ СН2 ‑ СООН |
Амінооцтова кислота (гліцин) |
Гідроксильна група ‑ ОН |
гідроксикислоти |
CH3 ‑ CHOH ‑ COOH |
Лактатна кислота |
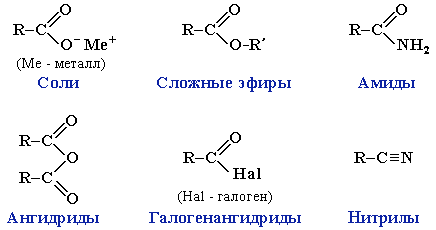
Похідні карбонових кислот:
|
|
|
|
|
|
солі |
естери |
аміди |
ангідриди |
галогенангідрид |
нітрил |
Одноосновні насичені кислоти
Одноосновні насичені кислоти (кислоти жирного ряду) – похідні алканів, у молекулі яких атом Гідрогену заміщений на карбоксильну групу.
Загальна формула гомологічного ряду: СnH2n+1 – COOH
Номенклатура
Історична номенклатура: карбонові кислоти називають, виходячи з назви продуктів, з яких вони вперше були одержані.
За номенклатурою ІЮПАК назви карбонових кислот походять від назви відповідних алканів, до яких додають суфікс –ова. Нумерацію починають з атома Карбону карбоксильної групи.
Формула кислоти |
Історична назва |
ІЮПАК |
Назва радикалу |
Н ‑ СООН |
мурашина |
метанова |
форміат |
СН3 ‑ СООН |
оцтова |
етанова |
ацетат |
С2Н5 ‑ СООН |
пропіонова |
пропанова |
пропіонат |
С3Н7 ‑ СООН |
масляна |
бутанова |
бутират |
С4Н9 ‑ СООН |
валеріанова |
пентанова |
валерат |
С5Н11 ‑ СООН |
капронова |
гексанова |
капрат |
С15Н31 ‑ СООН |
пальмітинова |
гексадеканова |
пальмітат |
С16Н33 ‑ СООН |
маргаринова |
гептадеканова |
маргарат |
С17Н35 ‑ СООН |
стеаринова |
октадеканова |
стеарат |
Ізомерія
Ізомерія карбонового ланцюга молекули:
СН3 – СН2 – СН2 – СН2 – СООН та СН3 – СН (СН3) – СН2 –– СООН
пентанова кислота 3-метилбутанова кислота
Міжкласова ізомерія (починаючи з С2) – ізомерні складним естерам, гідроксиальдегідам.
Просторова ізомерія (можлива у випадку ненасичених карбонових кислот):

Оптична ізомерія можлива в молекулах карбонових кислот із асиметричним атомом Карбону (зв’язаним з 4-мя різними замісниками):

Будова карбоксильної групи
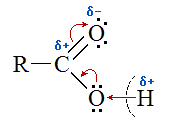
Електронна будова групи – СООН надає карбоновим кислотам характерні фізичні та хімічні властивості:
|
|
|
|
|
|
|
|
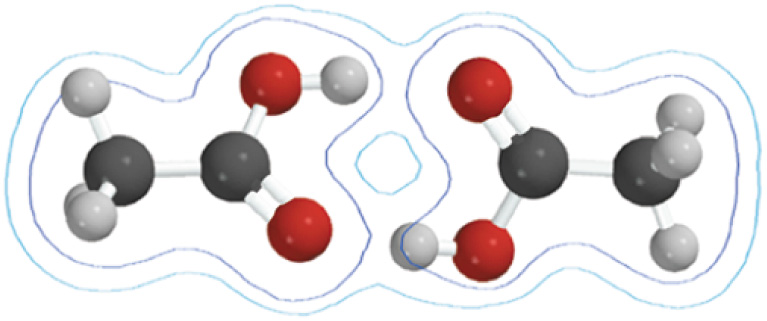
Фізичні властивості
Перші чотири гомологи одноосновних насичених карбонових кислот – безбарвні рідини з гострим запахом, змішуються з водою в різних співвідношеннях. Наступні представники (до С9) – малорухливі рідини з неприємним запахом, решта – тверді речовини без запаху, майже не розчиняються у воді. Температура кипіння карбонових кислот з нормальним карбоновим ланцюгом вища, ніж відповідних їм кислот з розгалуженим ланцюгом.
Хімічні властивості
І. Кислотні властивості карбонових кислот:
1.1. дисоціація:
СН3СООН ↔ СН3СОО- + Н+
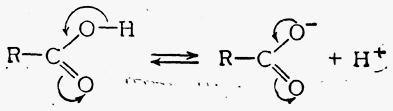
1.2. утворення солей:
взаємодія з лугами:
СН3СООН + NaOH → СН3СООNa + H2О
взаємодія з оксидами лужних і лужноземельних металів:
2 СН3СООН + СаO → (СН3СОО)2Са + H2О
взаємодія з лужними і лужноземельними металами:
2 СН3СООН + Са → (СН3СОО)2Са + H2↑
взаємодія з аміаком:
СН3СООН + NН3 → СН3СООNН4
взаємодія з солями:
СН3СООН + NaHCO3 → СН3СООNa + H2О + CO2↑
Реакції заміщення гідроксилу карбоксильної групи:
утворення естерів (реакція етерифікації), відбувається у присутності концентрованих мінеральних кислот (Н2SО4):

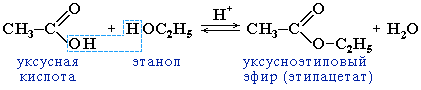
При взаємодії гліцерину та ВМЖК утворюються жири:
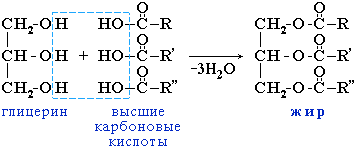
утворення галогенангідридів відбувається при дії пентахлориду фосфору РСІ5:
![]()
Галогенангідриди – реакційно активні речовини, їх галоген легко заміщується на різні функціональні групи, що і дозволяє одержати різні класи речовин.
утворення амідів при дії первинного аміну на карбонову кислоту, при дії аміаку на галогенангідриди карбонових кислот, або при нагріванні амонійних солей карбонових кислот:

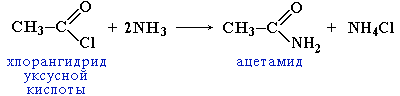
хлорангідрид оцтової кислоти ацетамід
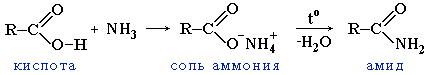
карбонова кислота сіль амонію амід
утворення нітрилів відбувається при нагріванні амідів відповідних карбонових кислот з водовіднімаючими засобами (Р2О5):
С Н3
– СО – NH2
t, P2O5
CH3
– C ≡ N
Н3
– СО – NH2
t, P2O5
CH3
– C ≡ N
ацетамід ацетонітрил (нітрил ацетатної кислоти)
утворення ангідридів – реакція дегідратації карбонових кислот під впливом водовіднімаючих засобів Р2О5:
СН3СООН + СН3СООН → СН3СО – О – СОСН3 + Н2О
ангідрид оцтової кислоти
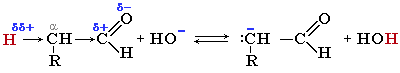
Реакції заміщення атому Гідрогену в α-положенні:
![]()
хлороцтова кислота
Реакції окислення:
Карбонові кислоти мають певну стійкість до дії окисників. Виключення – мурашина кислота, яка окислюється аміачним розчином Аg2О при нагріванні:
НСООН + Аg2О → 2 Аg↓ + СО2↑ + Н2О
При дії на карбонові кислоти Н2О2 утворюються β-гідроксикислоти, а потім β-кетоксикислоти:

Карбонова кислота гідроксикислота
кетокислота
β-окислення карбонових кислот. Відбувається в клітинах живих організмів. При цьому під впливом відповідних ферментів поступово скорочується карбоновий ланцюг радикала на два атоми Карбону, починаючи від карбоксильного кінця. Двокарбоновий фрагмент утворює з КоА ацетил-КоА, який у циклі три карбонових кислот (цикл Кребса) перетворюючись в АТФ і її структурні аналоги, є джерелом хімічної енергії. Найпростішим прикладом цього процесу може бути β-окислення масляної кислоти, складової частини молочного жиру:
С Н3
– СН2 – СН2
– СООН → СН3 – СН = СН –
СООН → СН3 – СНОН – СН2
– СООН
Н3
– СН2 – СН2
– СООН → СН3 – СН = СН –
СООН → СН3 – СНОН – СН2
– СООН
масляна кислота кротонова кислота β-гідроксимасляна кислота
СН3 – СО – СН2 – СООН → СН3 – СООН + СН3 – СООН
ацетооцтова кислота оцтова кислота
Відновлення та каталітичне гідрування кислот (відбувається дуже важко):
С2Н5СООН + Н2 → С2Н5 – СОН
пропанова кислота пропаналь
С2Н5 – СОН + Н2 → С2Н5 – СН2ОН
пропаналь 1-пропанол
Реакція декарбоксилювання – реакція відщеплення групи СО2 від карбоксилу карбонових кислот і їх похідних (амінокислот, кетокислот, гідроксикислот). Розрізняють термічне і ферментативне декарбоксилування. При термічному декарбоксилюванні солі карбонових кислот сплавляють з лугами:
СН3СООNa + NaOH → CH4 + Na2CO3
Ферментативне декарбокислювання – важливий біохімічний процес перетворень карбонових. кислот у клітинах живих організмів.
Методи одержання:
окислення первинних спиртів (утворюється одна кислота), вторинних або третинних спиртів (утворюються дві кислоти, іноді альдегіди і кетони, а також інші продукти):
окислення альдегідів:
R – COH + [O] → R – COOH
альдегід карбонова кислота
оксосинтез кислот з ненасичених вуглеводнів:
R – CH = CH2 + CO + H2O → R – CH2 ‑ CH2 ‑ COOH + R – CH(CH3) – COOH
Реакція відбувається при 50–100 С, тиску 10–105 Па, каталізаторами є концентровані мінеральні кислоти (Н3РО4 або Н2SО4) або солі (Nі(СО)4).
окислення ненасичених вуглеводнів.
декарбоксилювання двохосновних карбонових кислот:
![]()
відновлення галогенопохідних карбонових кислот:
![]()
гідроліз тригалогенопохідних вуглеводнів:
СН3 – СН2 – ССІ3 + 3НОН → СН3 – СН2 ‑ СООН + 3НСІ
1,1,1-трихлорпропан пропанова кислота
одержання мурашиної кислоти. Основну масу мурашиної кислоти одержують синтетично з СО і натронного вапна (температура 150 ‑ 2000 С, тиск 600-800кПа) При цьому утворюється форміат натрію, який потім обробляють сульфатною кислотою:
![]()
НСООNа + Н2SО4 → NаНSО4 + НСООН
одержання оцтової кислоти з елементів:

одержання оцтової кислоти:
![]()
Окремі представники одноосновних карбонових кислот
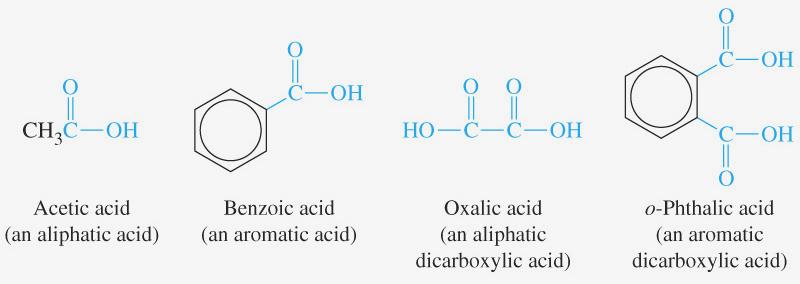
Мурашина (метанова, форміатна) кислота НСООН – безбарвна рідина з різким запахом. Міститься в їдкій речовині, яку виділяють мурашки. Міститься також у деяких рослинах (кропива). При потраплянні на шкіру викликає опіки.
Оцтова кислота (етанова, ацетатна) СН3СООН ‑ безбарвна рідина з характерним різким запахом. При температурі 16,750С кислота твердіє, утворюючи кристали, схожі на лід. Тому безводну оцтову кислоту називають льодяною оцтовою кислотою. Добере розчиняється у воді, 70-80%-й розчин називається оцтовою есенцією, 3-9%-й розчин – оцет. Міститься у багатьох тваринних і рослинних організмах, утворюється під час скисання багатьох продуктів і вина. ЇЇ використовують також у харчових цілях для консервування продуктів і як приправу.
Харчову оцтову кислоту одержують при оцтовокислому бродінні вуглеводів (крохмалю). Спочатку утворюється етанол, який під впливом оцтовокислих бактерій перетворюється в оцтову кислоту:
![]()
З бродильної суміші оцтову кислоту відганяють методом дробної перегонки. Одержують оцтову есенцію, з неї готують харчовий оцет. Для технічних потреб оцтову кислоту одержують при сухій перегонці деревини, окисленні алканів, карбоксилюванні метану. Використовують її у виробництві оцтового альдегіду, трихлороцтової кислоти, багатьох барвників, лаків, естерів, при фарбуванні тканин, як сировину для синтезу багатьох медикаментів, інсектицидів, як консервант у харчовій промисловості та у домашньому господарстві, як сировину для синтезу штучних волокон (ацетатцелюлозних).
Пропіонова кислота (пропанова кислота) С2Н5СООН – безбарвна рідина з гострим запахом. Утворюється при пропіоновокислому бродінні вуглеводів. У промисловому масштабі добувають шляхом окислення 1-пропанолу або пропаналю хромовою сумішшю або киснем повітря. застосовують у харчові промисловості проти пліснявіння зерна, хлібних продуктів і сиру. Є сировиною для синтезу багатьох гербіцидів, деяких вітамінів, запашних речовин.
Масляні кислоти С3Н7СООН – безбарвна рідина з різким і неприємним запахом, добре розчинна у воді та органічних розчинниках. Зустрічається у вільному стані (піт) і у вигляді естерів (гліцериди коров’ячого масла). Одержують її маслянокислим бродінням вуглеводів, у промисловості – окисленням бутану або бутаналю. застосовують у виробництві запашних речовин, синтезі медикаментів, виробництві пластифікаторів, ацетобутирату целюлози.
Пальмітинова кислота (гексадеканова) С15Н31 – СООН – безбарвна кристалічна речовина, майже не розчинна у воді, добре розчиняється у багатьох органічних розчинниках (особливо при нагріванні). Входить до складу всіх тваринних і рослинних жирів. У чистому вигляді одержують методом ректифікації після гідролізу жиру.
Стеаринова кислота (октадеканова) С17Н35 – СООН – тверда кристалічна речовина, практично нерозчинна у воді, погано розчиняється і в органічних розчинниках. Залишки кислоти входять до складу молекул всіх тваринних і рослинних жирів. Технічна стеаринова кислота (синтетична) – стеарин, містить домішки інших Вищих жирних кислот. Із суміші ВЖК індивідуальні кислоти видаляють методом дистиляції або дробним осадженням. Використовують у виробництві мил, миючих засобів, свічок, октадециловогоспирту.
Двоосновні насичені кислоти
Двоосновні (дикарбонові) насичені кислоти – похідні алканів, у молекулах яких два атоми Гідрогену, що розміщені біля різних Карбонів, заміщені карбокисльними групами – СООН.
Загальна формула гомологічного ряду дикарбонових кислот: СnН2n(СООН)2
Гомологічний ряд:
НООС – СООН ‑ щавлева (оксалатна) кислота, етандіолова
НООС – СН2 – СООН ‑ малонова кислота, пропандіолова
НООС – СН2 – СН2 ‑ СООН ‑ янтарна кислота, бутандіолова
НООС – СН2 – СН2 ‑ СН2 ‑ СООН ‑ глутарова кислота, пентадіолова
НООС – СН2 – СН2 ‑ СН2 ‑ СН2 ‑ СООН ‑ адипінова кислота, гексадіолова
Фізичні та хімічні властивості
Дикарбонові кислоти – кристалічні речовини, погано розчинні у воді, краще – в органічних розчинниках, їх властивості змінюються із зростанням молекулярної маси. зі збільшенням кількості атомів Карбону розчинність кислоти зменшується: у кислот з парним числом атомів карбону розчинність у воді більша, ніж у сусідніх представників з непарним числом атомів. Кислотні властивості виражені сильніше, ніж в одноосновних кислотах, що пояснюється сильною електроноакцепторною дією другої карбоксильної групи (де локалізація негативного заряду в аніоні, який утворюється після відриву протона на першій стадії дисоціації).
Двоосновні кислоти вступають у ті ж хімічні реакції, що й одноосновні. Відмінність пов’язана лише з наявністю двох груп – СООН: утворюються кислі і середні солі, повні та неповні естери, повні та неповні хлорангідриди, повні та неповні аміди).
Відношення до нагрівання. Розміщення двох карбоксильних груп на різній відстані одна від одної в молекулах дикарбонових насичених кислот зумовлює їх різне відношення до нагрівання.
Щавлева і малонова кислоти (карбоксильні групи в молекулах дуже зближені) при нагріванні декарбоксилюється:
НООС – СООН -СО2 Н – СООН → Н2О + СО
щавлева кислота мурашина кислота
НООС ‑ СН2 – СООН 140-1600С СН3 – СООН + СО2
малонова кислота оцтова кислота
Дикарбонові кислоти з карбоксильними групами в положенні 1,4 (янтарна) і 1,5 (глутарова) при нагріванні вище 2000С утворюють циклічні ангідриди:
НООС ‑ СН2 ‑ СН2 – СООН -Н2О СН2 – С = О


 О
+ Н2О
О
+ Н2О
СН2 – С = О
янтарна кислота янтарний ангідрид
Окремі представники двоосновних насичених кислот
Щавлева (оксалатна) НООС – СООН – кристалічна речовина білого кольору, гігроскопічна, розчиняється у воді, етанолі, діетиловому етері, легко сублімується. Є у вільному стані в багатьох рослинних тканинах, водоростях, грибах, лишайниках, листях щавлю, плодах смородини, малини, апельсинах. У промисловості одержують швидким нагріванням натрієвої (калієвої) солі мурашиної кислоти при 4000С з наступною дією на продукт реакції сульфатної кислоти.
У тканинах тваринного організму щавлева кислота утворюється як кінцевий продукт окислювального дезамінування. Екзогенна та ендогенна кислоти виділяють з організму з сечею у вигляді кальцій етанодіоату. При порушеннях обміну речовин в організмі утворюються оксалати кальцію (ознака сечокам’яної хвороби). Кислоту використовують як протраву при виготовленні різних тканин у текстильній промисловості, в синтезі барвників, для добування чорнил, як побутовий засіб для очищення ван, посуду.
Малонова кислота (пропандіолова) НООС – СН2 – СООН ‑ безбарвна кристалічна речовина, добре розчинна у воді, етанолі, діетиловому етері. Вперше одержанв з яблук, її багато в тканинах буряків і редьки. Солі та естери малонової кислоти – малонати, їх застосовують для одержання малонового естеру (діетиловий естер малонової кислоти), деяких амінокислот, вітамінів В1 і В2, барбітуратів.
Янтарна кислота (бутандіолова) НООС – СН2 – СН2 ‑ СООН ‑ безбарвна кристалічна речовина, погано розчиняється у воді, краще – в органічних розчинниках. Солі та естери янтарної кислоти – сукцинати. Кислоту вперше одержано при сухій перегонці янтарної смоли. Незначна кількість кислоти входить до складу бурого вугілля, недозрілих фруктів, тканин різних тварин і рослин (проміжний продукт циклу Кребса). Застосовують у виробництві фарб, барвників, інсектицидів, медикаментів, алкідних смол, сукцинатів, фотоматеріалів.
Глутарова кислота (пентадікарбонова) НООС – СН2 – СН2 ‑ СН2 ‑ СООН ‑ біла кристалічна речовина, добре розчиняється у воді й органічних розчинниках. Є в жомі цукрового буряка і у водах після промивання овечої вовни, її похідні – проміжні продукти ЦТК. Зустрічається в незначних кількостях в рослинних і тваринних тканинах. Застосовують в органічному синтезі біологічно активних речовин.
Адипінова кислота (гександіолова кислота) НООС – СН2 – СН2 ‑ СН2 ‑ СН2 ‑ СООН ‑ безбарвна кристалічна речовина, погано розчинна у воді, краще – в органічних розчинниках. Солі та естери адипінової кислоти – адипінати. Вперше кислоту виділено з продуктів окислення жирів. Застосовують у виробництві СВ (найлон), інсектицидів, барвників, мастил, пластифікаторів, у харчовій промисловості як добавка до продуктів харчування (регулятор кислотності).
Ненасичені одноосновні кислоти
Ненасичені одноосновні кислоти – похідні ненасичених вуглеводнів, у молекулах яких один атом Гідрогену радикала заміщений на Карбоксильну групу.
Номенклатура
Для найменування кислот часто використовують історичну номенклатуру: акрилова, кротонова, олеїнова.
За номенклатурою ІЮПАК назви кислот аналогічні назвам ненасиченим вуглеводням з вказівкою, що ця сполука – кислота.
СН2 = СН – СООН ‑ акрилова (пропенова кислота)
СН3 ‑ СН2 = СН – СООН ‑ кротонова (2-бутенова кислота)
СН2 = С (СН3) – СООН ‑ метакрилова кислота (2-метил-2-пропенова кислота)
СН2 = СН ‑ СН2 – СООН ‑ вінілоцтова (3-бутенова кислота)
СН3 – (СН2)7 – СН = СН – (СН2)7 – СООН ‑ олеїнова кислота
Ізомерія
Обумовлена розгалуженістю карбонового ланцюга.
Розміщенням подвійного зв’язку.
Геометрична ізомерія (цис- трансізомерія) кротонова кислота, олеїнова кислота.
Властивості
За звичайних умов акрилова і метакрилова кислоти – безбарвні рідини, кротонова кислота – тверда речовина, олеїнова кислота – олійна рідина.
Ненасичені кислоти сильніші за насичених кислот з таким самим числом атомів Карбону: акрилова сильніша за пропанову кислоту.
Взаємодія з лугами, утворюються молі відповідних кислот:
СН2 = СН – СООН + КОН → СН2 = СН – СООК + Н2О
акрилова кислота акрилат калію
Взаємодія зі спиртами, утворюються складні естери:
СН2 = СН – СООН + С2Н5ОН → СН2 = СН – СООС2Н5 + Н2О
акрилова кислота етанол етилакрилат
Приєднання галогенів за подвійним зв’язком:
СН2 = СН – СООН + СІ2 → СН2СІ – СНСІ –СООН
акрилова кислота 2,3-дихлопропанова кислота
Приєднання води (відбувається проти правила Марковнікова):
СН2 = СН – СООН + Н2О → СН2ОН – СН2 – СООН
акрилова кислота 3-гідроксипропанова кислота
Приєднання галогенводнів (проти правила Марковнікова):
СН2 = СН – СООН + НСІ → СН2СІ – СН2 – СООН
акрилова кислота 3-хлорпропанова кислота
Приєднання водню (гідрування), утворюються насичені карбонові кислоти, нагрівання, каталізатор ‑ Ni:
С17Н33СООН + Н2 → С17Н35СООН
олеїнова кислота стеаринова кислота
Окислення відбувається легко, що обумовлене наявністю в молекулах карбонових кислот подвійних зв’язків. При окислення ненасичених кислот розчином перманганату калію в лужному середовищі утворюються дигідроксикислоти:
СН2 = СН – СООН + [O] + Н2О → СН2ОН – СНОН – СООН
акрилова кислота 2,3-дигідроксипропанова кислота
Під дією сильних окислювачів відбувається розрив молекул за подвійним зв’язком і утворюється суміш різних карбонових кислот:
СН3 – СН = СН –СООН + 4[О] → CН3СООН + НООС – СООН
кротонова кислота оцтова кислота щавлева кислота
Добування
Каталітичне окислення алкенів з проміжним одержанням ненасичених альдегідів:
СН2 = С (СН3) – СН3 3[O] + H2O → СН2 = С (СН3) – СOOH + H2O
2-метилпропен метакрилова кислота
Каталітичне окислення альдегідів:
СН2 = СН – СОН + [O] → СН2 = СН – СООН
акролеїн акрилова кислота
Дегідрохлорування хлорпохідних насичених карбонових кислот:
СН3 – СНСІ – СООН → СН2 = СН – СООН + НСІ
2-хлорпропанова кислота акрилова кислота
Окремі представники одноосновних ненасичених кислот
Акрилова кислота (пропанова, етиленкарбонова кислота) СН2 = СН – СООН – рідина з різким подразнюючим кислим запахом, змішується з водою, етанолом, діетиловим етером. Акрилову кислоту, її метиловий естер і нітрил застосовують як мономери у виробництві полімерів різного складу і призначення, кислоту додають до друкарських фарб, лаків і паст. Солі та естери називають акрилати.
Метакрилова кислота (α-метилакрилова кислота) СН2 = С (СН3) – СOOH ‑ безбарвна рідина з різким запахом, розчиняється у воді та багатьох органічних розчинниках. Солі та естери називають метакрилатамии. Одержують з ацетону. Метиловий естер метакрилової кислоти (метилметакрилоат) – мономер для одержання полі метилметакрилату, що становить основу плексигласу (органічного скла). Метакрилову кислоту застосовують у виробництві карбоксилатних каучуків, іонообмінних смол, поліакрилових клеїв. Окремі солі метакрилової кислоти застосовуються як емульгатори.
Кротонова кислота СН3 – СН = СН –СООН – тверда речовина, розчиняється у воді й органічних розчинниках, існує у вигляді двох просторових ізомерів (найстійкіший транс-ізомер). Солі та естери називають кротоноатами. У ветеринарній практиці кротонова олія використовується як послаблюючий засіб, в органічному синтезі – для одержання треонін, в парфумерії – для одержання запашних речовин.
Сорбінова кислота (2,4-гександієнова кислота) СН3 – СН = СН – СН = СН – СООН – безбарвна кристалічна речовина, не розчиняється у воді і розчиняється в етанолі. Використовують як консервант у виробництві плодово-ягідних соків, сиропів, м’ясних і рибних консервів, сирів, кулінарних і кондитерських виробів, майонезу, у синтезі фунгіцидів.
Олеїнова кислота (цис-октадецилова кислота) С17Н33СООН –безбарвна масляниста рідина, без запаху, не розчиняється у воді, розчинна в органічних розчинниках. Вперше виділена з продуктів гідролізу рослинних олій. Одержують гідролізом жирів і олій з наступним фракціонуванням суміші кислот і багаторазовою перекристалізацією. На олеїнову кислоту багаті маслинова, мигдальна, соняшникова олії.
Лінолева кислота (лляна кислота, 7,10-октадекадієнова кислота) С17Н31СООН (містить два подвійних зв’язки) – безбарвна масляниста рідина, не розчиняється у воді, розчинна в органічних розчинниках. Міститься у всіх оліях. Особливо багато її входить до складу тригліцеридів лляної олії (близько 50%). одержують гідролізом жирів і олій. Належить до незамінних жирних кислот (НЖК): не синтезується в організмі людини і тварини. Є складовою частиною вітаміну F, компонентом лікарського препарату лінетолу.
Ліноленова кислота (7,10,13-октадекатриєнова кислота) С17Н29СООН (містить три подвійних зв’язки) – безбарвна масляниста рідина, не розчиняється у воді, розчиняється в органічних розчинниках. Складова частина тригліцеридів жирів і олій, її багато в лляній, конопляній оліях. Належить до незамінних жирних кислот (НЖК). Є складовою частиною вітаміну F.
Арахідонова кислота (цис-5-цис-8-цис-11-цис-14-ейкозантетраєнова кислота) С19Н31СООН (містить 4 подвійні зв’язки) – безбарвна масляниста рідина, не розчиняється у воді, розчиняється в органічних розчинниках. Входить до складу тваринних жирів (вершкове масло) і рослинних олій. Швидко окислюється на повітрі. Типова НЖК, складова частина вітаміну F.
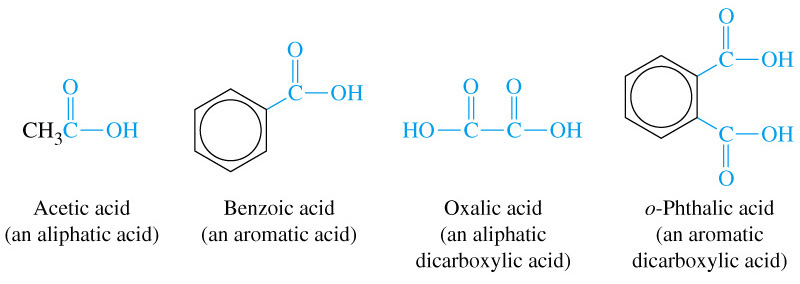
Ароматичні карбонові кислоти
Ароматичні кислоти – похідні бензену і його гомологів, у молекулі яких Гідроген бензенового ядра заміщений на групу –СООН.
|
|
|
Бензойна кислота (бензенкарбонова кислота) |
о-Фталева кислота (о-фенілдикарбонова кислота) |
м-толуїлова кислота (3-метилбензенкарбонова кислота) |
Фізичні властивості
Кислоти – безбарвні кристалічні речовини, погано розчинні у воді, краще – в етанолі та діетиловому етері. Найбільшу температуру плавлення мають н-ізомери.
Бензойну кислоту застосовують як антисептик, фунгіцид, консервант, вихідну речовину для синтезу барвників, багатьох медикаментів, запашних сполук. Похідної бензойної кислоти є сахарин, який в 400 разів солодший за сахарозу, натрієву сіль сахарину застосовують як замінник сахарози.
Хімічні властивості
Визначаються наявністю в молекулі кислот карбокисльої групи і бензенового кільця, а також її взаємним впливом. Група –СООН відноситься до електроноакцепторних замісників (замісники ІІ роду), які знижують електронну густину бензенового ядра і зменшують його реакційну здатність в реакціях електрофільного заміщення: спрямовує входження іншого замісника в мета-положення.
За рахунок впливу бензенового бензенового ядра на групу –СООН збільшується полярність зв’язку –ОН, атом Гідрогену стає більш рухливим, що сприяє підвищенню здатності до дисоціації бензойної кислоти порівняно з кислотами жирного ряду.
Дисоціація: С6Н5 ‑ СООН ↔ С6Н5 – СОО- + Н+
Взаємодія з лугами, утворюються солі:
С6Н5 ‑ СООН + КОН → С6Н5 ‑ СООК + Н2О
бензойна кислота бензоат калію
Взаємодія з РСІ5 і утворення галегноангідридів ароматичних кислот:
С6Н5 ‑ СООН + РСІ5 → С6Н5 – СО – СІ + РОСІ3 + НСІ
бензойна кислота хлорангідрид бензойної кислоти (бензоїлхлорид)
Заміщення атому Гідрогену в бензеновому ядрі (нітрування):
 СООН СООН
СООН СООН

+ HNO3 + Н2SО4 + Н2О
 t
= 900C
NO2 3-нітробензойна
кислота
t
= 900C
NO2 3-нітробензойна
кислота
Гідрування бензенового ядра. Атомарний Гідроген у момент виділення при високій температурі (каталізатор Ni, Pt) сприяє розриву подвійних зв’язків у бензеновому ядрі і приєднанню до нього Гідрогену:
С 6Н5 ‑ СООН + 4Н СООН
бензойна кислота гексагідробензойна кислота
Солі карбонових кислот. Мила. Миючі засоби
Мила – це солі, звичайно калієві та калієві, вищих карбонових кислот, нафтенових і смоляних кислот.
С17Н35СООNa – стеарат натрію; С15Н31СООК – пальмітат калію.
Натрієві солі ВЖК(натрієві мила) – тверді речовини, калієві мила – рідкі, добре розчинні у воді.
За свідченням Плінія Старшого мила використовувалися стародавніми галами й германцями. Згадка про мила є в працях римського лікаря Галена (ІІ ст. до н.е.). Миловаріння виникло в ІХ ст. Близькі за своєю дією до мил поверхнево-активні речовини (ПАР), розчини яких, як і мил, здатні очищувати поверхні. предметів.
Одержання мил:
Гідроліз (омилення) жирів при наявності лугів:

Дією соди на вищі жирні кислоти:
С17Н35СООН + Na2СО3 → С17Н35СООNa + СО2 + Н2О
стеаринова кислота стеарат натрію
З вищих вуглеводнів нафти – парафін. Парафін окислюють до карбонових кислот (суміш), виділяють із суміші потрібні кислоти і дією соди переводять їх у натрієву сіль.
Властивості розчинів мил і солей карбонових кислот:
дисоціація:
С17Н35СООNa С17Н35СОО- + Na+
гідроліз розчинних солей (лужна реакція середовища, фенолфталеїн набуває малинового забарвлення), солі утворені аніоном слабкої карбонової кислоти і катіоном сильної основи, утворюється карбонова кислота (ВЖК нерозчинна у воді) і луг (шкідливий для шкіри рук). Як приклад – гідроліз стеарату натрію С17Н35СООNa:
С17Н35СОО- + НОН ↔ С17Н35СООН + ОН-
С17Н35СОО- + Na+ + НОН ↔ С17Н35СООН + ОН- + Na+
С17Н35СООNa + Н2О ↔ С17Н35СООН↓ + NaОН
сплавлення з лугом:
![]()
електроліз:
![]()
взаємодія з розчинними солями. Мила втрачають мийну здатність у твердій воді (утворюються малорозчинні солі кальцію та магнію вищих карбонових кислот):
2С17Н35СООК + Са(НСО3)2 → (С17Н35СОО)2Са↓ + 2КНСО3
стеарат калію стеарат кальцію
взаємодія з мінеральними кислотами. Мила не можна використовувати в кислому середовищі (розкладаються з утворенням ВЖК):
С17Н35СООК + НСІ → С17Н35СООН↓ + КСІ
стеарат калію стеаринова кислота
Мило добре миє тільки в гарячій воді, особливо при кип’ятінні, що послаблює міцність волокон (шовк). Мила застосовують не тільки як мийний засіб. Вони є компонентами мастил, реагентами для флотації.
Крім мила розроблені інші мийні засоби (СМЗ), які виробляють без використання жирів. Синтетичні мийні засоби (детергенти) є композиціями різного складу таких речовин: поверхнево-активні речовини (ПАР), відбілювачі, парфумерні віддушки, фосфати, силікати, борати.
Поверхнево-активні речовини – речовини, що знижують поверхневий натяг на межі поділу фаз вода-повітря. Основна ознака зниження поверхневого натягу – спінювання.
Особливості фізико-хімічних властивостей розчинів мил: розбавлені водні розчини мил та особливо спиртові мають властивості істинних розчинів (молекулярних), а концентровані водні розчини виявляють властивості колоїдних систем, зокрема здатність до коагуляції, або «висалювання», при додаванні електролітів (хлорид натрію).
Звичайні продажні мила – колоїдні системи, які містять значну кількість води, а часто також домішки інших мінеральних і органічних речовин.
Розчини мила є стабілізаторами дисперсних систем завдяки їхній будові. Мила – дифільні молекули, складаються з:
При малих концентраціях дифільні молекули цих речовин знаходяться в розчині у вигляді окремих молекул або іонів, при підвищенні концентрації вони утворюють асоціати колоїдних розмірів – міцели. |
|
Міцели у розчинах мила здатні до тривалого існування, але вони є оборотними: розведення розчину спричиняє розпад міцел на молекули мила. Мила та миючі засоби належать до групи колоїдних поверхнево-активних речовин. |
а – молекула ПАР; b – стабілізація емульсії ПАР (емульгатором) |
Миюча дія мил – це складний фізико-хімічний процес. Починається з адсорбції мил поверхнею, яка повинна бути очищена від бруду. Молекули мил (ПАР) знижують поверхневий натяг грязьової плівки і сприяють змочуванню її частинок миючою рідиною. Між гідрованими частинками бруду виникає розклинюючий тиск, під впливом якого вони відкриваються від забрудненої поверхні. У мильному середовищі після цього виникають суспензії та емульсії, що стабілізуються колоїдними міцелами мила або іншого засобу. Утворена при цьому піна виносить частинки бруду із забрудненої поверхні. Цей процес прискорюють тертям.
Класифікація мийних засобів
І. Іоногенні мийні засоби
1.1. Аніоноактивні речовини – внаслідок іонізації утворюють у водних розчинах поверхнево-активні аніони, які здатні до агрегації, утворюючи при цьому міцели.
С17Н35СООNa С17Н35СОО- + Na+ (дисоціація стеарату натрію)
Мило (стеарат натрію) ПАР-аніон поверхнево-неактивний катіон
Іонізація алкілсульфатів-сульфоефірів вищих спиртів та їх солей (синтетичні миючі засоби):
СН3(СН2)10СН2ОSO3Na СН3(СН2)10СН2ОSO-3 + Na+
Додецилсульфат натрію поверхнево-активний поверхнево-неактивний
аніон катіон
Сульфокислоти та їх солі з одновалентними та багатовалентними катіонами достатньо добре розчиняються у воді з утворенням водних розчинів з характерними ознаками „мильних” розчинів. Використовуються як миючі засоби в твердій воді та навіть в кислому середовищі.
Катіоноактивні мийні засоби – внаслідок іонізації утворюють в розчинах поверхнево-активні катіони, здатні до агрегації та утворення міцел. Належать солі амінів, четвертинних амонієвих основ і алкілпіридинових сполук. Поверхнево-активні іони таких речовин заряджені позитивно.
Зверніть увагу! Аніоно- та катіоноактивні ПАР не можуть бути одночасно присутніми у водному розчині, оскільки між їх великими поверхнево-активними іонами відбувається взаємодія з утворенням погано розчинних у воді сполук.
Амфолітні (амфотерні) мийні засоби – іонізуються з відщепленням невеликих поверхнево-активних катіонів і аніонів. Залежно від значення рН розчину вони можуть бути аніоноактивними (в лужному середовищі) або катіоноактивними (в кислому середовищі). Належать алкіламінокислоти RNHCOOH.
Амфотерні мийні засоби можна використовувати у твердій воді, вони є добрими емульгаторами. Через складність одержання та високу вартість амфолітні колоїдні поверхнево-активні сполуки не мали широкого застосування.
ІІ. Неіоногенні колоїдні ПАР (неіоногенні мийні засоби) – це речовини, .молекули яких не дисоціюють на іони. Молекули НПАР – дифільні. Їх одержують внаслідок взаємодії оксиду етилену зі спиртами, фенолами, жирними кислотами та іншими сполуками, що містять полярні групи, при цьому одержують сполуки типу R(OCH2CH2)mOH. Чим довший оксиетиленовий ланцюг, тим сильніші гідрофільні властивості сполуки. Неіоногенні мила використовуються як стабілізатори та емульгатори.
Переваги СМЗ:
здатні розчинятися в соляних і кислих розчинах;
при частому пранні не руйнують текстильних волокон;
миюча дія не зменшується в твердій воді;
зручні для прання різноманітних текстильних виробів, миття різного обладнання, комунікацій, посуду.
Недоліки СМЗ:
здатність викликати алергію;
забруднення навколишнього середовища (водойм). Надходження значної кількості СМЗ у водне середовище (при падінні з висоти) викликає утворення великої маси піни, яка вкриває поверхню водоймища, порушує в ньому газообмін, що призводить до загибелі флори і фауни.
Естери (складні ефіри)
R1 |
Естери – продукти заміщення Гідрогену гідроксильної групи карбонових і мінеральних кислот на карбоновий радикал. Розрізняють моноестери, диестери та поліестери. |
Для одноосновних кислот існують моноестери, для двоосновних і багатоосновних кислот – повні та кислі естери.
Ізомерія
ізомерія карбонових радикалів;
метамерія.
Номенклатура
Назва естеру складається від назви кислоти і спирту, що беруть участь у його утворенні. Для найменування естерів найчастіше використовують тривіальну (історичну) номенклатуру.
за номенклатурою ІЮПАК: беруть у вигляді радикалу назву спирту, додають найменування кислоти як вуглеводню і закінчення –оат.
оцтовоетиловий естер, етилацетат, етилетаноат.
СН3 – СН2 – СО – О – СН3 пропіоновометиловий естер, метилпропіонат, метилпропаноат.
Одержання естерів
Естери широко поширені в природі: естери низькомолекулярних і середніх карбонових кислот є складовими частинами ефірних олій багатьох рослин (оцтово ізоаміловий естер, «грушева есенція» входить до складу плодів груш і багатьох квіток), естери гліцерину і ВЖК – хімічна основа всіх жирів і олій.
реакція етерифікації (відбувається при взаємодії карбонових (і мінеральних) кислот зі спиртами у присутності каталізатора (Н2SО4):
реакція приєднання карбонових кислот до ацетилену:
СН ≡ СН + НО – ОС – СН3 → СН2 = СН – О –ОС – СН3
ацетилен оцтова кислота вінілацетат
одержання естерів з галоге ангідридів і спиртів (алкоголятів), реакція відбувається у присутності солей кадмію або цинку та температурі 2000С:
![]()
Хімічні властивості
Реакція гідролізу (омилення) естерів, оборотна реакція, відбувається повільно, у присутності мінеральних кислот або лугів реакція прискорюється. Реакція використовується для виділення естерів із сумішей і відокремлення їх від етерів і ацеталів:
![]()
Естери гідролізують в лужному середовищі, етери та ацеталі – тільки в кислому.
Реакція переестрифікації. При нагріванні естерів із спиртами у присутності сульфатної кислоти або алкоголятів (в лужному середовищі) відбувається обмін алкоксигрупами. При цьому утворюється новий естер, а в реакційне середовище повертається спирт, який раніше входив до складу залишку естеру:
![]()
оцтовоетиловий естер аміловий спирт оцтовоаміловий естер етиловий спирт
(етилетаноат) (н-амілетаноат)
Реакції відновлення. Відновники – алюмогідрати літію, натрію в киплячому спирті або Гідроген у складі купрумхромового каталізатора:
СН3 – СО ‑ ОС3Н7 + 4 [Н] → С2Н5ОН + С3Н7ОН
пропілетаноат етанол пропанол
Аміноліз естерів – при дії аміаку на холоді молекула естеру розщеплюється з утворенням амідів кислот:
![]()
Відношення естерів до окислення. Високу стійкість естерів до дії різних окислювачів використовують у хімічному синтезі або аналізі для захисту спиртових і фенольних груп. Для цього їх естерифікують , після чого зі сполуками естерної природи проводять необхідні хімічні реакції. Потім здійснюють гідроліз і одержують необхідні речовини.
Окремі представники естерів
Оцтовоетиловий естер (етиленетаноат) СН3СООСН3 – безбарвна рідина з фруктовим запахом, погано розчиняється у воді, добре – в етанолі. Застосовують як розчинник нітрату целюлози у виробництві фото-і кіноплівки, бездимного пороху, компонент фруктових есенцій для харчової промисловості.
Оцтовоізоаміловий естер (ізоамілетаноат, «грушева есенція») СН3СООС5Н11 – безбарвна рідина з запахом груш, погано розчинна у воді, добре – в етанолі, діетиловому етері. Застосовують як запашну і смакову речовину в харчовій промисловості, в парфумерії і як розчинник.
Ізовалеріаноізоаміловий естер (ізоамілвалеріат, «яблучна есенція») (СН3)2СН–СН2–СОО(СН2)СН–(СН3)2 –рідина з запахом яблук, погано розчиняється у воді, добре – в етанолі. Застосовують як фруктову есенцію в харчові промисловості.
Тринітрогліцерин (гліцеринтринітрат) – О2NOCH(CH2ONO2)2 ‑ масляниста рідина солодкого смаку, погано розчинна у воді, добре – в ацетоні й бензолі, при нагріванні та ударі вибухає. Тринітрогліцерини – складова частина динаміту, а 1%-ий розчин три нітрогліцерину в етанолі – кардіологічний лікарський засіб.
Гідроксикислоти
Гідроксикислоти (оксикислоти, спиртокислоти) – це похідні карбонових кислот, у радикалах яких один або кілька атомів Гідрогену заміщені на гідроксильні (спиртові групи) – ОН.
Класифікація гідроксикислот
За будовою радикала: ациклічні і циклічні (ароматичні, фенолкислоти);
За основністю: одноосновні, двохосновні, багато основні гідроксикислоти;
За атомністю: двоатомні, триатомні та багатоатомні. Атомність гідроксикислот визначається загальною кількістю гідроксильних груп, включаючи гідроксили карбоксильних груп.
|
|
НООС – СНОН –СНОН ‑СООН |
НОСН2 ‑ СООН |
Цитратна (лимонна кислота) – триосновна, чотириатомна |
Саліцилова кислота – одноосновна, двоатомна фенолкислота |
Тартратна кислота (винна) – двоосновна чотириатомна |
гліколева кислота – одноосновна, двоатомна |
Ізомерія
структурна ізомерія зумовлена будовою карбонового радикала (нормальний і розгалужений);
взаємне розміщення спиртової і карбоксильної груп (α-, β-, γ-положення спиртової групи відносно карбоксильної);
оптична ізомерія залежить від наявності в молекулах кислот асиметричних атомів Карбону.
Номенклатура
тривіальні назви: гліколева, лактатна, або молочна, тартратна, або винна, яблучна, цитратна, або лимонна);
номенклатура ІЮПАК: називають за відповідними назвами карбонових кислот, додаючи префікс гідрокси. Місце розміщення спиртового гідроксилу в карбоновому ланцюзі вказують цифрою, а нумерація починається від атома Карбону карбоксилу.
раціональна номенклатура: розміщення гідроксилу в карбоновому ланцюзі вказується літерами грецького алфавіту (α-, β-, γ), потім додається префікс «гідрокси» до тривіальної назви кислоти.
СН3 – СН(ОН) – СООН
лактатна кислота, 2-гідроксипропанова кислота, α-гідроксипропіонова кислота
Методи одержання гідроксикислот
неповне окислення гліколей:
![]()
1,2-пропандіол 2-гідроксипропанова кислота
приєднання води до ненасичених жирних кислот:
![]()
акрилова кислота 3-гідроксипропанова кислота
відновлення оксокислот (кетокислот):
![]()
3-оксобутанова кислота 3-гідроксибутанова кислота
гідроліз галогенопохідних жирних кислот:
![]()
хлороцтова кислота гліколева кислота
окислення гідроксиальдегідів:
![]()
3-гідроксибутаналь 3-гідроксибутанова кислота
окислення карбонових кислот з розгалуженим ланцюгом:
![]()
Хімічні властивості
Реакції, що характерні для карбоксильної групи:
дисоціація дуже легко дисоціюють на іони (чим ближче розміщена спиртова група до гідроксилу карбоксильної групи, тим сильнішою є кислота і тим більш яскраво виражені її кислотні властивості):
СН2ОН – СООН ↔ СН2ОН – СОО- + Н+
гліколева кислота
утворення солей при взаємодії з лугом:
СН3 ‑ СНОН – СООН + NaOH → СН3 ‑ СНОН – СООNa + Н2О
лактатна кислота лактат натрію
Утворення хлорангідридів:
СН3 ‑ СНОН – СООН + РСІ5 → СН3 ‑ СНОН – СО – СІ + РОСІ3 + НСІ
лактатна кислота хлорангідрид лактатної кислоти
Утворення амідів:
СН3 ‑ СНОН – СООН + NH3 → СН3 ‑ СНОН – СООNН4 → СН3 ‑ СНОН – СОNН2
лактатна кислота лактат амонію амід лактатної кислоти
реакції естерифікації (у присутності сульфатної кислоти):
СН3 ‑ СНОН – СООН + С2Н5OH → СН3 ‑ СНОН – СООС2Н5 + Н2О
лактатна кислота етиллактат
Реакції, що характерні для спиртових гідроксилів:
2.1. реакція окислення (при наявності в молекулі гідроксикислоти первинної групи – ОН утворюються альдегідокислоти, вторинної – кетокислоти):
СН2ОН – СООН + [О] → НОС – СООН + Н2О
гліколева кислота гліоксилова кислота
СН3 ‑ СНОН – СООН + [О] → СН3 ‑ СО – СООН + Н2О
лактатна кислота піровиноградна кислота
реакція естерифікації (при заміщенні у спиртовому гідроксилі гідроксикислот атома Гідрогену на радикал утворюються етери):
СН3 ‑ СНОН – СООН + С2Н5OH → СН3 – СН ‑ СООН + Н2О
│
О ‑ С2Н5
лактатна кислота етанол етер етиллактат
реакції з галогенводнями (НСІ, НВr), утворюються галогенозаміщені кислоти:
СН3 ‑ СНОН – СООН + HCІ → СН3 – СНСІ ‑ СООН + Н2О
2-хлорпропанова кислота
3. Реакції, що характерні лише для гідроксикислот:
3.1. розщеплення гідроксикислот. При нагріванні α-гідроксикислот з концентрованими мінеральними кислотами руйнується зв’язок С1 – С2 і утворюються карбонільні сполуки (альдегіди, кетони) і мурашина кислота:
R – CHOH – COOH H2SO4, t R –COH + HCOOH
гідроксикислота альдегід мурашина кислота
3.2. дегідратація гідроксикислот: при нагріванні α-гідроксикислот виділяється вода і утворюється циклічний естер – лактид. При нагріванні γ- і δ- гідроксикислот утворюються лактони – внутрішні естери. При дегідратації β-гідроксикислот утворюються ненасичені карбонові кислоти:
СН2ОН – СН2 – СООН → Н2О + СН2 = СН ‑ СООН
3-гідроксипропанова кислота акрилова кислота
Окремі представники гідроксикислот
Гліколева кислота (оксиоцтова кислота) НОСН2СООН – безбарвна кристалічна речовина, гігроскопічна, добре розчинна у воді та етанолі, при кип’ятінні розкладається. Солі та естери гліколевої кислоти – гліколяти. Застосовують при фарбуванні вовни, бавовняних тканин, дубленні шкір, як складову частину сумішей для електрополірування стальних і мідних виробів. Є у недозрілому винограді, цукровій тростині, листях винограду.
Лактатна кислота (молочна кислота, α-оксипропіонова кислота, 2 –гідроксипропанова кислота) СН3 – СНОН – СООН існує у вигляді двох оптичних ізомерів (правого і лівого) і рацемату. Лівообертаюча лактатна кислота утворюється під час бродіння сахаридів під впливом бактерій. Правообертаюча лактатна кислота, або м’ясомолочна кислота виникає внаслідок ферментативного розщеплення глікогену і глюкози в м’язах тварин. Молочна кислота – рацемат утворюється з вуглеводів внаслідок молочнокислого бродіння під впливом бактерій Bacillus lactic acidi:
С6н12о6 → 2сн3 – снон – соон
Молочна кислота – кінцевий продукт анаеробного розщеплення вуглеводів у живих організмах, за допомогою якого органи, тканини і клітина отримують енергію для свого існування. Лактатна кислота – природний консервант кормів, овочів і фруктів, необхідна речовина, яка виникає при переробці молока і молочних продуктів, виготовленні сирів, молочнокислих продуктів. Вона – важливий компонент дозрівання м’яса і м’ясопродуктів, її застосовують у текстильній промисловості при фарбуванні тканин, у шкіряному виробництві при вичинюванні шкір, у медицині, у харчовій промисловості – при виробництві цукерок і безалкогольних напоїв, як добавку при виготовленні хліба й хлібобулочних, кондитерських виробів, морозива, мармеладу. Солі – лактати.
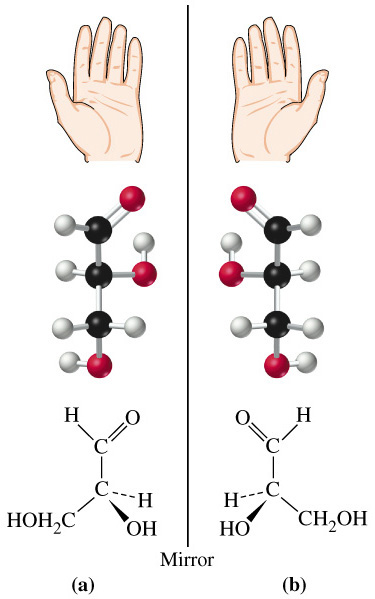
Оптична (дзеркальна) ізомерія
Теорія оптичної (дзеркальної ізомерії) Вант-Гоффа і Ле-Беля (1847р.): органічні речовини, що містять асиметричний атом Карбону, зв’язаний з чотирма атомами або групами атомів, виявляють оптичну активність.
Оптична (дзеркальна) ізомерія – це вид просторової ізомерії (стереоізомерії), що залежить від асиметрії молекули (від просторового розміщення чотирьох різних атомів або груп атомів навколо асиметричного атома Карбону), причому оптичні ізомери (стереоізомери) відносяться один до одного, як предмет до його дзеркального відображення. Оптична ізомерія пов’язана зі здатністю окремих груп органічних речовин у розчинах проявляти оптичну активність. Її виявляють за обертанням (відхиленням) площини поляризації на певний кут при проходженні поляризованого променя світла через розчин оптично активної речовини (французький фізик Ж.Б.Біо, 1815). Речовини, які здатні обертати площину поляризації світлового променя, називаються оптично активними. Кут на який оптично активні речовини відхиляли площину поляризації називають кутом обертання площини поляризації, або кутом поляризації. |
|
Оптичну активність вимірюють за допомогою поляриметра. Прилад має дві призми Ніколя – поляризатор, аналізатор, поляриметричну трубку, в яку наливають розчин оптично активної речовини, кругову шкалу для кількісного визначення оптичної активності.
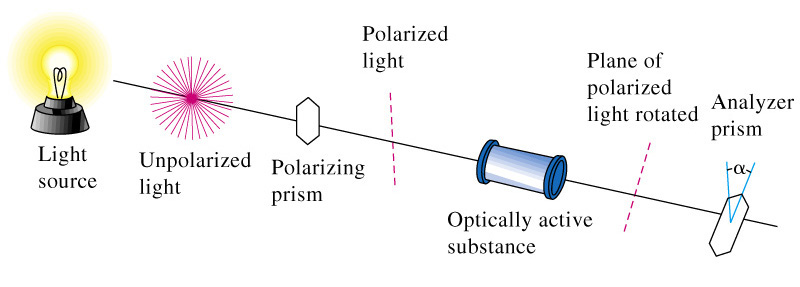
Згідно з електронною теорією світло – це поперечні електромагнітні хвилі. Частинки світла – фотони коливаються перпендикулярно напряму поширення хвилі. Такі світлові хвилі поширюються в просторі в різних напрямках.
Фотони в промені звичайного світла коливаються в різних площинах. Якщо такий промінь спрямувати на призму Ніколя, яка зроблена з кристалів іспанського шпату, він поляризується (електромагнітні коливання в ньому будуть проходити в одній площині). Площина, перпендикулярна площині коливання такого променя, називається площина поляризації.
Обертання (відхилення) площини поляризації на певний кут визначає оптичну активність речовини, через яку проходить даний промінь.
Оптично активні речовини існують у вигляді двох оптичних ізомерів. Один з них обертає площину поляризації світла праворуч, другий – на такий же кут ліворуч. Для позначення правого і лівого обертання користуються знаками (+) і (-), або літерами D (правий) і L (лівий), їх пишуть перед структурними формулами оптично активних речовин, щоб показати напрям їх оптичної активності.
Оптичні ізомери називають оптичними антиподами (енантіомерами).
М’ясомолочна кислота та молочна кислота, що утворюється при зброджуванні сахаридів, є дзеркальними ізомерами. Це виявляється в їх різній оптичній активності: м’ясомолочна кислота обертає площину поляризації світла праворуч, а молочна кислота, що утворюється внаслідок бродіння сахаридів – ізомер, що обертає площину поляризації світла ліворуч.
 СН3 СН3
СН3 СН3
| |
Н С ОН НО С Н (проекційні формули Фішера дзеркальних ізомерів | │ молочної кислоти ‑ антиподів)
СООН СООН
D(+)-лактатна L (-)-лактатна
кислота кислота
Вважають, що оптично активні речовини в проекційних формулах яких гідроксильна група розміщена праворуч від асиметричного атома Карбону відносяться до D-ряду, а ліворуч – L-ряду (еталон – гліцериновий альдегід). У підписах до формули оптично активної речовини D і L показують праву чи ліву конфігурацію її молекули. Знаки (+) чи (-) – праву або ліву оптичну активність речовини.
Оптично неактивні речовини, що складаються з однакових кількостей оптичних антиподів, називаються рацемічними сполуками (рацематами).
Оптично неактивною речовиною є молочна кислота з кислого молока. Це пояснюється тим, що молочна кислота бродіння є сумішшю однакових кількостей двох оптичних ізомерів проавообертаючого та лівообертаючого, тому результати їх оптичної активності взаємно знищуються.
У гліцеринових альдегідів і молочної кислоти конфігурації та знаки обертання співпадають (права конфігурація і праве обертання, ліва конфігурація і ліве обертання). У багатьох оптично активних речовин такого співпадання немає.

Еритроформи (два однакові бокові замісники у речовин з асиметричним атомом Карбону у формулі Фішера розміщено по один бік від головної осі), якщо по різні – треоформи.