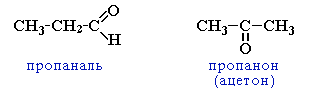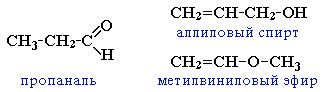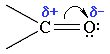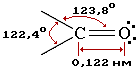- •Органічна хімія Опорні лекції Оксигенвмісні органічні сполуки
- •Реакції атома Гідрогену гідроксигрупи (реакції заміщення):
- •Реакції окислення:
- •Реакції радикала спирту
- •Окремі представники спиртів
- •Двоатомні та триатомні спирти. Багатоатомні спирти
- •Сн2он – сн (сн3) – снон ‑ сн2он
- •Окремі представники двоатомних, триатомних і багатоатомних спиртів
- •Дегідратація спиртів за допомогою мінеральних кислот:
- •Взаємодія алкоголятів з галогеналкілами:
- •Окремі представники етерів
- •Тіоспирти та тіоетери
- •Кумольний (кумельний) метод:
- •Одержання з ароматичних сульфосолей
- •Окремі представники фенолів
- •Альдегіди
- •Суміш вуглеводів
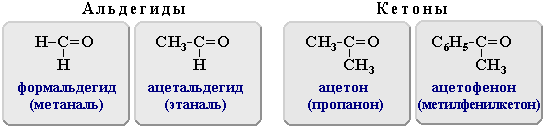
- •Окремі представники альдегідів
- •Окремі представники кетонів
- •Карбонові кислоти та їх похідні
- •Залежно від кількості карбоксильних груп:
- •Залежно від насиченості:
- •Одноосновні насичені кислоти
- •Реакції заміщення гідроксилу карбоксильної групи:
- •Реакції заміщення атому Гідрогену в α-положенні:
- •Реакції окислення:
- •Окремі представники одноосновних карбонових кислот
- •Двоосновні насичені кислоти
- •Окремі представники двоосновних насичених кислот
- •Ненасичені одноосновні кислоти
- •Окремі представники одноосновних ненасичених кислот
- •Ароматичні карбонові кислоти
- •Солі карбонових кислот. Мила. Миючі засоби
- •Гідроліз (омилення) жирів при наявності лугів:
- •Дією соди на вищі жирні кислоти:
- •Класифікація мийних засобів
- •Естери (складні ефіри)
- •Окремі представники естерів
- •Гідроксикислоти
- •Реакції, що характерні для карбоксильної групи:
- •Утворення хлорангідридів:
- •Утворення амідів:
- •Реакції, що характерні для спиртових гідроксилів:
- •3. Реакції, що характерні лише для гідроксикислот:
- •Окремі представники гідроксикислот
- •С6н12о6 → 2сн3 – снон – соон
- •Оптична (дзеркальна) ізомерія
Кумольний (кумельний) метод:
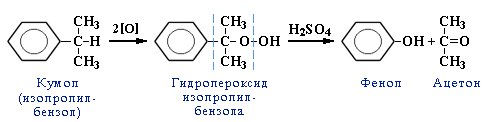
Вихідна речовина – кумен (ізопропілбензен), який одержують при алкілуванні бензену пропіленом (каталізатор АІСІ3).
кумен куменгідропероксид фенол ацетон
Одержують також ацетон.
Одержання з ароматичних сульфосолей
С6Н5 – SO3Na + 2NaOH → С6Н5 –ONa + Na2SO3 + H2O
натрієва сіль бензенсульфокислоти фенолят натрію
2С6Н5 –ONa + SO2 + H2O → 2С6Н5 –OH + Na2SO3
фенол
Окремі представники фенолів
Крезоли (метилфеноли, окситолуоли) СН3С6Н4ОН – кристалічні речовини, погано розчинні у воді, добре – в органічних розчинниках, суміш о-, м- і п-ізомерів. Одержують з кам’яновугільної смоли, після чого розділяють на індивідуальні представники фракційною дистиляцією. Використовують у ветеринарній практиці креолін (25-30% лужний розчин суміші крезолів) як дезинфекційний і профілактичний засіб.
Тимол (2-ізопропіл -5-метилфенол) – кристалічна речовина, погано розчиняється у воді, добре – в етанолі, діетиловому етері, бензені. Застосовують як антигельмінтний засіб, антисептик, фіксатор для біологічних рідин при проведенні біохімічного аналізу.
Пірокатехін (1,2 – діоксибензен) – двоатомний фенол – С6Н4(ОН)2 –біла кристалічна речовина, добре розчиняється у воді та етанолі. Застосовують для одержання адреналіну (гормону і лікарського засобу), як антисептик, компонент барвника для хутра.
Резорцин (1,3-діоксибензен) С6Н4(ОН)2 – безбарвна солодка кристалічна речовина, добре розчинна у воді, етанолі, діетиловому етері. Застосовується як антисептик, для виготовлення пломб у стоматології, як вихідна речовина для синтезу деяких фарб.
Гідрохінон (1,4-діоксибензен) С6Н4(ОН)2 – біла кристалічна речовина, добре розчиняється у воді, етанолі, діетиловому етері. Складова частина проявника у фотографії, а також хінгідронного електрода в рН-метрах, застосовують як інгібітор полімеризації. У тваринництві та харчові промисловості застосовують антиоксиданти фенольної природи для запобігання псуванню харчових продуктів.
Пірогалол (1,2,3-триоксибензен) – триатомний фенол ‑ С6Н3(ОН)3 – безбарвна кристалічна речовина, швидко темніє на відкритому повітрі. добре розчинна у воді, етанолі та діетиловому етері. Застосовують у виробництві барвників для хутра і волосся (вовни), як відновник в органічному синтезі, проявник у фотографії, присадку для мастил.
Альдегіди
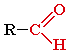
Альдегіди і кетони належать до оксосполук (карбонільних сполук). Це похідні вуглеводнів, в молекулах яких атом Гідрогену заміщений на одну або кілька карбонільних груп: |
|
|
|
альдегід |
кетон |
||
|
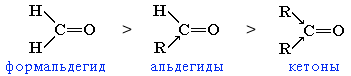
формальдегід > альдегід > кетон |
||
Класифікація:
ациклічні (насичені і ненасичені) та циклічні (похідні циклопарафінів, аренів);
за кількістю карбонільних груп – моно- і діальдегіди і дікетони.
|
|
|
|
|
|
Гомологічний ряд насичених альдегідів: НСОН, СН3СОН, С2Н5СОН, С3Н7СОН. |
|
Метаналь (мурашиний альдегід) |
Етаналь (оцтовий альдегід) |
Загальна формула ряду: СnH2nO |
|
Номенклатура
історична: альдегід називається кислотою, що утворюється при окисленні альдегіду (мурашиний альдегід, оцтовий, пропіоновий, масляний).
ІЮПАК: при найменуванні альдегідів їх називають по вуглеводню, додаючи суфікс –аль (нумерацію карбонового ланцюга починають від атома Карбону, де розміщена функціональна група). Наприклад, метаналь, етаналь, пропаналь, бутаналь.
Ізомерія
ізомерія карбонового ланцюга (з нормальним і розгалуженим):
ізомерія гомологічних рядів (альдегіди ізомерні кетонам, ненасиченим спиртам і простим етерам):
|
|
|
Фізичні властивості
Формальдегід – газ, наступні декілька гомологів – рідини, вищі представники – тверді речовини. Нижчі альдегіди розчинні у воді, мають різкий запах, середні (С3 – С8) – запах поту, вищі запаху не мають. Властивості змінюються із збільшенням молекулярної маси.
Будова карбонільної групи
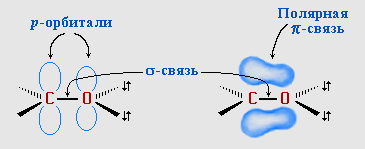
Висока хімічна здатність альдегідів обумовлена електронною будовою карбонільної групи. Зв'язок між атомами Карбону і Оксигену утворюється за рахунок двох пар електронів і здійснюється за рахунок σ- та π- зв’язків. Оксиген має більшу електронегативність тому електронна густина π-зв’язку зсувається до нього: |
|
|
Енергія подвійного зв’язку карбонільної групи вища, ніж в етилені, а довжина зв’язку між атомами С =О менша, ніж між С=С (відповідно 0,122 і 0,134 нм).
С = О зв'язок – сильно поляризований. Атом Карбону карбонільної групи з вираженими електрофільними властивостями може активно взаємодіяти з нуклеофільними реагентамми. Атом Оксигену набуває властивостей нуклеофілу і може активно взаємодіяти з електрофільними реагентами.
Атом Карбону в карбонільній групі знаходиться в стані sp2-гібридизації.
З шести валентних електронів атома Оксигену, зв’язаних з карбоновим атомом, один електрон йде на утворення σ-зв’язку між атомами Карбону і Оксигену, один – на утворення π-зв’язку, дві неподілені пари електронів атома Оксигену розміщаються на гібридизованих орбіталях, що знаходяться в площині σ- зв’язків. |
|
Частина молекули оксосполуки, в якій є карбонільна група, плоска і доступна для частинок реагентів зверху і знизу.
Зі збільшенням радіусів радикалів реакційна здатність оксосполук зменшується. тому альдегіди в хімічних реакціях більш активні, ніж відповідні ним кетони.
Хімічні властивості
Реакції нуклеофільного приєднання: нуклеофільна частинк атакує електрофільний центр молекули альдегіду (атом Карбону карбонільної групи С = О), приєднується до нього за рахунок своєї електронної пари. При цьому відбувається гетеролітичний розрив π-зв’язку С = О і пара електронів, що формує цей зв'язок переходить до атома Оксигену, надаючи його негативного заряду. Утворюється проміжна сполука – алкоксид-іон (властивості сильної основи). Потім алкоксид іон приєднує протон з середовища і стабілізується у кінцевий продукт хімічної реакції.
реакції приєднання водню в момент виділення (відновлення), утворюються відповідні первинні спирти:
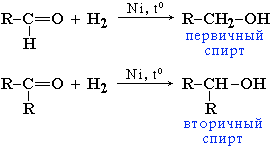
приєднання синільної кислоти (ціанід-іона). Реакцію проводять в лужному середовищі. реакцію використовують для синтезу α-гідроксикислот і α-амінокислот, а також для подовження карбонового ланцюга на один атом Карбону:
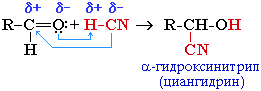 гідроксинітрил
(ціангідрин)
гідроксинітрил
(ціангідрин)
приєднання спирту до альдегіду призводить до утворення повних і неповних етерів (ацеталів і напівацеталів).
Напівацеталі – неповні етери альдегіду, нестійкі сполуки. Вони розкладають на вихідні речовини – альдегід і спирт. Гідроксил напівацеталю має підвищену реакційну здатність. При нагріванні альдегідів зі спиртами в присутності каталізатора (НСІ газоподібний), спочатку утворюється напівацеталь, а потім ацеталь (повний етер альдегіду).
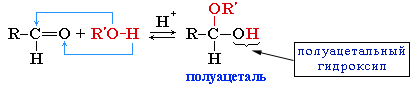
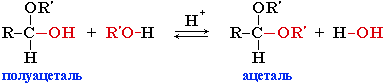
напівацеталь ацеталь
Ацеталі – стійкі речовини; це рідини з приємним запахом. У присутності кислот ацеталі гідролізують з утворенням альдегіду і спирту. Ацеталі можуть утворюватися при «дозріванні» або «старінні» вин внаслідок взаємодії етанолу з альдегідами. Вони створюють характерний аромат, або «букет» вина.
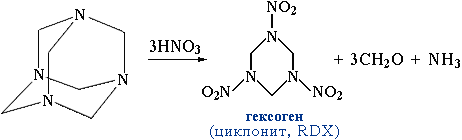
приєднання аміаку до формальдегіду лежить в основі одержання антисептику уротропіну (гексаметилентетраміну) – реакція Бутлерова, 1860:
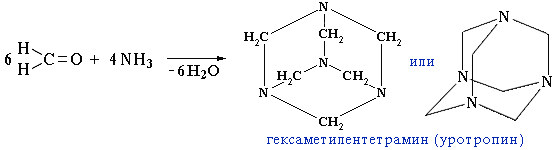
Уротропін використовують для виробництва фенопластів, як сировину для синтезу вибухових речовин (гексоген).
приєднання магнійорганічних сполук (реакція Гріньяра, 1912). В магнійорганічних сполуках зв'язок С – Мg поляризований, що призвело до утворення часткового негативного заряду на атомі Карбону, що спричиняє його нуклеофільність в реакціях приєднання. При розкладанні одержаних сполук утворюються відповідно первинні, вторинні та третинні спирти.
формальдегід метил магній бромід алкоголят первинний спирт
альдегід реактив Гріньяра алкоголят вторинний спирт
Реакції окислення протікають у альдегідів легко. Альдегіди окислюються слабкими окисниками (аміачний розчин оксиду аргентуму, гідроксид купруму, кисень повітря) у відповідні карбонові кислоти.
реакція «срібного дзеркала» ‑ якісна реакція на присутність у розчинах і біологічних рідинах альдегідів. Реакція відбувається при нагріванні. Аналітичний ефект: утворюється шар срібла (дзеркало) на стінках пробірки. Аміачний розчин оксиду аргентуму готують перед проведенням досліду:
NaOH + AgNO3 → Ag2O↓ + NaNO3
Ag2O↓ + 4NH4OH → 2 [Ag(NH3)2] OH + H2O
R – COH + 2 [Ag(NH3)2] OH → R – COOH + 2Ag↓ + 4NH3 + H2O
альдегід карбонова кислота
окислення гідроксидом купруму (ІІ) – реактивом Фелінга – якісна реакція на присутність у розчинах і біологічних рідинах альдегідів. Реакція відбувається при нагріванні. Аналітичний ефект: утворюється цегляно-червоний осад Сu2O. Використовують свіжо виготовлений осад Сu(ОН)2:
CuSO4 + 2NaOH → Na2SO4 + Cu(OH)2↓
R – COH + 2Cu(OH)2↓ → R – COOH + Cu2O↓ + 2H2O
Реакції заміщення атомів Гідрогену, що знаходяться в α-положенні по відношенню до карбонільної групи. Для них характерна висока рухливість внаслідок зменшення електронної густини у даного атома карбонільної групи: