- •Органічна хімія Опорні лекції Оксигенвмісні органічні сполуки
- •Реакції атома Гідрогену гідроксигрупи (реакції заміщення):
- •Реакції окислення:
- •Реакції радикала спирту
- •Окремі представники спиртів
- •Двоатомні та триатомні спирти. Багатоатомні спирти
- •Сн2он – сн (сн3) – снон ‑ сн2он
- •Окремі представники двоатомних, триатомних і багатоатомних спиртів
- •Дегідратація спиртів за допомогою мінеральних кислот:
- •Взаємодія алкоголятів з галогеналкілами:
- •Окремі представники етерів
- •Тіоспирти та тіоетери
- •Кумольний (кумельний) метод:
- •Одержання з ароматичних сульфосолей
- •Окремі представники фенолів
- •Альдегіди
- •Суміш вуглеводів
- •Окремі представники альдегідів
- •Окремі представники кетонів
- •Карбонові кислоти та їх похідні
- •Залежно від кількості карбоксильних груп:
- •Залежно від насиченості:
- •Одноосновні насичені кислоти
- •Реакції заміщення гідроксилу карбоксильної групи:
- •Реакції заміщення атому Гідрогену в α-положенні:
- •Реакції окислення:
- •Окремі представники одноосновних карбонових кислот
- •Двоосновні насичені кислоти
- •Окремі представники двоосновних насичених кислот
- •Ненасичені одноосновні кислоти
- •Окремі представники одноосновних ненасичених кислот
- •Ароматичні карбонові кислоти
- •Солі карбонових кислот. Мила. Миючі засоби
- •Гідроліз (омилення) жирів при наявності лугів:
- •Дією соди на вищі жирні кислоти:
- •Класифікація мийних засобів
- •Естери (складні ефіри)
- •Окремі представники естерів
- •Гідроксикислоти
- •Реакції, що характерні для карбоксильної групи:
- •Утворення хлорангідридів:
- •Утворення амідів:
- •Реакції, що характерні для спиртових гідроксилів:
- •3. Реакції, що характерні лише для гідроксикислот:
- •Окремі представники гідроксикислот
- •С6н12о6 → 2сн3 – снон – соон
- •Оптична (дзеркальна) ізомерія
Дегідратація спиртів за допомогою мінеральних кислот:
Взаємодія алкоголятів з галогеналкілами:
СН2ОNa – СН2ОNa + 2СН3І → СН2ОСН3 – СН2ОСН3 + 2NaІ
динатрійетандіол диметиловий етер етандіолу
СН3І + СН3ОNa → СН3 – О ‑ СН3 + NaІ
метилат натрію диметиловий етер
Окремі представники етерів
Диметиловий етер СН3 – О ‑ СН3 ‑ газ, розчинний у воді, діетиловому і дипропіловому ефірах, етанолі. Застосовують в холодильних установках і холодильниках як холодоагент, наркотичний засіб.
Діетиловий (етиловий, сірчаний ) етер С2Н5 – О – С2Н5 ‑ безбарвна рідина, кипить при 34,50 С погано розчиняється у вод, добре в органічних розчинниках. Є найкращим розчинником ліпідів. Застосовують для інгаляційного наркозу. Вперше для інгаляційного наркозу діетиловий етер використав Видатний російський хірург М.І.Пирогов – засновник воєнно-польової хірургії – в роки Кримської війни (1853 – 1856). При порушеннях умов зберігання етеру можуть утворюватися токсичні і вибухонебезпечні сполуки – гідропероксиди.
Етиленоксид (оксид етилену) – безбарвна летка рідина. Відносить до циклічні етерів – епоксидів. Одержують окисленням етилену в присутності каталізаторів. Застосовують в органічному синтезі для одержання антифризів, миючих засобів, пластмас, емульгаторів, як пестицид. |
|
|
Діоксан – рідина, змішується з водою, етанолом, діетиловим етером, бензеном. Одержують з етандіолу дегідратацією. Застосовують як органічний розчинник. |
|
|
|
Діоксин (2,3,7,8-тетрахлордибензо-п-діоксин). Ця речовина навіть в дуже низьких концентраціях різко знижує імунітет людини до вірусних інфекцій и впливає на генетичний апарат. |
|
Діоксини ‑ узагальнена назва групи поліхлордибензопарадіоксинів (ПХДЦ), поліхлордибензодифуранів (ПХДФ) і поліхлордибіфенілів (ПХДФ). До діоксинів належать сотні хлорорганічних, броморганічних і змішаних хлорброморганічних цикличних естерів, з яких 17 є найбільш токсичними. Діоксины ‑ тверді безбарвні кристалічні речовини, хімічно інертні і термічно стабільні. Є техногенною отрутою. У природному середовищі швидко поглинаються рослинами, ґрунтом і різними матеріалами. Період напіврозпаду діоксинів у природі перевищує 10 років. Діоксин ‑ універсальна клітинна отрута, діє дуже повільно. При потраплянні в організм людини уражаються: підшлункова залоза, легені, імунна система, порушуються функції печінки, виникає ризик захворювання на рак. Зростає ймовірність хромосомних мутацій і народження уродів.
Тіоспирти та тіоетери
Тіоспирти (меркаптани, тіоли) – похідні вуглеводнів, в молекулах яких атом Гідрогену заміщено на тіольну групу – SH.
R – OH R
– S – H (тіоспирт,
тіол, меркаптан)
– OH R
– S – H (тіоспирт,
тіол, меркаптан)
R1 – O – R2 R1 – S – R2 (тіоетери)
Способи одержання
Меркаптани одержують дією калію або натрію гідроген сульфіду на галогенопохідні вуглеводнів:
R – СІ + NaSH → R – SH + NaCI
Тіоетери утворюються при взаємодії меркаптидів з галогенопохідними вуглеводнів:
R – S ‑Na + R1 – CI → R – S – R1 + NaCI
Фізичні властивості
Метилмеркаптан СН3SH – газ, його найближчі гомологи – рідини, вищі представники – тверді речовини. Меркаптани і тіоетери погано розчиняються у воді, добре – в органічних розчинниках. Мають гидкий запах. тому незначні кількості меркаптанів добавляють в горючі гази (природний газ) з метою виявлення їх витікання при неполадках газового обладнання. Киплять при більш низькій температурі, ніж відповідні їм спирти (відсутність водневих зв’язків).
Хімічні властивості
Меркаптани виявляють кислотні властивості: при дії лугів або оксидів важких металів утворюють меркаптиди).
С2Н5 SH + КОН → С2Н5SК + Н2О
етилмеркаптан етилмеркаптиат калію
2С2Н5 SH + НgО → (С2Н5S)2Нg + Н2О
етилмеркаптан діетилмеркаптиат меркурію
2С2Н5 SH + Рb(СН3СОО)2 → (С2Н5S)2 Рb + 2СН3СООН
етилмеркаптан діетилмеркаптиат плюмбуму (етантіолят плюмбуму)
Тіоетери утворюють комплекси з солями важких металів. За допомогою цієї реакції відкривають тіоетери:
R2S + HgCI2 → R2S · HgCI2
Тіоспирти і тіоетери вступають в реакції окислення:
2С2Н5SH + 3O2 → 2С2Н5 – SO3H етил сульфокислота
При окисненні киснем повітря утворюються дисульфіди.
Окремі представники
Іприт СІ – СН2 – СН2 – S – СН2 – СН2 – СІ – бура рідина із запахом гірчиці, погано розчинна у воді, добре – в органічних розчинниках. Іприт – отруйна речовина (ОР) шкіряно-наривної дії. Вперше був застосований як ОР в 1917р. німцями на західному фронті поблизу р.Іпр (Бельгія). Уражає шкіру, очі, органи дихання. Смертельна доза для людини – 0,2 мг/л.
Феноли
Феноли – ароматичні сполуки, що мають одну або декілька гідроксильних груп, зв’язаних з атомами Карбону бензенового ядра.
За кількістю –ОН-груп розрізняють:
|
|
|
|
Ізомерія і номенклатура
У гомологів фенолу існує ізомерія положення гідроксильної групи в бензеновому ядрі (о-, м- і п-положення).
|
|
|
1-окси-2-метилбензен 1-окси-4-метилбензен
|
Фізичні властивості
Феноли – тверді кристалічні речовини зі специфічним запахом, важкорозчинні у воді, утворюють з нею кристалогідрати, температура плавлення в яких нижча, ніж у вихідних фенолів, добре розчиняються в органічних розчинниках.
Фенол С6Н5ОН (оксибензен, гідроксибензол, карболова кислота) – кристалічна речовина, на світлі рожевіє, плавить при 43 С, має специфічний запах, у воді розчиняється важко, добре – в органічних розчинниках. Фенол ‑ перший антисептик (англійський хірург Дж.Лістер, 1867). Антисептичні властивості обумовлені здатністю коагулювати білки, що призводить до загибелі мікроорганізмів.
Хімічні властивості
|
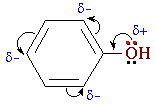
Радикал фенолу (бензенове кільце) здатний відтягувати електрони до себе, тобто є акцептором. Внаслідок зсуву пари електронів від атома Оксигену до атома Карбону бензенового ядра атом Оксигену, намагаючись компенсувати свій заряд, притягує до себе електронну густину зв’язку О – Н. Це призводить до підвищення полярності зв’язку С – Н і збільшення рухливості атома Гідрогену гідроксилу, що обумовлює кислотні властивості фенолів. |
При зміщенні електронів електронна густина в бензеновому ядрі перерозподіляється: вона підвищена в положеннях 2-, 4- і 6-, де і відбувається заміщення атомів Гідрогену.
І. Реакції заміщення в гідроксильній групі:
взаємодія фенолів з лугами – утворюються феноляти (феноксиди):
С6Н5ОН + NaOH → С6Н5ОNa + H2O
фенол фенолят натрію
взаємодія фенолів з лужними металами – утворюються феноляти (феноксиди) і виділяється водень:
2С6Н5ОН + 2Na → 2С6Н5ОNa + H2↑
фенол фенолят натрію
утворення комплексних солей – взаємодія з розчином хлориду феруму (ІІІ). Аналітичний ефект: поява фіолетового забарвлення розчину. Якісна реакція на фенол.
3С6Н5ОН + FeCI3 → (С6Н5О)3Fe + 3HCI
фенол фенолят феруму (ІІІ)
утворення етерів – в реакціях беруть участь феноляти і галогенопохідні вуглеводнів:
С6Н5ОNa + СН3Br → С6Н5ОСН3 + NaBr
фенолят натрію метилбромід метилфеніловий етер
утворення естерів відбувається при взаємодії фенолів з хлорангідридами або ангідридами карбонових кислот. Реакції легше протікають з фенолятами натрію або калію:

ІІ. Реакції заміщення в бензеновому ядрі
Група – ОН в бензеновому ядрі є орієнтантом І роду (електродонор для бензенового кільця), що дозволяє їй спрямовувати атаку електрофільних реагентів в орто- і пара-положення. Феноли вступають в реакції електрофільного заміщення значно легше, ніж арени.
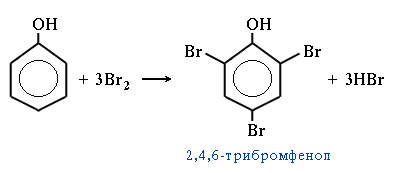
заміщення галогенами (бромування) – утворюється осад 2,4,6 – трибромфенолу (якісна реакція на фенол):
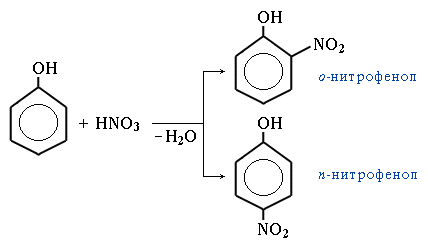
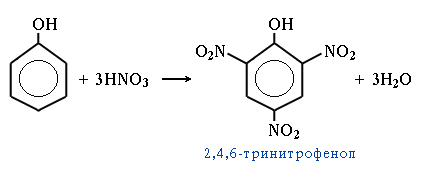
нітрування – при дії на фенол 20%-нітратної кислоти утворюється суміш о- і п-нітрофенолів, яку розділяють перегонкою з водяною парою (о-нітрофенол відганяється, а п-нітрофенол залишається у розчині). При нітруванні фенолу концентрованою нітратною кислотою утворюється 2,4,6 – тринітрофенол (пікринова кислота) – кристалічний осад жовтого кольору, при перегріванні вибухає.
|
|
Пікринову кислоту застосовують для фарбування тканин у текстильній промисловості, виготовлення вибухових речовин (фугасних бомб), лікування опіків (в медицині і ветеринарії), як сировину для одержання хлорпікрину (засобу для боротьби зі шкідниками сільськогосподарських культур).
ІІІ. Гідрування (гідрогенізація)
При нагріванні (t = 170 C) та у присутності Ni феноли можуть приєднувати водень, перетворюючись на спирти циклопарафінового ряду:
ОН ОН
 │
│
│
│
 + 3Н2
+ 3Н2
Ni, 170 C
фенол циклогексанол
Циклогексанол – органічний розчинник для масел та олій, восків і полімерів, барвників і реактивів, гомогенізуючий засіб для дезинфекційних сумішей. У великих дозах діє як наркотик.
ІV. Окислення
Феноли легко окислюються киснем повітря. При цьому їх забарвлення змінюється: вони стають рожевими, червонувато-рожевими або темними. Процес окислення протікає у декілька стадій за радикальним механізмом. Радикали нестійкі і вступають в різні хімічні реакції з утворенням димерів і полімерів. При інтенсивному окисленні фенолів сильними реагентами (хромова суміш) окислюються гідроксил і Гідроген бензенового ядра в пара-положенні з утворенням бензохінону, а при більш глибокому окисленні – і продукти розщеплення бензенового ядра:
ОН О
 │
║
│
║
[О]
п -бензохінон
-бензохінон
-Н2О
║
О
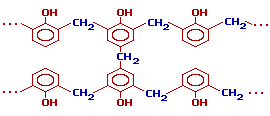
V. Утворення фенолформальдегідних смол при взаємодії фенолу з формальдегідом – реакція поліконденсації. Смолисті продукти називають «бакеліти».
|
При взаємодії фенолу та формальдегіду за умов високої температури і в присутності каталізатора спочатку утворюються о- і п-оксибензилові спирти |
Димери конденсуються і утворюються складну сітчасту структуру, в якій оксифенільні залишки з’єднуються між собою метиленовими містками:

Фенолформальдегідні смоли найчастіше використовують разом з іншими матеріалами (наповнювачами). До таких наповнювачів належать деревне борошно (фенолпласткарболіт), бавовнянопаперова тканина (текстоліт), папір (гетинакс), скляне волокно (склотекстоліт). |
|

Смоли широко використовують в машинобудівній промисловості, будівництві, при виготовленні лаків (новолачні полімери).
Методи одержання
З природної сировини – кам’яновугільної смоли (утворюється при сухій перегонці вугілля), букового дьогтю, кісточкової олії. З олій феноли одержують у вигляді фенолятів, які спочатку обробляють розчином лугу, а потім осаджують кислотами (сульфатна) і, використовуючи різні методи очистки, виділяють у чистому вигляді:
Аr – ONa + HOSO3H → Аr – OH + NaHSO4
фенолят натрію фенол
Спосіб Рашіга:
С6Н6 + ½ О2 + НСІ → С6Н5СІ + Н2О (t= 200 С)
С6Н5СІ + Н2О (пара) → С6Н5ОН + НСІ (гідроліз водяною парою, солі Сu, t = 500 C)