- •Органічна хімія Опорні лекції Оксигенвмісні органічні сполуки
- •Реакції атома Гідрогену гідроксигрупи (реакції заміщення):
- •Реакції окислення:
- •Реакції радикала спирту
- •Окремі представники спиртів
- •Двоатомні та триатомні спирти. Багатоатомні спирти
- •Сн2он – сн (сн3) – снон ‑ сн2он
- •Окремі представники двоатомних, триатомних і багатоатомних спиртів
- •Дегідратація спиртів за допомогою мінеральних кислот:
- •Взаємодія алкоголятів з галогеналкілами:
- •Окремі представники етерів
- •Тіоспирти та тіоетери
- •Кумольний (кумельний) метод:
- •Одержання з ароматичних сульфосолей
- •Окремі представники фенолів
- •Альдегіди
- •Суміш вуглеводів
- •Окремі представники альдегідів
- •Окремі представники кетонів
- •Карбонові кислоти та їх похідні
- •Залежно від кількості карбоксильних груп:
- •Залежно від насиченості:
- •Одноосновні насичені кислоти
- •Реакції заміщення гідроксилу карбоксильної групи:
- •Реакції заміщення атому Гідрогену в α-положенні:
- •Реакції окислення:
- •Окремі представники одноосновних карбонових кислот
- •Двоосновні насичені кислоти
- •Окремі представники двоосновних насичених кислот
- •Ненасичені одноосновні кислоти
- •Окремі представники одноосновних ненасичених кислот
- •Ароматичні карбонові кислоти
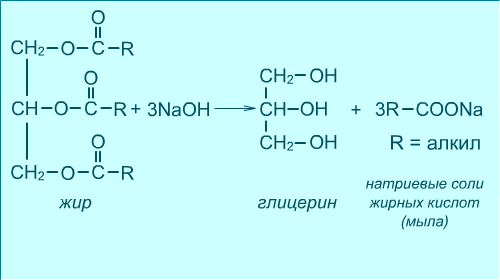
- •Солі карбонових кислот. Мила. Миючі засоби
- •Гідроліз (омилення) жирів при наявності лугів:
- •Дією соди на вищі жирні кислоти:
- •Класифікація мийних засобів
- •Естери (складні ефіри)
- •Окремі представники естерів
- •Гідроксикислоти
- •Реакції, що характерні для карбоксильної групи:
- •Утворення хлорангідридів:
- •Утворення амідів:
- •Реакції, що характерні для спиртових гідроксилів:
- •3. Реакції, що характерні лише для гідроксикислот:
- •Окремі представники гідроксикислот
- •С6н12о6 → 2сн3 – снон – соон
- •Оптична (дзеркальна) ізомерія
Сн2он – сн (сн3) – снон ‑ сн2он
2-метил-1,3,4-пропантріол
розміщення гідроксильних груп:
СН3 ‑ СНОН ‑ СНОН ‑ СН2ОН та СН2ОН – СН2 ‑ СНОН ‑ СН2ОН
1,2,3-бутантриол 1,2,4-бутантріол
Фізичні властивості
Тріоли – в’язкі рідини, солодкі, добре розчинні у воді, важчі за воду. Киплять при більш високих температурах , ніж відповідні алкоголі (наявність водневих зв’язків).
Хімічні властивості
Утворення гліцератів – взаємодія з металічним натрієм і гідроксидом купруму (ІІ) – якісна реакція на багатоатомні спирти. Аналітичний ефект: поява темно синього розчину гліцерату купруму (ІІ).
Утворення естерів – взаємодія з мінеральними і карбоновими кислотами:
![]()
гліцерин тринітрогліцерин
Тринітрогліцерин – хімічна основа динаміту. В медицині і ветеринарії використовується для лікування серцево-судинних захворювань у вигляді спиртових розчинів.
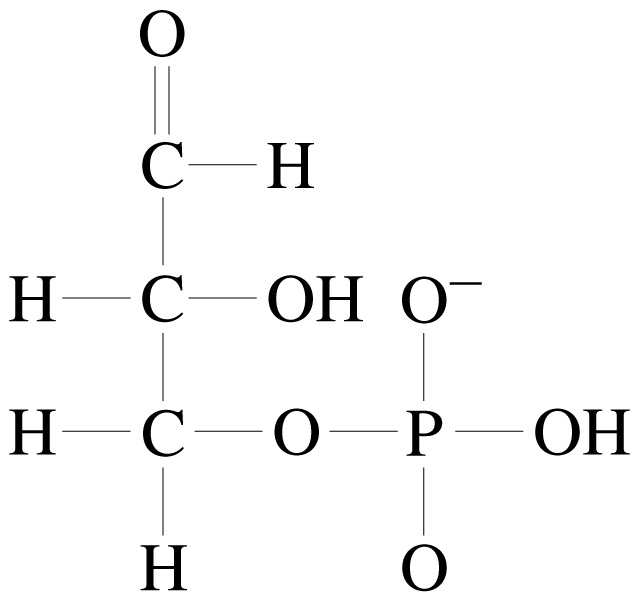
СН2ОН – СНОН ‑ СН2ОН + НО – Р (ОН)2 = О → СН2ОН – СНОН ‑ СН2О – Р – ОН
 (Н3РО4) ║
ОН
(Н3РО4) ║
ОН
О
гліцерин ортофосфорна кислота α-гліцерофосфат
Гліцерофосфати – продукти проміжного обміну вуглеводів і ліпідів в організмі людини і тварин. З них у тканинах і клітинах утворюються нейтральні жири, фосфатиди, глюкоза і глікоген. Гліцерофосфати – джерело хімічної енергії, що виділяється при реакціях окислювального фосфорилювання у вигляді АТФ та її структурних аналогів. |
|
СН2ОН – СНОН ‑ СН2ОН + 3С17Н35СООН → СН2 ‑ О – CO ‑ С17Н35
│
СН ‑ О – CO ‑ С17Н35 + 3H2O
│
СН2 ‑ О – CO ‑ С17Н35
Окиснення – при дії окислювачів (хромової суміші, перманганату калію):
СН2ОН – СНОН ‑ СН2ОН + 2[О] → CH2OH – CHOH – COH + H2O
гліцериновий альдегід
Утворення галогенопохідних – при взаємодії молекул спиртів з галогенводнями утворюються моно- і дигалогенопохідні тріолів:
С Н2ОН – СНОН ‑ СН2ОН + НСІ СН2СІ – СНОН ‑ СН2ОН + НСІ СН2СІ – СНОН ‑ СН2СІ
гліцерин монохлоргідрин дихлоргідрин
СН2СІ – СНСІ ‑ СН2СІ 1,2,3-трихлорпропан
Методи одержання
Гідроліз (омилення) жирів (одержання гліцерину), утворюються гліцерин і солі високомолекулярних жирних кислот (суміш):
Гліцеринове бродіння моносахаридів. Джерело – вуглеводи, мікроорганізми, в яких синтезуються ферменти гліцеринового бродіння:
С6Н12О6 → СН2ОН – СНОН – СН2ОН + СН3 – СОН + CO2
моносахарид гліцерин оцтовий альдегід
Синтетичний спосіб – вихідною речовиною є алкени крекінгу. Процес йде при високих температурах і в присутності каталізаторів (Сu2O). Спосіб простий, дешевий, заощадливий (по відношенню до витрат харчових жирів):
СН2 = СН – СН3 + СІ2 СН2 = СН – СН2СІ + NaOH СН2 = СН – СН2OH + [O] + H2O

 пропен
3-хлор-1-пропен
аліловий спирт
пропен
3-хлор-1-пропен
аліловий спирт
СН2ОН – СНОН ‑ СН2ОН
гліцерин
Окремі представники двоатомних, триатомних і багатоатомних спиртів
Етиленгліколь (етандіол) СН2ОН – СН2ОН – рідина, добре змішується з водою, спиртом, ацетоном. Одержують гідратацією етилену. Застосовують для синтезу пластмас, целофану, СВ, динітроетиленгліколю, діоксану, антифризів.
Пропіленгліколь (1,2-пропандіол) СН2ОН – СН ‑ СН2ОН – в’язка рідина, змішується з водою, спиртами, ацетоном у будь-яких співвідношеннях. Харчовий гліколі, який одержують внаслідок бродіння глюкози, використовують у кондитерській і фармацевтичній промисловості.
Гліцерин СН2ОН – СНОН ‑ СН2ОН – солодка сиропоподібна безбарвна рідина, добре розчинна у воді і етанолі Застосовують в органічному синтезі – для одержання три нітрогліцерину, алкідних смол, поліуретанів, акролеїну, як компонент антифризів, мастил. В медицині та ветеринарії гліцерин застосовують для виготовлення мазей, лініментів, емульсій, інших лікарських засобів і особливо вакцин.
Еритрит НОСН2(СНОН)2СН2ОН – тверда речовина, добре розчиняється у воді. Міститься в багатьох видах мохів і лишайників. Застосовують для виготовлення вибухових речовин, швидковисихаючих фарб, емульгаторів.
Ксиліт НОСН2(СНОН)3СН2ОН – тверді кристали, солодкі на смак, добре розчинні у воді. Одержують відновленням ксилоли. Застосовують у харчовій промисловості при виготовленні продуктів харчування для діабетиків, а аткож у виробництві алкідних смол, оліф, ПАР.
Пентаеритрит С(СН2ОН)4 – тверда речовина, погано розчинна у воді, добре – в органічних розчинниках. Застосовують для одержання алкідних смол, тетранітропентаеритриту (вибухової речовини), ПАР, пластифікаторів для одержання полівінілхлориду, синтетичних мастил. Має наркотичні властивості.
Маніт НОСН2(СНОН)4СН2ОН – тверда речовина, солодка на смак, розчинна у воді, гірше – в етанолі. Міститься у багатьох видах мохів, грибах, водоростях. Застосовується як діуретин і компонент косметичних виробів (мазей).
D-Сорбіт НОСН2(СНОН)4СН2ОН – тверда речовина, солодка на смак, розчинна у воді. На нього багаті плоди горобини і трояндових. Одержують відновленням глюкози. Він є проміжним продуктом у синтезі вітаміну С, відмінним діуретином, замінником сахарози для діабетиків.
Етери
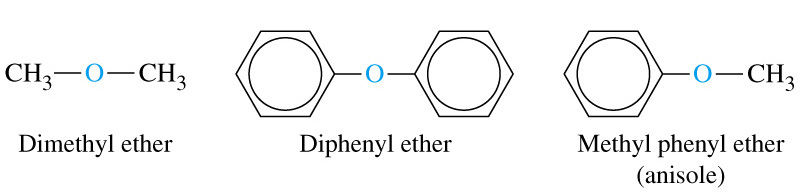
Етери – похідні спиртів, в молекулі яких атом Гідрогену гідроксигрупи – ОН, заміщений на карбоновий радикал R (однаковий або різні).
R1 – O – R2 |
|
|
R1, R2 ‑ радикали |
діетиловий етер дифеніловий етер метилфеніловий етер (анізол) |
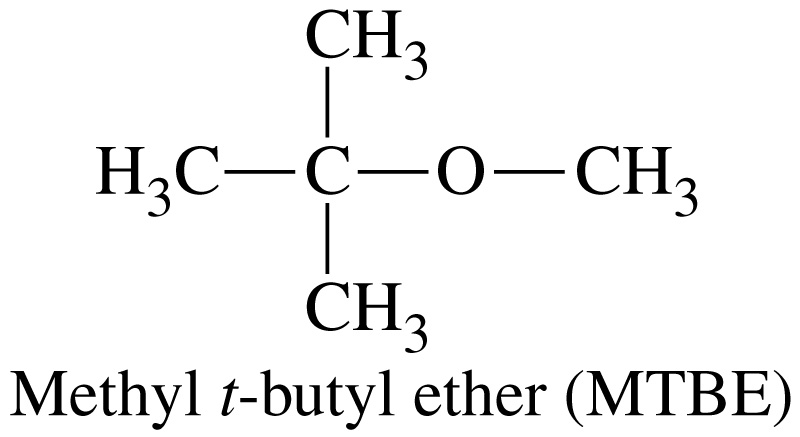
метил-третбутиловий етер |
Номенклатура
за раціональною номенклатурою етер називається діетиловим, дифеніловим, метил феніловим.
за номенклатурою ІЮПАК етери називають як похідні вуглеводнів, в молекулі яких атом Гідрогену заміщується на алкоксигрупу (R1 – O ‑) : етоксиетан.
Ізомерія
карбонового ланцюга;
метамерія – вид ізомерії, при якому два і більше етерів мають однакову молекулярну формулу, але різну будову молекул, обумовлену різними радикалами по обидва боки від кисневого «містка».
СН3 ‑ СН2 – О ‑ СН2 – СН3 СН3 – О – СН2 – СН2 – СН3
діетиловий етер метилпропіловий етер
Фізичні властивості
Диметиловий і метилетиловий етери – гази, наступні декілька представників – рідини, вищі – тверді речовини. Етери погано розчиняються у воді, добре – в органічних розчинниках. Діетиловий, пропілетиловий, дипропіловий ефіри – добрі органічні розчинники.
Хімічні властивості
Етери – хімічно інертні речовини. На них не діють розведені кислоти, луги і лужні метали. За особливих умов (t, Р, каталізатор) можуть вступати в деякі хімічні реакції.
Взаємодія з концентрованими галогенводневими кислотами:
СН3 ‑ СН2 – О ‑ СН2 – СН3 + 2НІ → 2С2Н5І + Н2О
діетиловий етер йодетан
Утворення пероксидів з киснем повітря (на світлі):
СН3 – О – СН2 – СН2 – СН3 О2, hν СН3 – СН – СН2 – СН3
 │
│
метилпропіловий етер О – ОН
гідропероксид метилпропілового етеру
Способи одержання