- •Органічна хімія Опорні лекції Оксигенвмісні органічні сполуки
- •Реакції атома Гідрогену гідроксигрупи (реакції заміщення):
- •Реакції окислення:
- •Реакції радикала спирту
- •Окремі представники спиртів
- •Двоатомні та триатомні спирти. Багатоатомні спирти
- •Сн2он – сн (сн3) – снон ‑ сн2он
- •Окремі представники двоатомних, триатомних і багатоатомних спиртів
- •Дегідратація спиртів за допомогою мінеральних кислот:
- •Взаємодія алкоголятів з галогеналкілами:
- •Окремі представники етерів
- •Тіоспирти та тіоетери
- •Кумольний (кумельний) метод:
- •Одержання з ароматичних сульфосолей
- •Окремі представники фенолів
- •Альдегіди
- •Суміш вуглеводів
- •Окремі представники альдегідів
- •Окремі представники кетонів
- •Карбонові кислоти та їх похідні
- •Залежно від кількості карбоксильних груп:
- •Залежно від насиченості:
- •Одноосновні насичені кислоти
- •Реакції заміщення гідроксилу карбоксильної групи:
- •Реакції заміщення атому Гідрогену в α-положенні:
- •Реакції окислення:
- •Окремі представники одноосновних карбонових кислот
- •Двоосновні насичені кислоти
- •Окремі представники двоосновних насичених кислот
- •Ненасичені одноосновні кислоти
- •Окремі представники одноосновних ненасичених кислот
- •Ароматичні карбонові кислоти
- •Солі карбонових кислот. Мила. Миючі засоби
- •Гідроліз (омилення) жирів при наявності лугів:
- •Дією соди на вищі жирні кислоти:
- •Класифікація мийних засобів
- •Естери (складні ефіри)
- •Окремі представники естерів
- •Гідроксикислоти
- •Реакції, що характерні для карбоксильної групи:
- •Утворення хлорангідридів:
- •Утворення амідів:
- •Реакції, що характерні для спиртових гідроксилів:
- •3. Реакції, що характерні лише для гідроксикислот:
- •Окремі представники гідроксикислот
- •С6н12о6 → 2сн3 – снон – соон
- •Оптична (дзеркальна) ізомерія
Двоатомні та триатомні спирти. Багатоатомні спирти
Двоатомні насичені спирти (гліколі) – похідні алканів, в молекулах яких два атоми Гідрогену біля двох атомів Карбону заміщені на гідроксигрупи.
Загальна формула гомологічного ряду алкадіолів: СnH2n(OH)2
Перший представник гомологічного ряду:
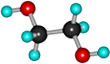
Етиленгліколь, етандіол СН2ОН – СН2ОН |
|
|
|
Номенклатура
раціональна: за основу беруть тривіальну назву алкану, до якої додають слово «гліколь».
ІЮПАК: до назви відповідного алкану додають суфікс –діол, перед назвою цифрами вказують місце розміщення спиртових груп у ланцюзі:
СН2ОН – СН2 – СН2ОН 1,3-пропандіол
Ізомерія
ізомерія карбонового ланцюга: СН2ОН – СН (СН3) – СН2ОН
2-метил-1,3-пропандіол
розміщення гідроксильних груп:
СН3 ‑ СНОН ‑ СН2 ‑ СН2ОН та СН3 – СН2 ‑ СНОН ‑ СН2ОН
1,3-бутандіол 1,2-бутандіол
Завдання. Скласти формули всіх ізомерів 1,2-пентадіолу.
Фізичні властивості
Гліколі – густі сироподібні рідини, солодкі на смак, без запаху. Вищі представники – кристалічні речовини. Розчинність гліколей у воді зменшується при збільшенні молекулярної маси. Гліколі киплять при більш високих температурах, ніж відповідні їм алканоли. Мають більшу густину, ніж алканоли.
Хімічні властивості
утворення гліколятів – взаємодія з лужними металами:
2 СН2ОН – СН2ОН + 2Na → 2СН2ОН – СН2ОNa + Н2
мононатрій гліколят
СН2ОН – СН2ОН + 2Na → СН2ОNa – СН2ОNa + Н2
динатрій гліколят
взаємодія з гідроксидом купруму (ІІ) – якісна реакція на діяльний фрагмент. Аналітичний ефект: поява темно синього забарвлення.

гліколят купруму
утворення естерів – взаємодія з органічними і мінеральними кислотами (реакція етерифікації):
СН2ОН – СН2ОН + НОNO2 -H2O СН2ОН – СН2ОNO2 -H2O СН2О NO2 – СН2ОNO2
е
 тандіол мононітроетандіол
динітроетандіол
тандіол мононітроетандіол
динітроетандіол
утворення продуктів дегідратації – внутрішньо молекулярна і міжмолекулярна дегідратації. Тип дегідратації залежить від умов перебігу реакції. Прикладом внутрішньо молекулярної дегідратації можу бути утворення ацетону з пропандіолу:
С Н3
– СНОН – СН2ОН -Н2О
СН3 – С – СН3
Н3
– СНОН – СН2ОН -Н2О
СН3 – С – СН3
1,2-пропандіол ║
О
Прикладом міжмолекулярної дегідратації є утворення етеру 1,4-діоксану:
 1,4-діоксан
1,4-діоксан
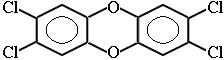 діоксин
діоксин
взаємодія з галогенопохідними алканів ‑ утворення етерів:
СН2ОNa – СН2ОNa + 2СН3І → СН2ОСН3 – СН2ОСН3 + 2NaІ
динатрійетандіол диметиловий етер етандіолу
реакції окислення:
С Н2ОН
– СН2ОН [О] [CH2OH
‑ COH] [О] CH2OH
– COOH [О] COOH – COH
Н2ОН
– СН2ОН [О] [CH2OH
‑ COH] [О] CH2OH
– COOH [О] COOH – COH
е тандіол гліоксаль гліколева кислота гліоксилова кислота
+ [О] COOH – COOH
оксалатна (щавлева) кислота
Методи одержання діолів
гідроліз дигалогенопохідних алканів (у присутності лугу):
СН3 ‑ СН2 ‑ СНСІ –СН2СІ + 2НОН → СН3 ‑ СН2 –СНОН ‑ СН2ОН + 2НСІ
1,2-бутандіол
гідроксилювання алкенів (реакція Вагнера) – окислення алкенів водним розчином КМnО4. Аналітичний ефект реакції: зникнення рожево-фіолетового забарвлення розчину перманганату.
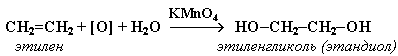

Триатомні спирти (гліцерини, алкантріоли) – похідні алканів, у молекулах яких три атоми Гідрогену біля різних атомів Карбону заміщені на гідроксигрупу.
Гліцерин, 1,2,3-пропантріол |
|
|
|
Загальна формула гомологічного ряду алкантріолів: СnH2n-1(OH)3
Номенклатура
Називаючи спирт, до найменування вуглеводню додають суфікс -тріол, перед яким цифрами вказують місце розміщення спиртових груп у карбоновому ланцюзі
Ізомерія
ізомерія карбонового ланцюга: