- •Органічна хімія Опорні лекції Оксигенвмісні органічні сполуки
- •Реакції атома Гідрогену гідроксигрупи (реакції заміщення):
- •Реакції окислення:
- •Реакції радикала спирту
- •Окремі представники спиртів
- •Двоатомні та триатомні спирти. Багатоатомні спирти
- •Сн2он – сн (сн3) – снон ‑ сн2он
- •Окремі представники двоатомних, триатомних і багатоатомних спиртів
- •Дегідратація спиртів за допомогою мінеральних кислот:
- •Взаємодія алкоголятів з галогеналкілами:
- •Окремі представники етерів
- •Тіоспирти та тіоетери
- •Кумольний (кумельний) метод:
- •Одержання з ароматичних сульфосолей
- •Окремі представники фенолів
- •Альдегіди
- •Суміш вуглеводів
- •Окремі представники альдегідів
- •Окремі представники кетонів
- •Карбонові кислоти та їх похідні
- •Залежно від кількості карбоксильних груп:
- •Залежно від насиченості:
- •Одноосновні насичені кислоти
- •Реакції заміщення гідроксилу карбоксильної групи:
- •Реакції заміщення атому Гідрогену в α-положенні:
- •Реакції окислення:
- •Окремі представники одноосновних карбонових кислот
- •Двоосновні насичені кислоти
- •Окремі представники двоосновних насичених кислот
- •Ненасичені одноосновні кислоти
- •Окремі представники одноосновних ненасичених кислот
- •Ароматичні карбонові кислоти
- •Солі карбонових кислот. Мила. Миючі засоби
- •Гідроліз (омилення) жирів при наявності лугів:
- •Дією соди на вищі жирні кислоти:
- •Класифікація мийних засобів
- •Естери (складні ефіри)
- •Окремі представники естерів
- •Гідроксикислоти
- •Реакції, що характерні для карбоксильної групи:
- •Утворення хлорангідридів:
- •Утворення амідів:
- •Реакції, що характерні для спиртових гідроксилів:
- •3. Реакції, що характерні лише для гідроксикислот:
- •Окремі представники гідроксикислот
- •С6н12о6 → 2сн3 – снон – соон
- •Оптична (дзеркальна) ізомерія
Миколаївський державний коледж економіки та харчових технологій
Циклова комісія природничо-наукових дисциплін

Органічна хімія Опорні лекції Оксигенвмісні органічні сполуки
|
|
|
|
|
|
Миколаїв-2011
Оксигенвмісні органічні сполуки – сполуки, які крім атомів Карбону та Гідрогену містять атоми Оксигену.

Функціональні
групи
Класи
Гідроксильні сполуки
Карбонільні
сполуки
Спирти
Спирти – похідні вуглеводнів, в молекулах яких один або декілька атомів Гідрогену біля насиченого атома Карбону заміщені на гідроксигрупу – ОН.
R – OH, де R – радикал (алкан, алкен, арен, алкадієн, циклоалкан, алкін).
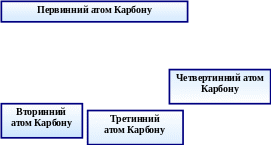
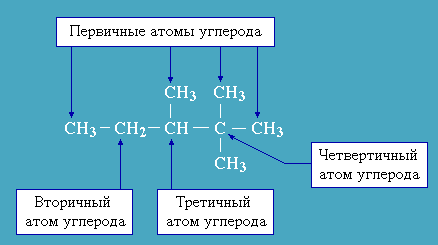
Класифікація спиртів
І. Залежно від природи радикала:
ациклічні (аліфатичного ряду);
циклічні спирти.
ІІ. Залежно від кількості гідроксильних груп:
|
|
|
|
ІІІ. Залежно від насиченості:
насичені;
ненасичені спирти.
ІV. Залежно від місця розміщення гідроксильної групи:
|
|
|
Загальна формула гомологічного ряду насичених одноатомних спиртів: СnH2n+1OH
Гомологічний ряд насичених одноатомних спиртів
метанол етанол 1-пропанол 2-пропанол
метиловий етиловий первинний пропіловий спирт вторинний пропіловий спирт
спирт спирт н-пропіловий спирт ізопропіловий спирт
Номенклатура
історична: за основу беруть найменування радикала у вигляді прикметника, вказують атом Карбону, біля якого розміщена група – ОН і додають слово «спирт».
ІЮПАК: назви спиртів утворюються від назви алканів з додаванням суфіксу –ол, після якого цифрою вказують місце розміщення спиртової групи в карбоновому ланцюзі. Нумерацію ланцюга починають з того краю, ближче до якого розміщена група – ОН: пропанол-1, пропанол-2; 2-метилпропанол-2.
УНКаХіТерН: рекомендує атом Карбону, біля якого розміщується групи –ОН, вказувати цифрою перед назвою карбонового ланцюга: 1-пропанол, 2,2-диметил-1-пропанол.
Ізомерія спиртів
ізомерія карбонового ланцюга
2-метил-1-пропанол 2-метил-2-пропанол
ізомерія положення гідроксильної групи:
![]()
1-пропанол 2-пропанол
міжкласова ізомерія (спирти насичені одноатомні спирти ізомерні простим етерам):
СН3 – СН2 – СН2 – СН2 –ОН ↔ СН3 – СН2 – О ‑ СН2 – СН3
1-бутанол діетиловий етер (простий ефір)
Фізичні властивості
Перші 11 спиртів гомологічного ряду – рідини, вищі спирти – тверді речовини. Метанол, етанол, пропанол мають запах алкоголю, середні – сивушних олій, вищі не мають запаху. Із збільшенням молекулярної маси зростають температури кипіння і плавлення спиртів, розчинність спиртів у воді зменшується.
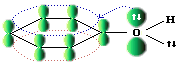
У спиртів висока температура кипіння, що пов’язано з асоціацією їх молекул за допомогою водневих зв’язків:
![]()
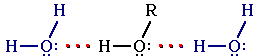
При переході спиртів з рідкого у газоподібний стан (при кипінні) руйнується водневий зв'язок.
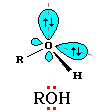
Будова гідроксильної групи та хімічні властивості спиртів Властивості спиртів визначаються наявністю в молекулі гідроксильної групи – ОН. Зв'язок О – Н ‑ полярний внаслідок зміщення електронної густини в бік Оксигену як більш електронегативного атома (притягує до себе спільну електронну пару і набуває частково негативного заряду, а атом Гідрогену – частково позитивного). |
|
|
|
Карбоновий радикал є донором електронів, що призводить до підвищення часткового негативного заряду на атомі Оксигену. Гідроген групи – ОН може відщеплюватися у вигляді протона – кислотні властивості. |
Н аявність
в молекулі спирту атома Оксигену, що
має неподілену електронну пару, визначає
основні властивості. Радикал, що
має частково позитивний заряд, є
електрофільним центром, і його
можуть атакувати нуклеофільні реагенти
(реакції заміщення в радикалі). Крім
того спирти можуть виконувати функції
нуклеофільних реагентів у хімічних
реакціях з іншими речовинами (молекули
містять Оксиген з неподіленою парою
електронів). Стан молекули спирту
характеризує схема:
аявність
в молекулі спирту атома Оксигену, що
має неподілену електронну пару, визначає
основні властивості. Радикал, що
має частково позитивний заряд, є
електрофільним центром, і його
можуть атакувати нуклеофільні реагенти
(реакції заміщення в радикалі). Крім
того спирти можуть виконувати функції
нуклеофільних реагентів у хімічних
реакціях з іншими речовинами (молекули
містять Оксиген з неподіленою парою
електронів). Стан молекули спирту
характеризує схема:

Хімічні властивості