
- •Лабораторна робота Кінетика і каталіз
- •Лабораторная работа №8 Химическое равновесие
- •8.1. Влияние концентрации исходных веществ и продуктов реакции на смещение равновесия реакции.
- •Домашняя работа №8 Химическое равновесие
- •Лабораторная работа № 9 Растворы
- •9.2. Определение концентрации раствора кислоты методом титрования
- •Домашняя работа №9 Растворы
- •Лабораторная работа №10 Окислительно-восстановительные реакции
- •10.1. Процессы при участии типичных окислителей
- •10.2. Процессы при участии типичных восстановителей
- •10.3. Процессы при участии соединений, которые могут служить как окислители и восстановители
- •10.4. Внутримолекулярные окислительно-восстановительные реакции
- •10.5. Межмолекулярные окислительно-восстановительные реакции
- •10.6. Влияние внешних факторов на ход окислительно-восстановительных процессов
- •Домашняя работа №10 Окислительно-восстановительные реакции
9.2. Определение концентрации раствора кислоты методом титрования
Определение концентрации раствора кислоты методом титрования заключается в определении объемов растворов, которые реагируют между собой. Зная эти объемы и молярную концентрацию эквивалента одного из растворов, можно вычислить концентрацию второго раствора.
Закрепленную в штативе бюретку наполните полностью (к отметке “0”) раствором соляной кислоты, концентрация которой известна. Наберите в пипетку 10 мл раствора щелочи KOH и перелейте его в коническую колбу. Добавляйте туда 1–2 капли фенолфталеина. Раствор будет окрашивающимся в малиновый цвет. Поставьте колбу под бюретку на чистый белый лист бумаги.
Из бюретки маленькими порциями (приблизительно по 0,2 мл) додавайте кислоту в раствор основы, который непрерывно перемешивайте. Место, в которое попадает кислота, на мгновение обесцвечивается. Цвет возобновляется во время перемешивания. Когда расцветка начнет появляться медленнее, начинайте доливать кислоту по одной капле и так продолжайте до тех пор, пока от одной капли раствор полностью будет обесцвечиваться. Это означает, что произошла полная нейтрализация щелочи и появление в растворе малейшего избытка кислоты. Определите и запишите объем раствора кислоты, который потрачен на нейтрализацию щелочи. Повторите процесс титрования еще дважды. Расхождение между результатами титрования не должно превышать 0,1 мл
Номер титрования |
Объем раствора основания VО, мл |
Молярная концентрация эквивалента основания NО, моль/л |
Объем раствора кислоты VК, мл
|
Молярная концентрация эквивалента кислоты NК, моль/л |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Средний объем использованного раствора кислоты, мл |
|
|
|
|
За средним значением объема кислоты вычислите молярную концентрацию эквивалента кислоты.
Когда NKOHVKOH = NHClVHCl вычисление нормальности кислоты методом титрования рассчитывают по формуле:
NKOH=NHClVHCl/VKOH
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Выводы: ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Дата защиты лабораторной работы _________
Оценка лабораторной работы ______________ Подпись преподавателя_________________
Домашняя работа №9 Растворы
Записать математическое выражение и словесное определение следующих понятий:
Процентная концентрация (массовая доля) ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Молярная концентрация ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Моляльная концентрация
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Молярная концентрация эквивалента ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Формулы для расчета температуры кипения и замерзания растворов
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Задачи для самостоятельного решения:
1. Какая масса натрий сульфата содержится в растворе массой 50г с массовой долей растворенного вещества 25%?
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
2. Рассчитайте массовую долю сахара в растворе, который содержит 200г воды и 50г сахара.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
3. Сколько граммов 5% раствора КСІ можно приготовить с 75г КСI?
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
4. Раствор содержит 75г соли, растворенной в 1000г воды, снижение температуры замерзания составляет 1,86К, криоскопическая постоянная воды равна 1,86К·кг/моль. Чему равняется молярная масса соли?
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
5. Определите молярную массу растворенного вещества, если при растворении его 18г в 200г воды снижение температуры замерзания составляет 0,93К. Криоскопическая постоянная воды равна 1,86К·кг/моль.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
6. В каком объеме раствора с концентрацией 1моль/л содержится 114г Al2(SO4)3?
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
7. 1мл 25%-ного раствора содержит 0,458г растворенного вещества. Какая плотность этого раствора?
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
8. В 0,6 л раствора калий гидроксида содержится 16,8г КОН. Определите молярную концентрацию КОН в растворе.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Оценка домашней работы ______________ Подпись преподавателя___________
Формула расчета |
Формула перерасчета |
Словесное обозначение |
|
|
Молярная концентрация
моль/л,
( число молей растворенного вещества в 1 л растворителя. |
|
|
Нормальная концентрация моль
экв./л,
(
число молей эквивалентов вещества, в 1 литре растворителя |
|
|
Моляльная концентрация моль/кг,
(
число молей v в 1 кг растворителя |
|
|
Массовая часть, или процентная концентрация (ω,
или
масса вещества растворенного в 100 г раствора. |
Примечание:
|
||

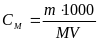 ,
,

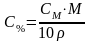
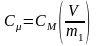
 ),
),
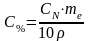
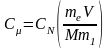
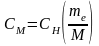
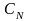 ),
),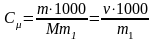



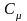 )
)

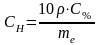

 )
) —
массы растворенного вещества,
растворителя и раствора;
—
массы растворенного вещества,
растворителя и раствора;
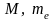 —
масса моля и моль эквивалента
растворенного вещества;
—
масса моля и моль эквивалента
растворенного вещества;
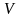 —
обьем раствора,
—
обьем раствора,
 —
плотность раствора;
—
плотность раствора;
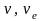 —
число молей и моль эквивалента вещества
соответственно
—
число молей и моль эквивалента вещества
соответственно