
- •Міністерство освіти і науки, молоді та спорту України
- •Методичні вказівки
- •Передмова
- •Загальні питання організації та проведення лабораторних робіт
- •Лабораторна робота № 1 визначення молярної маси еквівалентів металу об’ємним методом Теоретична частина
- •Експериментальна частина
- •Розрахунки
- •Контрольні завдання
- •Лабораторна робота №2 класи неорганічних сполук. Оксиди. Гідроксиди Теоретична частина
- •Експериментальна частина і. Добування та властивості основних оксидів
- •Іі. Добування і властивості кислотних оксидів
- •Ііі. Вивчення властивостей амфотерних оксидів
- •IV. Добування нерозчинних основ
- •V. Добування та властивості амфотерних гідроксидів
- •Контрольні запитання
- •Лабораторна робота №3 класи неорганічних сполук. Кислоти. Солі Теоретична частина
- •Експериментальна частина і. Добування середніх солей
- •Іі. Добування та властивості кислих солей
- •Ііі. Добування та властивості основних солей
- •Контрольні завдання
- •Експериментальна частина і. Проведення розрахунків
- •Іі. Приготування розчину
- •Ііі. Обрахунки результатів дослідів
- •Контрольні завдання
- •Лабораторна робота №5 реакції в розчинах електролітів Теоретична частина
- •Експериментальна частина Визначення величини рН розчинів електролітів
- •Контрольні завдання
- •Лабораторна робота № 7 гідроліз солей Теоретична частина
- •Експериментальна частина і. Визначення реакції середовища в розчинах солей
- •Іі. Фактори, які посилюють ступінь гідролізу солей
- •Контрольні завдання
- •Лабораторна робота № 8 окисно-відновні реакції Теоретична частина
- •Класифікація окисно-відновних реакцій
- •Правила складання рівнянь електронного балансу
- •Еквівалент і молярна маса еквівалентів окисника і відновника
- •Експериментальна частина Прості речовини та елементарні йони у якості окисників і відновників
- •Міжмолекулярні окисно-відновні реакції. Окисно-відновні властивості сполук сірки у залежності від її ступеня окиснення
- •Внутрішньомолекулярні окисно-відновні реакції. Розклад дихромату амонію
- •Складні йони в окисно-відновних реакціях. Відновлення дихромату калію калій йодидом
- •Значення середовища в окисно-відновних процесах
- •Контрольні завдання
- •Лабораторна робота № 9 визначення загальної лужності і карбонатної твердості води Теоретичний вступ
- •Експериментальна частина
- •Контрольні завдання
- •Лабораторна робота № 10 якісне дослідження природної води Теоретичний вступ
- •1. Головні йони
- •2. Розчинені гази
- •3. Біогенні речовини
- •4. Мікроелементи
- •5. Органічні сполуки
- •Експериментальна частина
- •1. Проба на присутність солей кальцію
- •2. Проба на присутність солей магнію
- •3. Проба на присутність хлоридів
- •4. Проба на присутність сульфатів
- •7. Проба на окиснюваність води
- •Контрольні завдання
- •Хід процесів висолювання білків
- •Згортання білків при нагріванні
- •Осадження білків концентрованими мінеральними кислотами
- •Осадження білків органічними кислотами
- •Осадження білків солями важких металів
- •Осадження білків фенолом і формальдегідом
- •Осадження білків спиртом
- •Осадження білків натрій вольфраматом
- •Контрольні завдання
- •Лабораторна робота № 12 визначення відносної молекулярної маси амінокислот за амінним нітрогеном Експериментальна частина
- •Контрольні завдання
- •Рекомендована література Базова
- •Допоміжна
Класифікація окисно-відновних реакцій
Окисно-відновні реакції поділяються на три типи:
міжмолекулярного окиснення-відновлення;
внутрішньомолекулярного окиснення-відновлення;
диспропорціонування (самоокиснення – самовідновлення).
До першого типу належать реакції, при перебігу яких електрони переходять від молекул одних речовин до молекул інших, тобто окисник і відновник представлені різними речовинами:
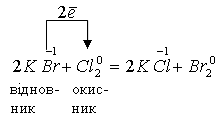
До другого типу належать реакції, які відбуваються із зміною ступенів окиснення різних атомів в одній молекулі. В цьому випадку атом, який має вищий ступінь окиснення, окиснює атом з нижчим ступенем окиснення:
![]() ;
;
![]() .
.
В реакціях третього типу вихідна речовина виявляє функції як окисника, так і відновника:
![]() .
.
Фосфатна(ІІІ) кислота (ступінь окиснення Фосфору +3) виступає одночасно окисником (Фосфор відновлюється до ступеня окиснення –3 в сполуці РН3) і відновником (Фосфор окиснюється до ступеня окислення +5 в фосфатній кислоті Н3РО4).
Реакції такого типу можливі, якщо відповідний елемент знаходиться в вихідній сполуці в проміжному ступені окиснення. В розглянутому прикладі ступінь окиснення Фосфору в вихідній сполуці (+3) має проміжне значення між можливим максимальним (+5) і мінімальним (-3) ступенями окиснення цього елемента.
Правила складання рівнянь електронного балансу
При складанні рівнянь електронного балансу виходять з того, що:
а) сума електронів, які беруть участь в реакції відновлення, дорівнює сумі електронів, які беруть участь в реакції окиснення;
б) алгебраїчна сума ступенів окиснення окремих атомів, відповідних молекул, дорівнює нулю;
в) визначають речовини, в яких атоми змінюють свій ступінь окиснення;
г) занотовують рівняння електронного балансу, в яких розраховується кількість електронів, які віддає відновник і приймає окисник;
д) зрівнюють кількості приєднаних і відданих електронів введенням множників, виходячи з найменшого загального кратного для коефіцієнтів у процесах окиснення й відновлення;
е) знайдені коефіцієнти підставляють у рівняння реакції перед відповідними формулами речовин у лівій і правій частинах.
ж) підбирають коефіцієнти для решти учасників реакції.
Приклад. Методом електронного балансу розставте коефіцієнти в рівнянні окисно-відновної реакції:
Р + НСlО3 + Н2O = Н3РO4 + НС1.
На початку складання рівняння реакції визначаємо елементи, що змінили ступінь окиснення, і складімо електронний баланс процесів окиснення й відновлення:
![]()
Ступінь окиснення змінюють Фосфор і Хлор. Складімо електронні рівняння:

Найменше спільне кратне дорівнює 30.
Знайдені коефіцієнти підставляємо до рівняння реакції:
6Р + 5НСlО3 + Н2O → 6Н3РO4 + 5НСl.
Порівняння лівої і правої частин рівняння показує, що для повного матеріального балансу в лівій частині перед Н2O треба виставити коефіцієнт 9.
Тоді в остаточному вигляді має місце наступне рівняння:
6Р + 5НСlО3 + 9Н2O → 6Н3РO4 + 5НСl.
Еквівалент і молярна маса еквівалентів окисника і відновника
В окисно-відновних
реакціях еквівалент
речовини –
це та умовна частинка (частка структурної
одиниці), яка приймає (окисник) або віддає
(відновник) один електрон. Так, в кислому
середовищі йон MnO4-
приймає 5 електронів, тому fекв
для KМnO4
дорівнює
![]() ,
а еквівалент калій перманганату -
,
а еквівалент калій перманганату -
![]() .
.
Молярна маса еквівалентів окисника дорівнює молярній масі окисника, поділеній на число приєднаних однією молекулою електронів.
Молярна маса еквівалентів відновника дорівнює молярній масі відновника, поділеній на число відданих однією молекулою електронів.
Визначимо еквіваленти і молярні маси еквівалентів окисника і відновника в такій окисно-відновній реакції:
![]()

Йон S2-
віддає 2 електрони, тому fЕКВ
для Н2S
дорівнює
![]() ,
а еквівалент
,
а еквівалент
![]() .
Йон SO32-
приймає 4 електрони, тому fЕКВ
для
H2SO3
дорівнює
.
Йон SO32-
приймає 4 електрони, тому fЕКВ
для
H2SO3
дорівнює
![]() ,
а еквівалент -
,
а еквівалент -
![]() .
.
Молярна маса еквівалентів відновника H2S:
![]() .
.
Молярна маса еквівалентів окисника H2SO3:
![]() .
.
