
- •Санкт-петербургская государственная химико-фармацевтическая академия
- •Часть 1
- •Под общей редакцией
- •Введение
- •1. Общие рекомендации
- •1.1. Проверка очевидного
- •1.2. Запись результатов эксперимента
- •1.3. Схемы и графики
- •1.4. Вычисления
- •2. Рекомендации по обработке результатов измерений
- •2.1. Погрешности измерений
- •2.2. Порядок обработки результатов прямых измерений
- •2.3. Пример обработки прямых измерений
- •Механика Лабораторная работа № 1 закон гука
- •Лабораторная работа № 2 определение периода свободных колебаний груза на пружине
- •Лабораторная работа № 3 изучение колебательного движения с помощью оборотного маятника
- •Лабораторная работа № 5 статистическая обработка результатов измерений периода колебаний пружинного маятника
- •Теоретическое значение периода колебаний
- •Экспериментальные значения периода колебаний
- •Сводная таблица результатов обработки экспериментальных данных
- •Лабораторная работа № 6 статистическая обработка результатов измерений периода колебаний крутильного маятника
- •Средние значения и погрешности измерения периода крутильных колебаний
- •Лабораторная работа № 12 определение момента инерции маятника обербека
- •Лабораторная работа № 13 определение момента инерции тела методом крутильных колебаний
- •Результаты измерений и вычислений момента инерции тела (диска, шара, кольца)
- •Лабораторная работа № 13а определение момента инерции тела методом крутильных колебаний
- •Молекулярная физика Лабораторная работа № 20 распределение максвелла
- •Задание 1 Получение функции распределения электронов по скоростям
- •Задание 2 Линеаризация графика функции распределения Максвелла
- •Результаты экспериментов
- •Данные для построения графика ln(f(X)/X)
- •Лабораторная работа № 21 определение коэффициента внутреннего трения жидкости методом стокса
- •Лабораторная работа № 23 распределение больцмана
- •Лабораторная работа № 24 определение отношения ср/cv методом клемана и дезорма
- •Задание 1 Определение показателя адиабаты для воздуха
- •Лабораторная работа №25 измерение коэффициента вязкости жидкости капиллярным методом
- •Электричество Лабораторная работа № 31 исследование электрического поля
- •Лабораторная работа № 33 измерение электродвижущей силы источника электрической энергии
- •Разделив равенства (3) и (2) почленно, получим
- •Лабораторная работа № 34 измерение сопротивлений методом моста постоянного тока
- •Лабораторная работа № 35 исследование цепи постоянного тока
- •Лабораторная работа № 36 исследование закона ома для линейных и нелинейных элементов электрической цепи
- •Лабораторная работа № 37 измерение сопротивления проводника
- •Результаты измерений сопротивления проводника по схеме 1
- •Результаты измерений сопротивления проводника по схеме 2
- •Список используемой литературы
- •Содержание
- •Часть 1
- •197376, Санкт-Петербург, ул. Профессора Попова, 14.
Лабораторная работа № 24 определение отношения ср/cv методом клемана и дезорма
Цель работы
Определение отношения теплоемкости газа при постоянном давлении (ср) и теплоемкости при постоянном объеме (cv) для воздуха методом Клемана и Дезорма.
Оборудование
1. Стеклянный баллон;
2. U-образный манометр;
3. Насос,
4. Секундомер.
Основные сведения
Теплоемкость тела (или системы) — это количество теплоты Q, необходимое для нагревания этого тела на один (градус) кельвин, Cтела=Q/T. Теплоемкость тела измеряется в Дж/К.
Теплоемкость моля вещества, называемую молярной теплоемкостью, будем обозначать с.
Молярная теплоемкость — количество тепла, необходимое для нагревания одного моля вещества на один кельвин. Имеем
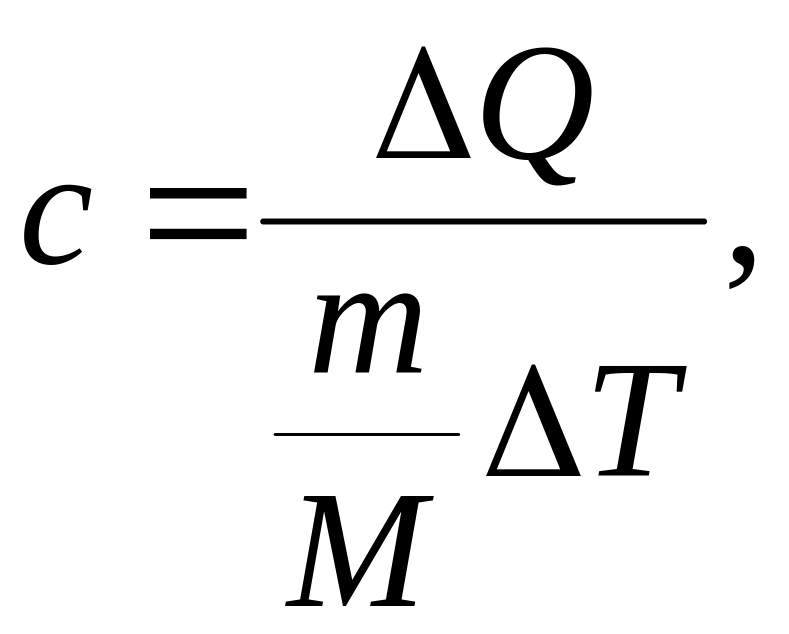 (1)
(1)
где М — молярная масса вещества, m – масса вещества.
В СИ молярная теплоемкость измеряется в Дж/моль.К. Заметим, что эта размерность совпадет с размерностью универсальной газовой постоянной R.
Теплоемкость вещества зависит от условий, при которых происходит нагревание газа. Наибольший интерес представляет теплоемкость для случаев, когда нагревание происходит при постоянном объеме или при постоянном давлении. В первом случае теплоемкость называется теплоемкостью при постоянном объеме (сV), во втором — теплоемкостью при постоянном давлении (ср).
Классическая теория теплоемкости приводит к следующим значениям удельных и молярных теплоемкостей
![]() (2)
(2)
![]() ,
(3)
,
(3)
где i — число степеней свободы.
Как видно из (2) и (3) сV и ср связаны между собой уравнением, ср- сV=R, которое называется уравнением Майера.
Отношение ср/ сV= входит в уравнение адиабатного процесса
рV = const (4)
или
![]() (5)
(5)
называют показателем адиабаты или коэффициентом Пуассона, т. к. уравнение (4) называют уравнением Пуассона.
Отношение ср/ сV= = i+2/i зависит от числа степеней свободы i, а это число зависит от атомности газа. Запишем:
— для одноатомных газов i = 3, =5/3=1,67
— для двухатомных газов i = 5, =7/5=1,4
— для многоатомных газов i = 6, =8/6=1,33
Экспериментальная установка состоит из стеклянного баллона А, соединенного с манометром В и насосом (рис. 24.1).
Кран С позволяет сообщать баллон А с атмосферой.
Если при помощи насоса накачать в баллон некоторое количество воздуха, то давление и температура воздуха внутри баллона повысятся.
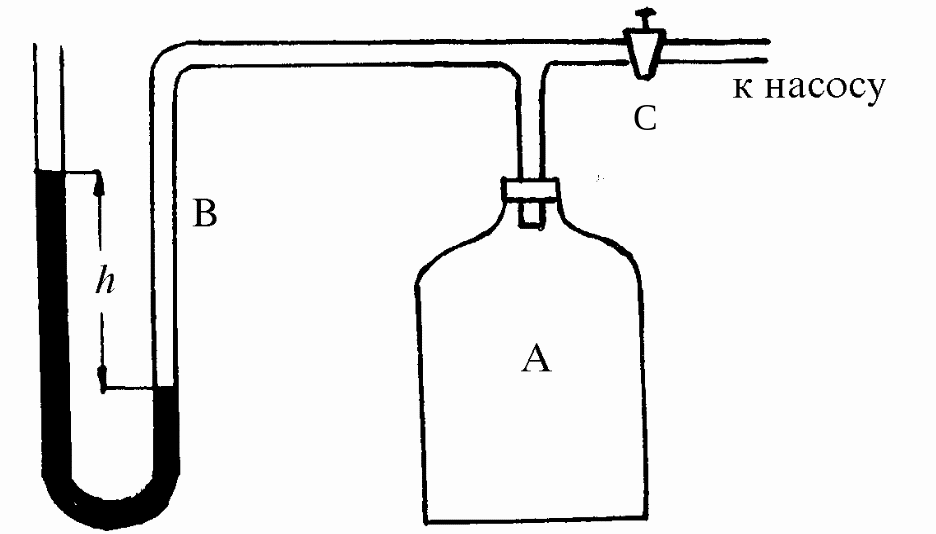
Рис. 24.1. Экспериментальная установка
Избыточное по сравнению с атмосферным давление воздуха в баллоне А измеряется U-образным манометром.
Через некоторое время воздух в сосуде охладится и его температура станет равной комнатной температуре T1.
Давление, установившееся в баллоне, будет р1 = H + h1, где H—атмосферное давление, h1 — добавочное давление, измеряемое разностью уровней жидкости в манометре.
Вынув на несколько долей секунды кран С из гнезда, заставляют часть воздуха выйти из сосуда, вследствие чего давление в сосуде уравновешивается с атмосферным H.
При расширении воздуха температура в сосуде А понизится до T2. Затем закрывают кран С. Через некоторое время воздух в сосуде А нагреется до температуры окружающего воздуха, сохранив свой объем неизменным. При этом увеличится давление до величины р2 = H + h2, где h2 — новая разность уровней в манометре.
Обозначим объем той массы воздуха, которая осталась в сосуде после удаления части ее (когда была открыта на несколько секунд пробка c) — V2. До открывания крана та же масса воздуха занимала (какой-то) меньший объем V1, так как кроме этой массы воздуха в сосуде А находилось еще некоторое количество воздуха, вышедшего при открывании крана С.
Таким образом, мы имеем 3 состояния воздуха, которые характеризуются следующими параметрами.
1. До открытия крана С V1; H+h1; T1.
2. В момент открытия крана V2; H; T2.
3. После закрытия крана
(когда установилась температура) V2; H+h2; T1.
Так как в первом и третьем состояниях воздух имел одну и ту же температуру, то применяя закон Бойля-Мариотта (р1V1=р2V2), получим
![]() или
или
![]() . (6)
. (6)
Переход из одного состояния во второе происходит настолько быстро, что теплообмена за столь короткое время не произойдет. Этот процесс расширения можно считать адиабатным.
Применяя к первому и второму состоянию уравнение Пуассона (5), получим
![]() или
или
![]() .
(7)
.
(7)
Возведя обе части уравнения (6) в степень y
![]() (8)
(8)
и, сопоставляя выражение (7) и (8), получим
![]() (9)
(9)
Для удобства это выражение запишем так
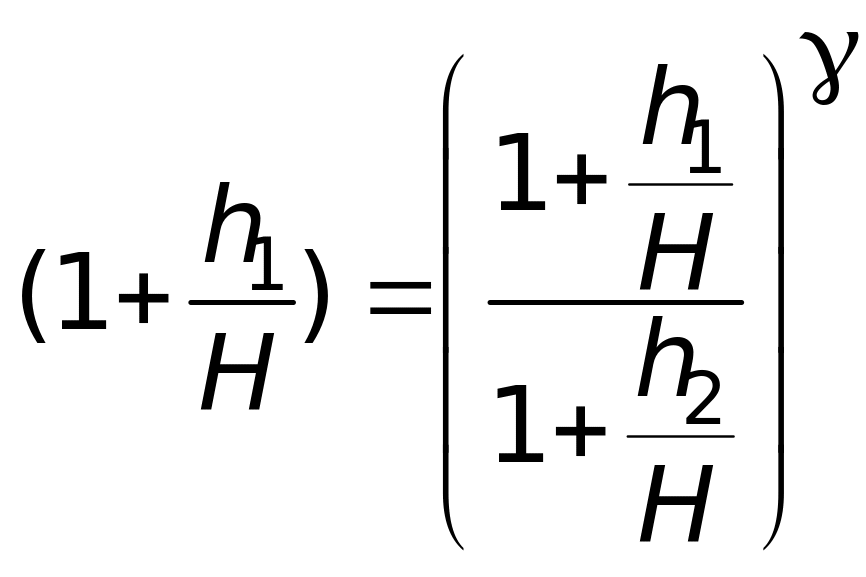 . (10)
. (10)
Логарифмируя выражение (10) и решая относительно , находим
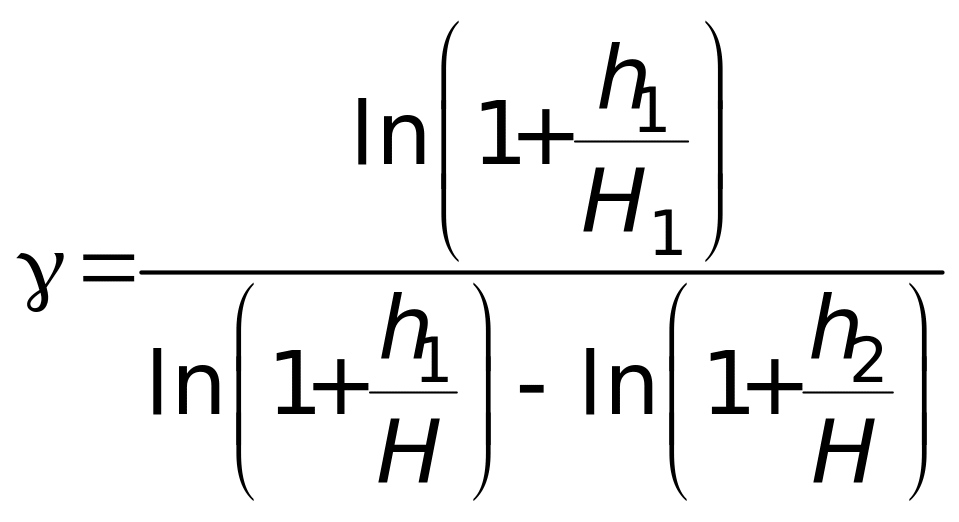 . (11)
. (11)
Так как h1/H <<1 и h2/H <<1 то ln(1+ h2/H )и ln(1+ h1/H ) можно разложить в ряд. Например,
![]() . (12)
. (12)
Если h1/H и h2/H мало, то можно в разложении (12) ограничиться лишь первым членом.
Тогда (11) принимает вид
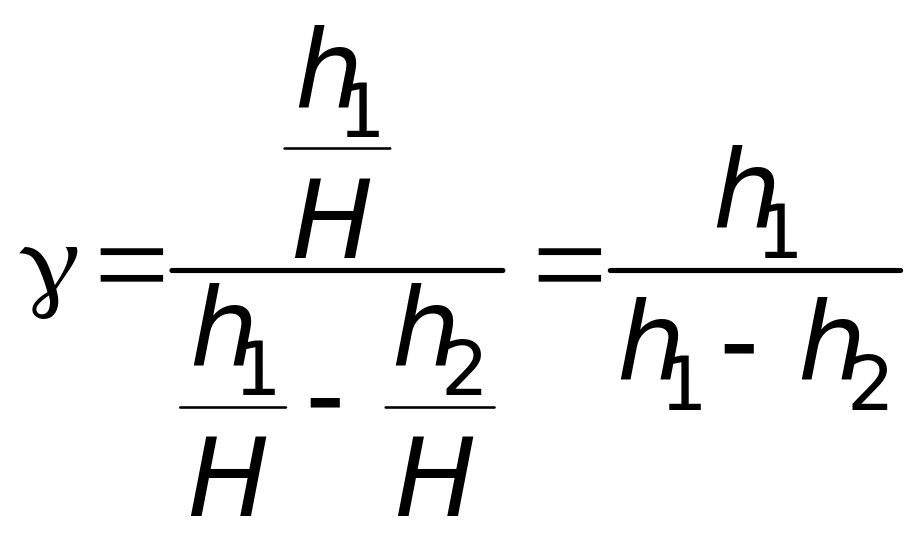 . (13)
. (13)
Таким образом, экспериментальное определение = cр/cV сводится к измерению h1 и h2.
Порядок выполнения работы и обработка результатов
