
- •Санкт-петербургская государственная химико-фармацевтическая академия
- •Часть 1
- •Под общей редакцией
- •Введение
- •1. Общие рекомендации
- •1.1. Проверка очевидного
- •1.2. Запись результатов эксперимента
- •1.3. Схемы и графики
- •1.4. Вычисления
- •2. Рекомендации по обработке результатов измерений
- •2.1. Погрешности измерений
- •2.2. Порядок обработки результатов прямых измерений
- •2.3. Пример обработки прямых измерений
- •Механика Лабораторная работа № 1 закон гука
- •Лабораторная работа № 2 определение периода свободных колебаний груза на пружине
- •Лабораторная работа № 3 изучение колебательного движения с помощью оборотного маятника
- •Лабораторная работа № 5 статистическая обработка результатов измерений периода колебаний пружинного маятника
- •Теоретическое значение периода колебаний
- •Экспериментальные значения периода колебаний
- •Сводная таблица результатов обработки экспериментальных данных
- •Лабораторная работа № 6 статистическая обработка результатов измерений периода колебаний крутильного маятника
- •Средние значения и погрешности измерения периода крутильных колебаний
- •Лабораторная работа № 12 определение момента инерции маятника обербека
- •Лабораторная работа № 13 определение момента инерции тела методом крутильных колебаний
- •Результаты измерений и вычислений момента инерции тела (диска, шара, кольца)
- •Лабораторная работа № 13а определение момента инерции тела методом крутильных колебаний
- •Молекулярная физика Лабораторная работа № 20 распределение максвелла
- •Задание 1 Получение функции распределения электронов по скоростям
- •Задание 2 Линеаризация графика функции распределения Максвелла
- •Результаты экспериментов
- •Данные для построения графика ln(f(X)/X)
- •Лабораторная работа № 21 определение коэффициента внутреннего трения жидкости методом стокса
- •Лабораторная работа № 23 распределение больцмана
- •Лабораторная работа № 24 определение отношения ср/cv методом клемана и дезорма
- •Задание 1 Определение показателя адиабаты для воздуха
- •Лабораторная работа №25 измерение коэффициента вязкости жидкости капиллярным методом
- •Электричество Лабораторная работа № 31 исследование электрического поля
- •Лабораторная работа № 33 измерение электродвижущей силы источника электрической энергии
- •Разделив равенства (3) и (2) почленно, получим
- •Лабораторная работа № 34 измерение сопротивлений методом моста постоянного тока
- •Лабораторная работа № 35 исследование цепи постоянного тока
- •Лабораторная работа № 36 исследование закона ома для линейных и нелинейных элементов электрической цепи
- •Лабораторная работа № 37 измерение сопротивления проводника
- •Результаты измерений сопротивления проводника по схеме 1
- •Результаты измерений сопротивления проводника по схеме 2
- •Список используемой литературы
- •Содержание
- •Часть 1
- •197376, Санкт-Петербург, ул. Профессора Попова, 14.
Молекулярная физика Лабораторная работа № 20 распределение максвелла
Цель работы
Получение и изучение распределения Максвелла для электронного газа.
Оборудование
Электронная лампа (диод с подогреваемым катодом);
Источник напряжения на 0,5 В;
Микроамперметр на 200 А для измерения анодного тока;
Вольтметр на 0,5 В;
Цепь накала: источник постоянного напряжения на 4—8 В, миллиамперметр на 500 mA, вольтметр на 15 В, реостат 25 Ом 5 А.
Основные сведения
В замкнутом сосуде, наполненном газом (например, газом электронов), устанавливается термодинамическое равновесие, которое характеризуется определенным распределением молекул газа по скоростям. Известно, что средняя кинетическая энергия беспорядочного движения молекул газа прямо пропорциональна его абсолютной температуре
![]() . (1)
. (1)
Отсюда следует, что средняя квадратичная скорость для газа из частиц, не имеющих составных частей,
![]() , (2)
, (2)
где k = 1,38 1023 Дж/К — постоянная Больцмана, T — абсолютная температура газа, m — масса молекулы газа. Для двухатомных молекул в формуле (2) стоит число 5.
При t=15°C средняя квадратичная скорость vкв молекул азота (N2) равна ~500 м/c; со скоростями от 300 до 700 м/c движется 59% молекул. С малыми скоростями — от 0 до 100 м/c — движется лишь 0,6% молекул. Быстрых молекул со скоростями свыше 1000 м/c в газе всего лишь 5,4 %. При нормальных условиях каждая молекула претерпевает в секунду примерно 109 соударений и, следовательно, величина и направление скорости каждой молекулы изменяются. Это перераспределение скоростей между молекулами происходит так, что число молекул, обладающих значениями скорости, заключенной в определенном интервале, все время остается постоянным и описывается распределением по скоростям Максвелла.
Рассмотрим, что представляет собой это распределение. Пусть данная масса газа содержит N молекул. Тогда число молекул dN, скорости которых имеют значение от v до v + dv (т. е. заключены внутри интервала dv), очевидно, пропорционально рассматриваемому количеству молекул. Вместе с тем оно пропорционально и величине заданного интервала dv и, конечно, будет зависеть от самого значения скорости v, т. е. dN = N F(v) dv, где F(v) — функция, характеризующая распределение молекул газа по скоростям.
![]() (3)
(3)
и есть функция распределения, численно равная относительному числу молекул, имеющих скорость в интервале от v до v + dv, отнесенному к величине этого интервала скоростей dv.
Отношение dN/N = F(v) dv дает вероятность того, что скорость молекулы будет иметь значение в пределах данного интервала скоростей dv.
Если проинтегрировать dN по всем интервалам dv, на которые разбиты возможные значения скорости v, то, очевидно, можно получить полное число молекул N. Отсюда вытекает следующее свойство функции распределения.
![]() , (4)
, (4)
которое получило название условия нормировки функции.
Оно имеет смысл того, что молекула имеет одно из значений скорости в пределах от 0 до . Так как скорость молекулы, несомненно, имеет какое-либо значение, то указанная вероятность есть вероятность достоверного события и, следовательно, равна 1. Функцию распределения молекул по скоростям (распределение Максвелла) записывают в виде
![]() , (5)
, (5)
где А — множитель, не зависящий от v (его значение можно найти из условия нормировки функции распределения).
Функция F(v) стремится к 0 при v 0 и v ; ее график имеет следующий вид.
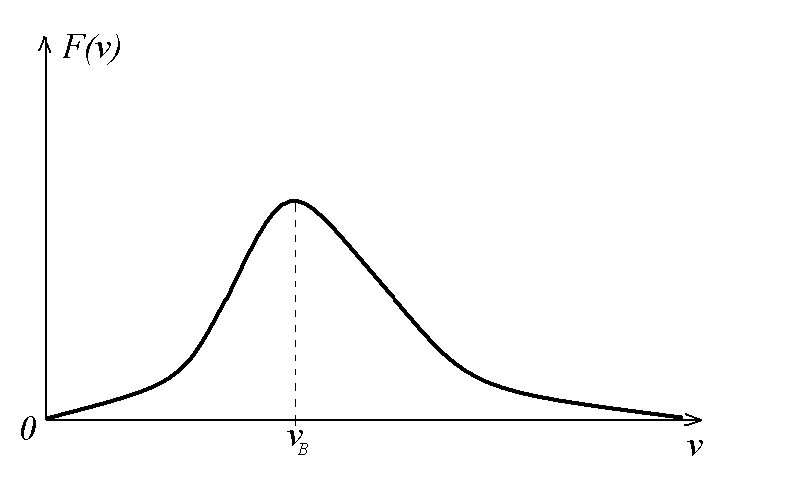
Рис. 20.1. График функции распределения Максвелла
Скорость, которая соответствует максимуму функции распределения, называется наиболее вероятной — vв. Чтобы ее найти, нужно продифференцировать функцию распределения F(v) (см.(5)) по v и приравнять полученное выражение к 0, т. е. обычным путем, как находится максимум функции в математике. Оказывается
![]() (6)
(6)
Сравнивая (6) и (2), имеем
![]() . (7)
. (7)
Наибольшее
число молекул имеют скорости в том
интервале, к которому относится наиболее
вероятная скорость. При возрастании
температуры наиболее вероятная скорость
увеличивается пропорционально
![]() (см.
формулу (6)) и максимум распределения
сдвигается вправо (см. рис.
20.3?).
(см.
формулу (6)) и максимум распределения
сдвигается вправо (см. рис.
20.3?).
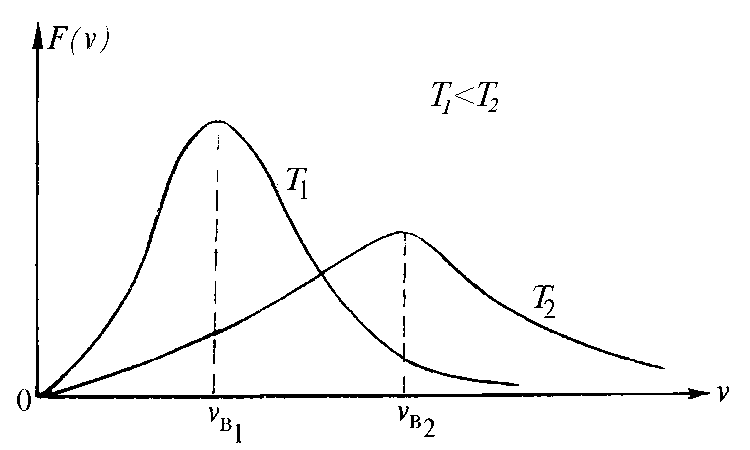
Рис. 20.3?. Графики функции распределения Максвелла разных температур газа
При этом число медленных молекул убывает, а число быстрых возрастает, но площадь под кривой остается постоянной, равной 1.
