
- •Термодинамика полимеризации.
- •Радикальная сополимеризация.Состав сополимеризации.
- •Термоокисл. И фотохим. Дестр. Принцип стабилизации пол-ров.
- •Сшивание пол-ных цепей. Вулканизация каучуков.
- •Сравнительная характеристика мономеров и кат анионной и катионной полимеризации.
- •Расщепление пол. Цепей под действ. Физ. И хим. Факторов.
- •Принцип синтеза стереорегулярных полимеров.
- •Кинетика катионной пол-ции.
- •Вынужденнная высоко-эластичность.
- •Ионообменные вмс.
- •Пластифик. Пол-ров. Мех.
- •Релаксационные явл. В пол-рах. Спектр времени. Релаксация напряжения.
- •Кристаллизация пол-ров.
- •Радикальная полимеризация.
- •Молекулярно-мас. Распределение. Среднемассовая и вазкостная мм.
- •Стеклование пол-ров.
- •Инициирование, рост и обрыв цепи при анон полим-ции. Живые цепи.
- •Регуляторы и ингибиторы радикальной пол-ции.
- •Теродинамич поведение макром-лы в р-ре осбенности от нм.
- •Реакції росту, обриву та передачі ланцюгу
- •Конформац изомерия. Количеств. Х-ка гибкости макром-лы.
- •Вэс полимера.
- •Вязкотекучее сост пол-ра.
- •17.Засоби регенерації радикалів та їх використання в ініціюванні полімеризації.
1.
Термодинамика полимеризации.
Термодинамическая возможность образования того или иного соединения описывается изменением изобарно–изотермического потенциала:
ΔG=ΔH–TΔS –ΔH = ΔQ
Изменение ΔG зависит от констант равновесия. ΔG = ΔGо + RT LnK, ΔG=0 >> ΔGo=–RTLnK = ΔHo–TΔS = RT Ln [M]
![]()
ΔH<0
Если ΔGо<0, то
![]()
Изменение энтальпии зависит от природы мономера.
ΔS = Δsпост + ΔSкол + ΔSвр + ΔSвнутр вращ
ΔS <0 (ΔH >(TΔS ))
Переход мономера в полимер будет осуществляться до верхний границы температуры, далее полимеризация не идет.
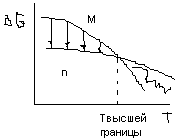
Полимеризация циклов
ΔН>0, ΔS>0
![]()
После достижения Тгр начинается переход мономера в полимер.

ΔН>0, ΔS<0
При любой температуре полимеризации нет.
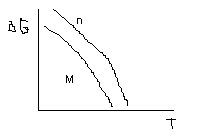
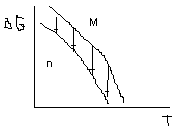
ΔН<0, ΔS>0
Процесс полимеризации осуществляется при любой температуре. Полимеризация идет самопроизвольно за счет раскрытие макромолекулы.
3.
Радикальная сополимеризация.Состав сополимеризации.
Сополимеризация - совместная полимеризация двух или большего количества мономеров; макромолекула полимера, которая образуется, состоит из составных звеньев мономеров различных сортов. Распределение может быть:
1)случайное ААБАБАБББ;
2)регулярное чередование ААББААББ;
3)чередование блоками ААААБББААААБББ.
Соотношение компонентов полимера зависит от сополимерной активности. Для того, чтобы определить активность сополимера нужно проанализировать конcтаты сополимеризации. Для бинарной сополимеризации М1, М2 – мономеры.
–R1* + M1 ––k11–> –R1*
–R1* + M2 ––k12–> –R2*
–R2* + M1 ––k21–> –R1*
–R2* + M2 ––k22–> –R2*
V11=k11[R*1][M1]
V12=k12[R*1][M2]
V21=k21[R*2][M1]
V22=k22[R*2][M2]
R1·, R2·- радикальные частицы; k – константы скоростей соответствующих реакций.
[R1·] и [R2]=const.
В квазистацион. состоянии равновесие
K2[R1·][M2]=k11[R2][M1]
С какой скоростью исчезает мономер того или другого сорта с такой вероятностью следует ожидать его появление в составе сополимера. Скорость изменения концентрации мономера М1 будет соответствовать сумме скоростей реакции.
10.
Термоокисл. И фотохим. Дестр. Принцип стабилизации пол-ров.
Термическая деструкция полимерных материалов в процессе переработки сопровождается окислением. Деструкция полимера при одновременном воздействии на него тепла и кислорода называется термоокислительной. Присоединение кислорода в процессе термоокисл деструкции происходит по цепному механизму с участием гидропероксидов и свободных радикалов.
Процесс термоокисл деструкции протекает по свободно радикальному механизму аналогично окислению низкомолекулярных углеводородов к другим цепным реакциям свободных радикалов:
1)инициирование;
RH + O=O >> R* + *OOH (малоактивный радикал)
2)рост цепи:
R* + O2 >> ROO* (+ R’H) >> ROOH + R’* (+ O2) >> R’OO* и т.д.
3)обрыв цепи:
ROO* + *OOR’ >> ROOR’ + O2
Т.к. распад гидроперекисей приводит к возникновению активных радикалов, способных отрывать водород от макромолекулы, происходит развертывание реакционной цепи, приводящей к ускорению окисления:
R–O–OH >> R*O + *OH
R* + HOH + OH <<>> RH
RH + RO* >> ROH +R*
Антиоксиданты замедляют окислит деструкцию. Используют – фенолы сульфиды и др. Они ингибируют цепной процесс окисления двумя путями:
– обрывают цепь окисления, т.е. взаимодействуют со свободным радикалом на стадии их образования.
– предотвращают расположения гидропеоксидов по радикальному механизму.
Особенно эффективна стабилизация полимеров смесями антиоксидантов – сикермическими смесями. Антиоксиданты тормозят окисление только в том случае, когда их концентрация не превышает кристаллическую концентрацию.
Фотохим. дестр. наз. процесс дестр. происходящий под действмем световой енергии. Степень фотохим. дестр. зависит от длины волны ультраиолетового света(энергии квантов), интенсивности облучения , строения исследуемого материала. При облуч. некотор. пол-ров ультрафиолетовым светом поисходит деполимеризация (с выделением мономера) процесс получил наз.- фотолиза. При поглащ. Β или γ излучения происходит возбуждение молек. пол-ра и диссоциация ее на свободные радикалы или на радикал и ион. Продолжит. жизни образующихся ионов мала поетому в различ. хим. превращ вступают в основном свободные радикалы . При этом конечными продуктами дестр могут быть пол- ры линейного, разветвленного и пространственного строения.
ФТ характерна для полимеров, содержащих группировки, способные поглощать свет с короткой длиной волны. Это цепной процесс, протекающий по радикальному механизму. ФД может идти даже при относительно низких температурах. Механизм реакции определяется строением основной цепи полимера и природой боковых групп, способных поглощать свет. При действии УФ–излучения на полимер при повышенной температуре скорость ФД резко возрастает – процесс фотолиза.
Механизм реакции, протекающий под действием УФ:
Процесс начинается с отрыва атомов Н2 с образованием свободного радикала.
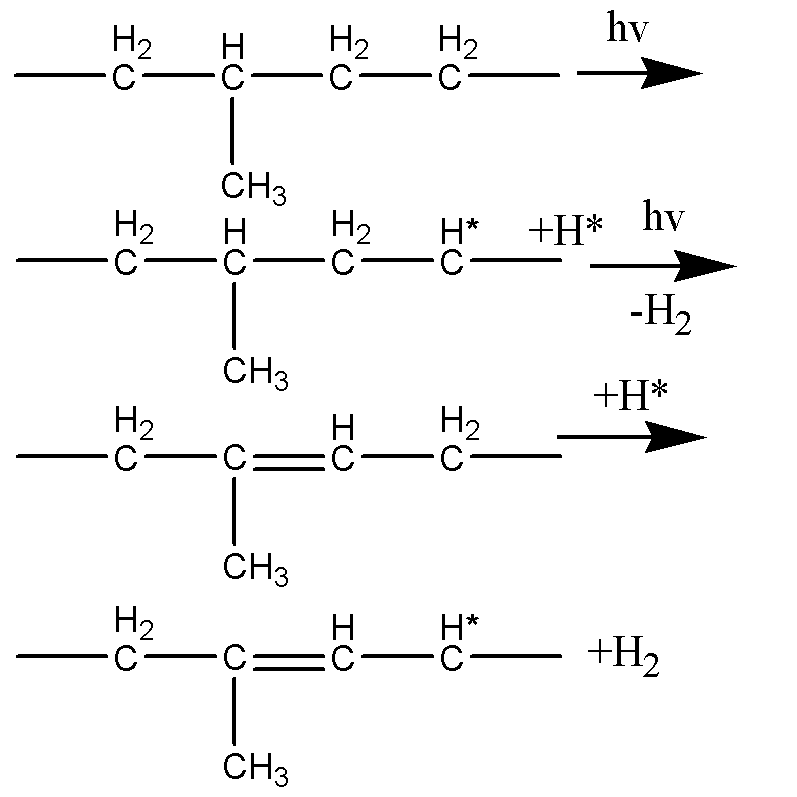
Водород отщепляется от α – метиленовых групп, где энергия связи уменьшается за счет сопряженной с двойной связью.
Стабилизация полимеров с ФД основана на введении в полимер соединений, которые легко поглощают световую энергию и трансформируют ее так, что она излучается квантами меньшей энергии, безопасным для полимера. Кроме того, светостабилизаторы выполняют функцию акцептора электронной энергии возбуждения макромолекулы, они превращают эту энергию в тепловую и рассеивают ее
7.
типы р-ций полик-ции.
Полик-ция протекает за счет р-ции между функц-ными группами (ОН-, подвижный водород, -СООН, -NH2, галогены и т д) и приводит к образованию нового в-ва, состоящего из остатков, которые ранее были соединены с указанными группами. Одновременно при этом обычно выделяются НМ продукты: вода, HCl, NH3, спирты и т д. по характеру хим процессов различают равновесную и неравновесную полик-цию. Примером равновесной полик-ции служит р-ция этерификации. Типы полик-ции:
1.Равновесная полик-ция:
- Гетерополик-ция – в р-ции учавствует 2 и более различных типа мономеров, функциональные группы одного из них реагируют только с функц-ми группами др-го.
- Гомополик-ция – в каждой мономерной молекуле находятся различные функц-ные группы, способные реагировать между собой (возможна самоконд-ция с участием одного лишь типа мономеров).
- совмесная или сополик-ция – в ней участвует 2 или больше мономеров одного типа.
2.Неравновесная полик-ция – хаарктерны высокая скорость, низкая температура, выход полимера с высокой мол-й массой. Обусловлены присутствием основания, мгновенно нейтрализующего выделяющийся HCl. Может быть :
- межфазная – протекает на поверхности, точнее вблизи поверхности, разделяющей р-р хлорангидрида в несмешивающемся с водой орг. Р-ле и водный р-р второго мономера к которому добавлено основание. Если непрерывно удалять пленку из реакционной смеси, то р-ция будет продолжаться до полного исчерпания мономера. Если проводить р-цию при перемешивании, то получается порошок, а в случае подачи струи раствора одного компонента в р-р другого – в виде волокна.
Эмульсионная – проводится в 2-хфазной системе но основная р-ция протекает в орг. Фазе эмульсии и в кинетической области. Очень схожа с полик-цией в р-ре (применяют взаимно несмешивающиеся растворители).
В р-ре – на скорость р-ции и мол. массу влияет концентрация реагирующих в-в и природа растворителя, в зависимости от дозировки можно регулировать мол массу.
Акцепторно-каталитическая – для получения стереорегулярных полимеров, проводится в среде орг растворителей при Т=-20 - +500С в присутствии третичных аминов (акцептор).
3.В твердой фазе – отсутствует цепной механизм, связан с процессами сшивания макромолекул и образования теплостойких полимеров, не плавящихся в условиях р-ции.
Стехиометрия – соотношение взаимодейстующих между собой функциональных групп. Чем более точно она соблюдается, тем более высокая мол масса получаемого полимера.
Содержание монофункциональных примесей понижает мол массу так как они блокируют реакционные центры на молекулах образующегося полимера.
Побочные р-ции понижают мол массу, так как ведут к образованию НМ продуктов, которые не участвуют в р-ции полик-ции.
По тем же причинам эти факторы уменьшают вероятность образования сетчатых структур.
11.
