
- •Вопросы к лабораторным работам
- •1.Характеристика поверхностных явлений и дисперсных систем
- •2. Адсорбция на границе жидкость - газ
- •3. Адсорбция на границе твердое тело – газ и твердое тело - жидкость
- •Правила безопасной работы с органическими растворителями
- •Термодинамика поверхностного слоя
- •Порядок выполнения работы:
- •Определение полной поверхностной энергии жидкостей
- •Порядок выполнения работы:
- •Изучение адсорбции пав из растворов на твердом адсорбенте
- •Порядок выполнения работы:
- •Исследование адсорбции неэлектролитов из бинарных растворов на твердых поверхностях
- •Порядок выполнения работы:
- •Получение и свойства коллоидных систем
- •Получение золей и строение мицеллы
- •Порядок выполнения работы:
- •Вязкость растворов высокомолекулярных соединений. Определение молекулярной массы полимеров по вязкости их растворов
- •Седиментационный анализ
- •Электрические свойства коллоидных систем
- •Оптические свойства коллоидных систем
- •Определение изоэлектрической точки белка по данным кинетики набухания
Электрические свойства коллоидных систем
Цель работы: изучить явления электрофореза, ознакомиться с методом определения скорости движения и знака заряда коллоидных частиц.
Общие теоретические положения
Коллоидно-дисперсные системы являются гетерогенными. На границе раздела между фазами в результате избирательной адсорбции одинаково заряженных ионов возникает разность потенциалов.
Возникновение двойного электрического слоя (д.э.с.) на межфазных поверхностях, как и адсорбция, является результатом взаимодействия соприкасающихся фаз благодаря избыточной поверхностной энергии. Стремление гетерогенной системы к уменьшению поверхностной энергии вызывает определенное ориентирование полярных молекул и ионов в поверхностном слое, в результате чего соприкасающиеся фазы приобретают заряды противоположного знака, но равные по величине. Причины возникновения заряда могут быть различными. Во-первых, возможна диссоциация соединений, входящих в состав поверхностного слоя, например ионизация молекул кремниевой кислоты на поверхности частиц кремнезема SiО2 (стекло, кварц и т. д.) в воде, сопровождающаяся переходом в раствор ионов водорода или катионов, входящих в состав стекла. Во-вторых, на поверхности твердой фазы может происходить адсорбция ионов электролита из раствора. При этом преимущественно адсорбируются ионы, входящие в состав твердой фазы или изоморфные с ними. Например, на поверхности частиц золя хлорида серебра AgCl в присутствии нитрата серебра AgNО3 преимущественно адсорбируются ионы Ag+, а в присутствии в растворе галогенидов металлов − галогенид-ионы. Оба явления − и диссоциация поверхностных соединений, и адсорбция ионов из раствора − приводят к образованию на поверхности электрического заряда. Ионы, обусловливающие заряд поверхности, носят название «потенциалопределяющие ионы». Заряд поверхности компенсируется благодаря концентрированию вблизи поверхности ионов противоположного знака, называемых «противоионами». В целом д.э.с. электронейтрален.
Согласно современным представлениям некоторое количество противоионов прочно связано с твердой поверхностью в результате действия как электрических, так и адсорбционных сил и образует так называемый слой Гельмгольца (адсорбционный слой). Остальные противоионы благодаря тепловому движению и взаимному отталкиванию находятся на большом расстоянии от поверхности, образуя так называемый диффузный слой Гуи, удерживаемый у поверхности только электростатическими силами. Таким образом, д.э.с. состоит из заряженной поверхности с потенциалом φ0 и противоположно заряженной части слоя, в котором находятся противоионы (рис. 8.1).
Поверхностный потенциал частицы определяется свойствами поверхности (величиной стандартного электродного потенциала) и концентрацией электролита и рассчитывается по уравнению Нернста. Установлено, что потенциал в адсорбированном слое при увеличении расстояния от слоя потенциалопределяющих ионов снижается до потенциала диффузного слоя φδ, называемого также штерновским потенциалом, линейно, а затем (в самом диффузном слое) по экспоненте. При этом за толщину диффузного слоя λ принято расстояние, на котором потенциал диффузного слоя φδ уменьшается в е раз.

Рис. 8.1. Строение двойного электрического слоя
При относительном смещении фаз (независимо от причин его вызывающих) происходит разрыв д.э.с. по плоскости скольжения (рис. 8.1, штрих-пунктирная линия). Плоскость скольжения обычно проходит вблизи границы адсорбционного и диффузного слоев и часть ионов последнего остается в дисперсионной среде. Потенциал, возникающий на плоскости скольжения при отрыве ионов диффузного слоя от твердой фазы, носит название электрокинетического потенциала или ζ − (дзета-) потенциала (см. рис. 8.1).
При изменении концентрации электролита в д.э.с. изменяется соотношение между влияниями адсорбционного и электростатического притяжений и влиянием диффузии, определяющими распределение ионов в наружной обкладке д.э.с. При увеличении концентрации противоионов в растворе д.э.с. сжимается, диффузия противоионов в раствор уменьшается, так как уменьшается разность концентраций между адсорбционным слоем и раствором. Соответственно уменьшается число противоионов в диффузном слое и увеличивается число противоионов в адсорбционном слое. При этом полный потенциал поверхности φ0 изменяется незначительно. Толщина д.э.с. уменьшается. Такое изменение д.э.с. с увеличением концентрации приводит к уменьшению ζ-потенциала. При увеличении заряда противоионов (при одинаковой концентрации электролита) вследствие их более сильной поляризуемости и адсорбируемости также происходит уменьшение толщины д.э.с.
При увеличении размера ионов одинакового заряда (например, в пределах одной группы Периодической системы элементов) эффект сжатия д.э.с. усиливается. По значению электрокинетического потенциала ионы с одинаковым зарядом располагаются в так называемые лиотропные ряды.
Li+ > Na+ > К+ > Rb+ > Cs+; Mg2+ > Са2+ > Sr2+ > Ва2+.
В этих рядах слева направо растет радиус иона, его способность поляризоваться в электрическом поле, а следовательно, и адсорбироваться. Одновременно с увеличением радиуса уменьшается способность ионов к гидратации, уменьшается объем гидратированного иона. Соответственно в этих рядах возрастает влияние присутствия этих ионов в растворе на строение д.э.с.
Явления, связанные с взаимодействием электрического поля с зарядом жидкости или с поверхностным зарядом диспергированных частиц твердого тела, называются электрокинетическими.
В зависимости от природы дисперсионной среды, дисперсной фазы и способа получения, гранулы мицелл коллоидных растворов получают заряд того или иного знака. При наложении внешнего электрического поля эти электрически заряженные частицы (гранулы) передвигаются в дисперсионной среде к электродам: катоду или аноду.
Движение дисперсных коллоидных частиц под влиянием внешнего электрического поля называется электрофорезом. Одновременно с движением гранул происходит перемещение в противоположном направлении гидратированных противоионов диффузного слоя жидкости. Визуально это выражается в изменении (увеличении) уровня жидкости в приэлектродном пространстве. Явление перемещения дисперсионной среды через пористую мембрану при наложении внешней разности потенциалов называется электроосмосом.
Если через коллоидный раствор пропускать постоянный ток, то к одному из электродов будут передвигаться ядра мицелл вместе с ионами и противоионами адсорбционного слоя, т. е. основная масса всей мицеллы. Противо-ионы диффузного слоя передвигаются к другому электроду. Наблюдая явления электрофореза, можно определить скорость движения частиц в данном электрическом поле и знак их заряда.
Выражение, связывающее электрокинетический потенциал с постоянной линейной скоростью течения жидкости относительно мембраны, называется уравнением Гельмгольца - Смолуховского.
![]() , (8.1)
, (8.1)
где
η −
вязкость среды, Па-с;
u0
− линейная
скорость течения, м/с; Е
− напряженность
внешнего электрического поля, В/м; ε
− относительная диэлектрическая
проницаемость среды; ε0
= 8,85∙10-12
Ф/м − электрическая постоянная. Входящее
в выражение (8.1)
соотношение
![]() называется
электроосмотической
или
электрофоретической подвижностью
uэ.о
и измеряется
в м2
/(с∙В).
называется
электроосмотической
или
электрофоретической подвижностью
uэ.о
и измеряется
в м2
/(с∙В).
Электроосмотическую линейную скорость в выражении (8.1) удобнее заменить на объемную скорость течения жидкости υ, м3/с
υ=u0S, (8.2)
где S − площадь поперечного сечения всех капилляров в пористой мембране. При этом следует понимать что, исходя из самого термина «объемная скорость течения жидкости», ее практически можно определить по выражению
υ=![]() (8.3)
(8.3)
С учетом закона Ома уравнение Гельмгольца − Смолуховского (8.1) легко преобразуется к виду:
![]() , (8.4)
, (8.4)
где æ - удельная электрическая проводимость, См/м; I- сила тока, А.
Уравнение (8.4) позволяет по экспериментально определяемым значениям величин υ, η, æ, I рассчитать электрокинетический потенциал. Необходимо отметить, что уравнения (8.1) и (8.4) справедливы для случая, когда радиус капилляра гораздо больше толщины д.э.с. Если же размеры капилляра сопоставимы с толщиной д.э.с. (это имеет место в микропористых системах), то необходимо вводить поправку на поверхностную проводимость. Соотношения (8.1) и (8.4) справедливы и для единого цилиндрического капилляра, и для системы капилляров различной формы, поскольку в них не включены геометрические параметры капилляров.
ПРИБОРЫ И РЕАКТИВЫ:
Приборы для наблюдения электрофореза;.
Электрофоретический зонд.
Батарея аккумуляторов.
Две стеклянные трубки диаметром около 20 мм.
Пять пробирок; десять стаканов вместимостью 50 мл.
Кусок глины.
Кварцевый песок.
Фильтры.
Стеклянные палочки.
Фильтровальная бумага.
Золи Fe(OH)3 и AgI.
Растворы: 10% CuS04, 0,001 н NaOH.
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ:
Наблюдение электрофореза
В кусок сырой глины размером 8x15 см при толщине 4 см вдавливают две стеклянные трубки диаметром 1,5−2 см (рис.8.2). В трубки насыпают слой хорошо промытого кварцевого песка толщиной 0,5 см. В трубки наливают воду так, чтобы ее верхний уровень находился на 2−3 см выше слоя песка. Вставляют в обе трубки платиновые или медные электроды и присоединяют их к аккумуляторной батарее с напряжением 2 В. Через несколько минут после пропускания тока наблюдается электрофорез; в трубку с положительным электродом сквозь слой песка проходят частицы глины, и постепенно образуется мутная суспензия. А в катодном пространстве происходит увеличение уровня жидкости.

Рис. 8.2. Схема опыта по перемещению частиц в электрическом поле:
1 и 2 – трубки.
Определение знака заряда коллоидных частиц при помощи электрофоретическеого зонда
Знак заряда гранул коллоидных частиц можно определить при помощи электрофоретического зонда. Электрофоретический зонд Наумова (рис.8.3) состоит из медного и цинкового электродов, изготовленных в виде круглых пластинок 1 и 2 диаметром 5 мм; пластинки расположены горизонтально одна под другой на расстоянии 2−3 мм.

Рис. 8.3. Электрофоретический зонд: 1,2 − электроды; 3,4 – стеклянные трубки
Эти электроды припаяны к платиновым проволокам, вплавленным в стеклянные трубки 3 и 4. Внутри стеклянных трубок к платиновым проволокам припаяны медные проволочки, которые выходят наружу и сверху спаяны друг с другом. При погружении в коллоидный раствор, находящийся в пробирке, зонд действует как коротко замкнутый гальванический элемент (медь − положительно заряженный электрод, цинк − отрицательно). Через несколько минут после погружения зонда в золь возле электрода, заряженного одинаково с коллоидными частицами, появляется тонкая светлая полоска.
Электрофоретический зонд можно изготовить и более просто. Две пластинки − одну медную, другую цинковую длиной 7−10 см и шириной 1 см − спаивают между собой так, чтобы расстояние между ними (неспаянными концами) было 1−2 см. Свободные концы медной и цинковой пластинок погружают в золь. Получают короткозамкнутый элемент, где цинк заряжен отрицательно, а медь положительно.
Определение скорости электрофореза гидроксида железа(III)
Для измерения скорости электрофореза может служить прибор Рабиновича − Фодиман (рис. 8.4.). Он состоит из U-образной трубки 1, соединенной вверху мостиком с краном 4. Верхние отростки U-образной трубки имеют изогнутые трубки 5, в которые вставляют электроды. Колена U-образной трубки в середине имеют краны 2 и 3, диаметр отверстия которых равен диаметру трубок.
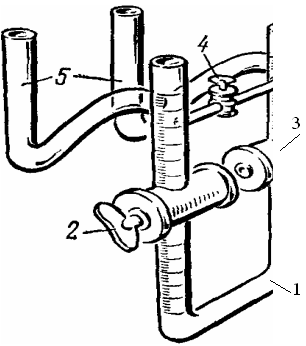
Рис. 8.4. Прибор Рабиновича − Фодиман: 1 − U- образная трубка; 2, 3 − краны; 4 − кран мостика; 5 − изогнутые трубки.
В прибор Рабиновича − Фодиман, тщательно вымытый хромовой смесью и дистиллированной водой, а затем высушенный, наливают отдиализованный золь гидроксида железа(III) так, чтобы была заполнена вся нижняя часть прибора и краны. Краны закрывают, избыток золя (поверх кранов) сливают и оба колена прибора (верхнюю часть) несколько раз промывают дистиллированной водой. Затем всю верхнюю часть U-образной трубки заполняют доверху дистиллированной водой и прибор укрепляют в штативе.
После этого на дно боковых трубок 5 наливают через стеклянную трубочку с капиллярно оттянутым концом небольшое количество раствора сульфата меди. В отростки 5 вводят медные электроды и открывают на короткое время кран 4, чтобы сравнять уровни жидкости в обоих коленах прибора. Соединяют электроды с источником тока, осторожно открывают краны 2 и 3 и наблюдают за передвижением границы золя. Затем определяют знак заряда дисперсной фазы и вычисляют подвижность коллоидных частиц по формуле:
![]() , (8.5)
, (8.5)
где S − путь, пройденный частицами золя, см; l − расстояние между границами раствора сульфата меди, см; τ − время прохождения тока, мин; v − напряжение батареи аккумуляторов, В.
Лабораторная работа №9.
