
- •Реферат
- •РЕферат
- •1Перелік умовних позначень
- •2Теоретична частина
- •2.1Історія «Інституту сорбції та проблем ендоекології Національної академії наук України» та основні наукові напрямки інституту
- •2.2Теоретичні основи сорбції аніонів на оксигідроксидах металів
- •2.3Сорбція аніонів і деяких органічних пероксидів гідратованими діоксидами цирконію, титану та олова
- •2.3.1Сорбція аніонів
- •3Експериментальна частина
- •3.1Об'єкти досліджень
- •3.2Лабораторна установка
- •3.3Синтез зразків сорбенту на основі оксиду цирконію (IV)
- •3.4Аналіз отриманих сорбентів рфа
- •3.5Потенціометричне титрування
- •3.6Регенерація сорбенту
- •3.7Методика побудови калібрувального графіку
- •3.8Побудова графіків потенціометричного титрування
- •3.9Побудова калібрувальної кривої
- •3.10Сорбція фосфатів з робочих розчинів
- •4Охорона праці та безпека в лабораторії у випадку надзвичайних ситуацІй
- •4.1Заходи охорони праці
- •4.1.1Повітря робочої зони
- •4.1.2Освітлення робочої зони
- •4.1.3Шум та вібрація
- •4.1.4Електробезпека
- •4.2Безпека в надзвичайних ситуаціях
- •4.2.1Пожежна безпека
- •4.3Аналіз небезпеки об’єкта. План ліквідації аварійних ситуацій
- •Висновки
- •Перелік посилань
3.5Потенціометричне титрування
Всі зразки (С1, С2, С3, С4), наважкою по 0,05 г вносимо в конічні колби на 250 см3, додаємо 50 см3 розчину KCI 0.1 н, перемішуємо. Вимірюємо рН приготовлених розчинів. Далі розчини титруємо розчином KOH 0.05 н та KCI 0.05 н, додаючи по 0.1 см3 приготовленого розчину і щоразу вимірюємо рН, доводячи його до 11.
3.6Регенерація сорбенту
Після потенціометричного титрування регенеруємо сорбенти на основі ZrO2. Для цього кожну з 8 колб, зі зразками сорбентів (С1, С2, С3, С4), які прожарені при 300 та 350 0C, відповідно, титруємо з кроком 0.1 см3 розчином HCI 0.1 н та KCI 0.01 н, до певного рН, використавши той самий об'єм розчину, який було витрачено при потенціометричне титрування.
3.7Методика побудови калібрувального графіку
Для побудови графіку у шість мірних колб ємністю 100 см3 вводимо почергово відміряні об’єми робочих розчинів (0,2 мг P2O5 в 1 см3): 0,25; 0,5; 1, 2, 3, 4. Далі розбавляємо дистильованою водою до об’єму приблизно 30-50 см3. Після цього приливаємо 25 см3 реактиву на фосфати та додаємо дистильовану воду до мітки. Через 15 хвилин (але не більше ніж через 60 хвилин) вимірюємо оптичні густини зафарбованих робочих розчинів відносно розчину порівняння (дистильованої води) при довжині хвилі λ=450 нм і товщині кювети 1 сантиметр. За отриманими даними будуємо калібрувальний графік: по осі абсцис відкладаємо концентрацію P2O5 в 100 см3 розчину в мг , по осі ординат – відповідні їм величини оптичної густини.
3.8Побудова графіків потенціометричного титрування
Результати потенціометричного титрування та регенерації отриманих зразків сорбенту при 300 °С заносимо у таблицю 2.1.
Таблиця 2.1 – Результати досліджень при 300°С
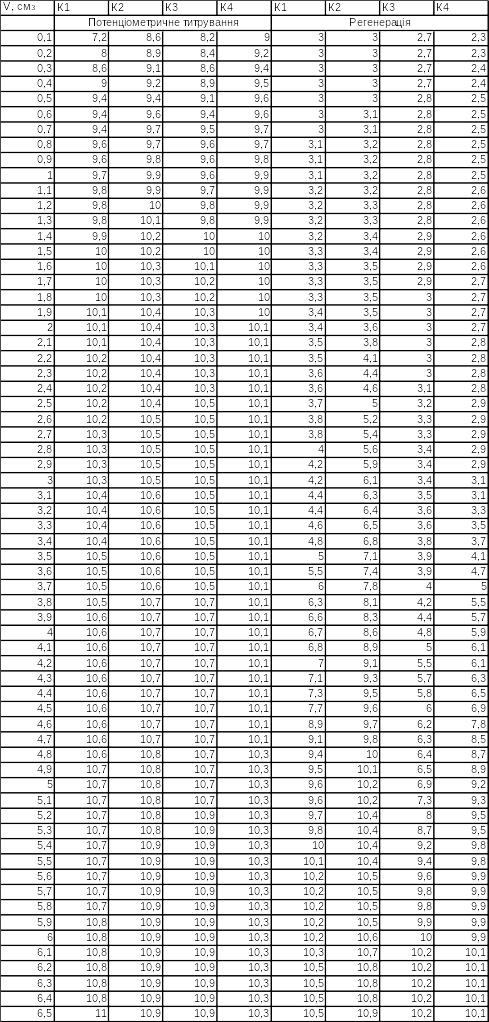
За одержаними даними будуємо криві потенціометричного титрування та регенерації на одному графіку 2.8.
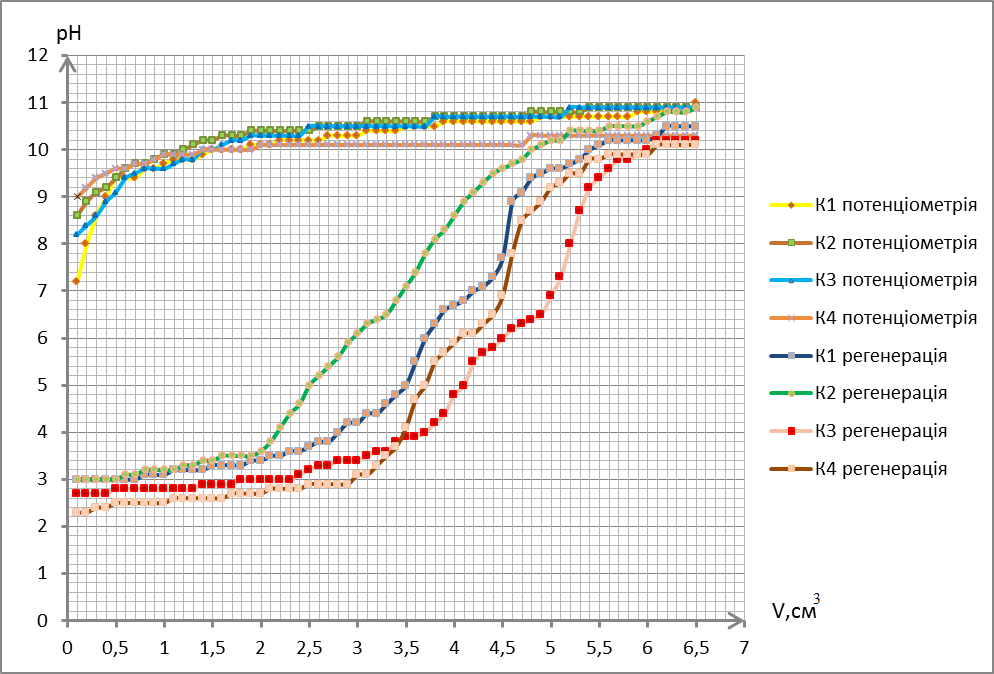
Рисунок 2.8 – Криві потенціометричного титрування та регенерації зразків сорбентів при 300°С
Аналогічно до попередніх операцій, виконуємо побудову графіка потенціометричного титрування і регенерації для зразків прожарених за температури 350 °С.
Таблиця 2.2 – Результати досліджень при 350°С
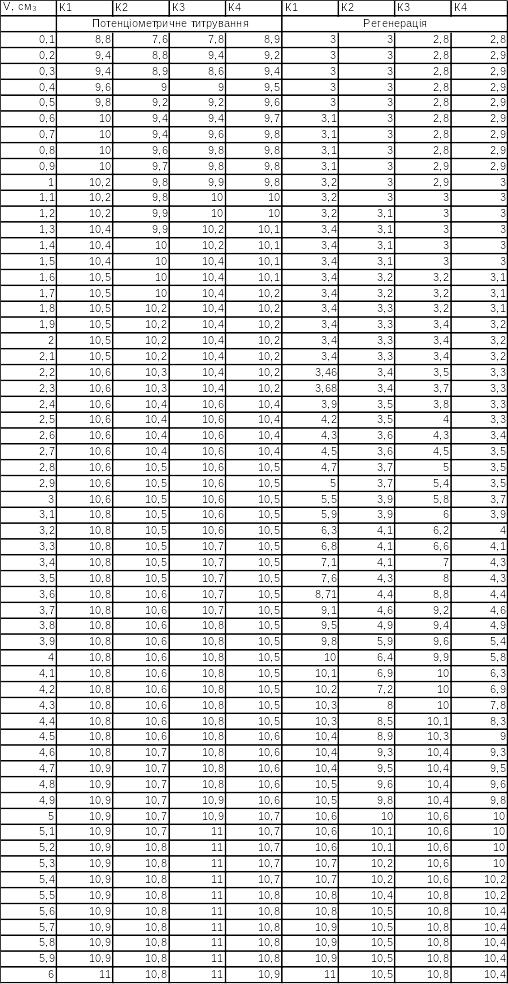

Рисунок 2.9 – Криві потенціометричного титрування та регенерації зразків сорбентів при 350°С
3.9Побудова калібрувальної кривої
Таблиця 2.3 – Залежність виміряної оптичної густини від концентрації робочих розчинів
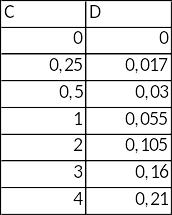

Рисунок 2.10 – Калібрувальна крива
3.10Сорбція фосфатів з робочих розчинів
Готуємо 1 дм3 модельного розчину з концентрацією KH2PO4 1 ммоль/дм3. Вимірюємо pH отриманого розчину: pH=3,7 – pH не повинен бути більше 5. Відбираємо в колбу на 100 см3 50 см3 отриманого розчину, додаємо 25 см3 реактиву на фосфат, доводимо дистильованою водою до мітки. Добре перемішуємо і чекаємо 15 хвилин. Вимірюємо оптичну густину модельного розчину на фотоелектрокалориметрі при довжині хвилі λ=490 нм. Розчином порівняння є дистильована вода.
Для проведення сорбції в конічні колби на 100 см3 додаємо по 0,1 г кожного зразка отриманого сорбенту та 25 см3 модельного розчину. Кожний зразок сорбенту ставимо на струшування на 30 хвилин, 1 годину, 2 години. Тобто отримуємо 12 колб зі зразками, прожареними за температури 300°С та 12 колб зі зразками, прожареними при 350°С.
Через визначений час знімаємо колби зі струшування, кожний з розчинів одразу фільтруємо через паперові фільтри в мірні колби ємністю на 100 см3. Доводимо фільтрат дистильованою водою до мітки. Перемішуємо розчини. З кожної колби почергово відбираємо аліквоту 75 см3 в колби на 100 см3, додаємо по 25 см3 реактиву на фосфат. Всі розчини добре перемішуємо і залишаємо постояти на 15 хвилин. Після цього вимірюємо оптичну густину отриманих розчинів при довжині хвилі λ=490 нм з розчином порівняння – дистильованою водою. Таку операцію проводимо з усіма зразками сорбентів.
Згідно виміряних даних оптичної густини, розраховуємо залишкову концентрацію P2O5 у фільтратах.
Кількість P2O5 у розчинах, розраховуємо за формулами наступними формулами:
Для модельного розчину:
![]()
(2.4)
Для розчинів після сорбції:
-

(2.5)
Відсоток вилучення визначають за формулою:

(2.6)
В результаті побудови калібрувальної кривої отримано наступні значення кількості P2O5 (таблиця 2.4).
Таблиця 2.4 – Залежність оптичної густини від вмісту фосфатів у різних зразках при різній температурі та при різному часі контактування з сорбентом
Зразок |
D |
|
, |
х, % |
||||||||
300 °С |
||||||||||||
|
30 хв |
1 год |
2 год |
30 хв |
1 год |
2 год |
30 хв |
1 год |
2 год |
30 хв |
1 год |
2 год |
С1 |
0,045 |
0,045 |
0,03 |
0,82 |
0,82 |
0,53 |
43,6 |
43,6 |
24,6 |
17,6 |
17,6 |
53,5 |
С2 |
0,055 |
0,06 |
0,045 |
1,00 |
1,11 |
0,82 |
53,3 |
59,2 |
43,6 |
0,8 |
11,9 |
17,6 |
С3 |
0,055 |
0,06 |
0,065 |
1,00 |
1,11 |
1,20 |
53,3 |
59,2 |
64,0 |
0,8 |
11,9 |
21 |
С4 |
0,075 |
0,06 |
0,07 |
1,11 |
1,30 |
1,39 |
74,1 |
69,3 |
59,2 |
11,9 |
31,0 |
40,1 |
350 °С |
||||||||||||
|
30 хв |
1 год |
2 год |
30 хв |
1 год |
2 год |
30 хв |
1 год |
2 год |
30 хв |
1 год |
2 год |
С1 |
0,025 |
0,015 |
0,01 |
0,44 |
0,24 |
0,14 |
23,5 |
12,8 |
7,5 |
55,6 |
75,8 |
85,8 |
С2 |
0,035 |
0,025 |
0,02 |
0,63 |
0,44 |
0,34 |
33,6 |
23,5 |
18,1 |
36,5 |
55,6 |
65,8 |
С3 |
0,04 |
0,03 |
0,025 |
0,72 |
0,53 |
0,44 |
38,4 |
28,3 |
23,5 |
27,4 |
46,5 |
55,6 |
С4 |
0,045 |
0,035 |
0,03 |
0,82 |
0,63 |
0,53 |
43,7 |
33,6 |
28,3 |
17,4 |
36,5 |
46,5 |
Було виміряно також оптичну густину модельного розчину. Для цього додали в колбу на 100 см3 50 см3 модельного розчину, додали 25 см3 реактиву на фосфат, довели дистильованою водою до мітки. Зачекали 15 хвилин, і виміряли оптичну густину: D0=0,14;
Концентрацію P2O5 у модельному розчині розраховуємо за формулою (2.4):
![]() .
.
Концентрацію P2O5 у фільтратах розраховуємо за формулою (2.5):
![]() .
.
Відсоток вилучення фосфатів визначаємо за формулою (2.6) :
![]() .
.
Отримані результати приводимо до графічного вигляду.
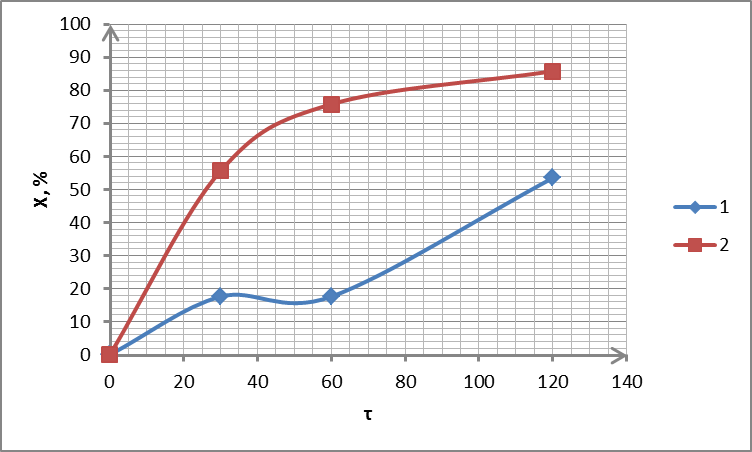
Рисунок 2.11 – Залежність ступеня вилучення від часу для зразка сорбенту С1: 1 – 300 °С; 2 – 350 °С

Рисунок 2.12 – Залежність ступеня вилучення від часу для зразка сорбенту С2: 1 – 300 °С; 2 – 350 °С
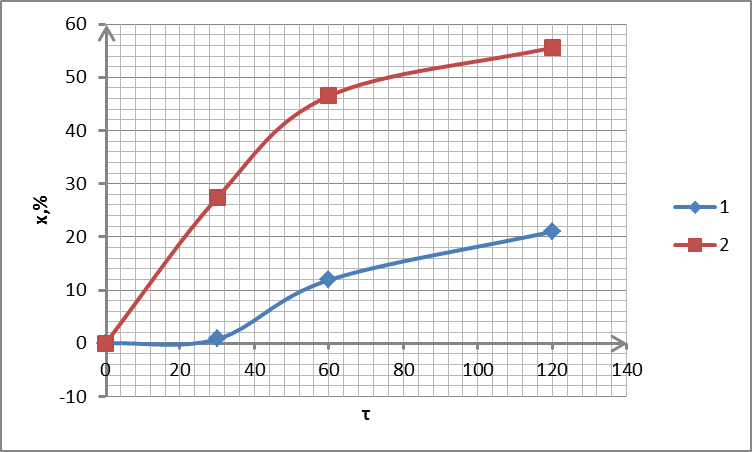
Рисунок 2.13 – Залежність ступеня вилучення від часу для зразка сорбенту С3: 1 – 300 °С; 2 – 350 °С
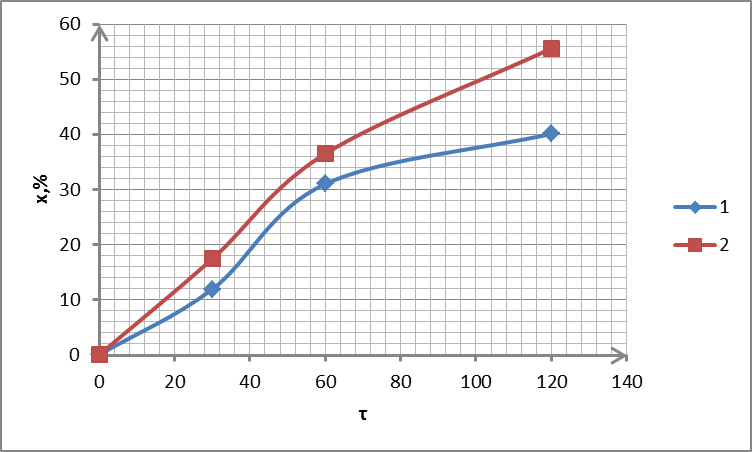
Рисунок 2.14 – Залежність ступеня вилучення від часу для зразка сорбенту С4: 1 – 300 °С; 2 – 350 °С
