
- •Реферат
- •РЕферат
- •1Перелік умовних позначень
- •2Теоретична частина
- •2.1Історія «Інституту сорбції та проблем ендоекології Національної академії наук України» та основні наукові напрямки інституту
- •2.2Теоретичні основи сорбції аніонів на оксигідроксидах металів
- •2.3Сорбція аніонів і деяких органічних пероксидів гідратованими діоксидами цирконію, титану та олова
- •2.3.1Сорбція аніонів
- •3Експериментальна частина
- •3.1Об'єкти досліджень
- •3.2Лабораторна установка
- •3.3Синтез зразків сорбенту на основі оксиду цирконію (IV)
- •3.4Аналіз отриманих сорбентів рфа
- •3.5Потенціометричне титрування
- •3.6Регенерація сорбенту
- •3.7Методика побудови калібрувального графіку
- •3.8Побудова графіків потенціометричного титрування
- •3.9Побудова калібрувальної кривої
- •3.10Сорбція фосфатів з робочих розчинів
- •4Охорона праці та безпека в лабораторії у випадку надзвичайних ситуацІй
- •4.1Заходи охорони праці
- •4.1.1Повітря робочої зони
- •4.1.2Освітлення робочої зони
- •4.1.3Шум та вібрація
- •4.1.4Електробезпека
- •4.2Безпека в надзвичайних ситуаціях
- •4.2.1Пожежна безпека
- •4.3Аналіз небезпеки об’єкта. План ліквідації аварійних ситуацій
- •Висновки
- •Перелік посилань
2.2Теоретичні основи сорбції аніонів на оксигідроксидах металів
Багато забруднювачів навколишнього середовища (As, P, Cr, Se, Te, S, F) існують в природі у вигляді аніонів солей, розчинених у воді або сорбованих на компонентах грунтів. Їх перерозподіл (міграція) здійснюється шляхом сорбційно-десорбційних процесів. У всіх природних водах і грунтах присутні карбонат-іони (розчинений вуглекислий газ) і залишки органічних кислот, які надають постійний вплив на всі природні сорбційно-міграційні процеси. Сорбція і гетерогенні реакції між оксианіонами і гідратованими оксидами заліза, алюмінію, кремнію, марганцю контролюють розподіл оксианіонів в грунтових, озерних і океанічних системах [1].
З іншого боку, ОГ металів є одним з найважливіших об'єктів хімічної технології, як сировину для одержання металів, кераміки і оптики загального та спеціального призначення, як каталізатори та носії каталізаторів і нарешті, як власне сорбенти. У всіх цих випадках велике значення мають дисперсність ОГ, конфігурація їх часток, електроповерхневі властивості. Вони визначають каталітичну і сорбційну активність. Не менш важливим є питання про сорбційне забруднення технологічних продуктів оксигідроксидной природи сорбованих аніонами, у зв'язку з отриманням чистих оксидів.
Основними методами експериментального дослідження процесу сорбції є: вивчення залежностей величини сорбції А (під величиною сорбції А мається на увазі кількість сорбату, сорбованої одиницею маси або поверхні сорбенту, виражається в моль∙г-1 або в моль∙м-2) від рН рівноважного розчину –дисперсійного середовища в суспензії (рНсусп) і від рівноважної концентрації сорбату (сорбтива) Ср при постійній температурі в статичних умовах, що дає сорбційні фронти і ізотерми сорбції, відповідно. Сорбтивом називається речовина, яка сорбується, але ще не знаходиться на поверхні сорбенту; сорбатом називається та речовина, яке вже сорбована, але частіше вживається поняття «сорбат» для обох форм [2].
Для моделі механізму сорбції застосовується поняття про внутрішньо- і зовнішньо сферичні комплекси. При встановленні механізму сорбції завдання зводиться до того, щоб визначити, який аніон сорбується внутрішньо- або зовнішньосферним чином. За визначенням, внутрішньосферичні (ВТ) комплекси утворюються, якщо має місце хімічний зв'язок між сорбованим аніоном і поверхневим іоном металу, що утворює ОГ. У внутрішньосферних (ВШ) комплексах зберігається гідратна оболонка сорбованого іона, і молекула води відділяє його від іона металу на поверхні. Головною рушійною силою ВШ-сорбції є тяжіння протилежних зарядів, можливо, за участю поверхневої води або гідроксидів як донорів протона для водневого зв'язку.
Традиційно при моделюванні механізмів сорбції західна школа дослідників приділяє велику увагу стану зарядженої поверхні сорбенту. Майже у всіх роботах користуються поняттям «точки нульового заряду (ТНЗ)», яке було введено Парксом і де Бруіном. Автори це поняття визначили як такий стан поверхні, коли число поверхневих позитивно і негативно заряджених центрів однакове.
Оскільки основні чинники, що впливають на сорбцію – це рН середовища, концентрація сорбованого іона, концентрація і природа електроліту і природа сорбенту, модель повинна бути здатна прийняти до уваги всі ці фактори. Моделі, що описують сорбцію, розрізняються формою запису поверхневих реакцій і описом прикордонного шару, що розділяє сорбент та розчин сорбата.
Оскільки в атмосфері постійно присутній вуглекислий газ, а в природних водах – карбонат- і бікарбонат-іони, питання про сорбцію карбонат-іонів має першорядне значення.
Кристалічні поліморфні зразки ZrО2 (моноклинна, тетрагональна і змішана з цих двох модифікацій) добре сорбують СО2 з газової фази. Різні кристалічні форми ZrО2 показують різні сорбційні властивості по відношенню до СО2. На зразках з моноклинною структурою утворюються гідрокарбонати і моно- і бідентатно ПК: = Zr-О-СО(OH), = Zr = О2СО або = Zr-ОСО2. Це є відображенням факту, що поверхнева активність створюється ОН-групами, координаційно-ненасиченими (кнс) О2- центрами і кнс-парами О2—Zr4+. На зразках з тетрагональною структурою утворюються бі- та полідентатні ПК =Zr=О2СО або (ZrO)3С, що відображає наявність пар О2- і близько розташованих центрів Zr4+. Бідентатні карбонати на моноклиних і тетрагональних зразках показують різні частоти в ІЧ-спектрах і мають різну термічну стійкість, що вказує на різну основність кнс-центрів О2--Zr4+ [3].
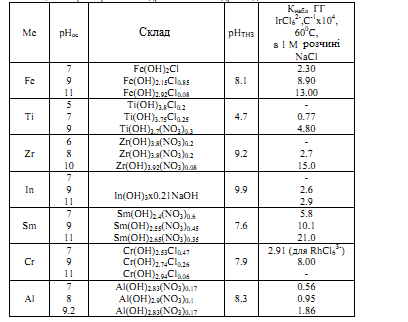
Було розглянуто цикл систематичних досліджень сорбції простих і комплексних аніонів на поверхні гідрогелів і ксерогелів аморфних ОГ деяких перехідних і р-металів (Cr, Ti, Zr, Sm, In, Al). В роботах проведено дослідження сорбційних властивостей гідрогелів ОГ Fe, Ti, Zr, In, Sm і Al в реакціях гетерогенного гідролізу аніонних комплексів ПМ. Ці реакції відрізняються досить низькою швидкістю, а гідрогелі мають дуже високу ємність по ПМ. Тому вивчали головним чином кінетику процесу, а не псевдорівновагу. У всіх випадках вивчено вплив рН осадження гідрогелів на їх сорбційні властивості та склад. Крім кінетичного методу, використані методи ТНЗ, крапельного титрування, хімічного, термічного і рентгенодифракційного аналізу. Метою робіт було створення теоретичної моделі, придатної для прогнозування сорбційних властивостей ОГ стосовно сорбції металів-комплексоутворювачів з комплексоутворюючих середовищ (водних розчинів електролітів). Для цього необхідно було встановити взаємозв'язок між фундаментальними властивостями катіона металу, що утворює ОГ, умовами синтезу та поверхневими властивостями (заряд і рНТНЗ) ОГ, і швидкістю реакцій гетерогенного гідролізу комплексів. Фундаментальні характеристики центральних іонів ОГ представлені в таблиці 1.1, і характеристики вивчених гідрогелів – в таблиці 1.2.
В роботах [3,4] встановлено два важливих факти:
значення рНТНЗ, у всіх вивчених гідрогелях, залежать від концентрації фонового електроліту (рисунок 1.1);
криві (ізотерми адсорбції), що відображають залежність певних таким чином величин рНТНЗ від рН осадження при різних концентраціях електроліту, перетинаються в точці, яка, мабуть, відповідає істинному значенню рНТНЗ ОГ, отриманого з певної вихідної солі, для даного іонного середовища. Можна бачити, що для ОГ одного і того ж металу, отриманих з різних солей, ці величини розрізняються (рисунок 1.2). Величини істинного значення рНТНЗ характеризують кислотно-основні властивості ОГ.
Визначено істинні значення рНТНЗ ряду гідрогелів ОГ в розчинах NaCl і Na2SO4 (таблиця 1.4). Гідрогелі досліджуваних ОГ здатні при рН>рНТНЗ сорбувати значні кількості ОН-груп, які використовуються в процесі гетерогенного гідролізу.
Таблиця 1.1 – Фундаментальні характеристики центральних іонів оксигідроксидів
Метал |
Іонний радіус по Гольфшміту, Å |
Іонний потенціал,
|
Електронна структура зовнішнього шару |
Al (III) |
0,54 |
5,27 |
2s22p6 |
Ti (IV) |
0,64 |
6,25 |
3s22p6 |
Cr (III) |
0,65 |
4,61 |
3p63d3 |
Fe (III) |
0,67 |
4,48 |
3p63d5 |
Co (II) |
0,83 |
2,41 |
3p63d7 |
Zn (II) |
0,83 |
2,41 |
3p63d10 |
Zr (IV) |
0,87 |
4,60 |
2s22p6 |
In (III) |
0,92 |
3,26 |
4p64d10 |
Sm (III) |
0,96 |
3,12 |
5s25p6 |
Sn (IV) |
0,67 |
5,97 |
4p64d10 |
Всі вивчені у роботах [3] гідрогелі ОГ протягом досить тривалого часу (до 1 року) при зберіганні у воді і при кімнатній температурі преставляють собою рентгеноаморфне освітлення. Такі гідрогелі, після деякого дуже швидкого самовільного зменшення рН суспензії на 0.5-1.0, потім протягом декількох десятків діб зберігають постійними свої кислотно-основні та сорбційні властивості, а також Sпит. Особливо стійкі властивості хромогелей, які зберігають величину Sпит після сушіння на повітрі, при кімнатній температурі або в ексикаторі над лугом, а також після старіння при нагріванні під розчинами електролітів [4].
В реакціях гетерогенного гідролізу найбільшу активність, оцінювану за величиною константи швидкості, виявляють цирконо-, феро- і самарієві гелі (таблиця 1.3). Справжні рНТНЗ цих ОГ перебувають в одній і тій же області 8-10.
Спосіб оцінки Sпит гідрогелів ОГ металів (Fe (III), Zr (IV), Cr (III) і In (III) заснований на величині сорбції гідроксильних груп АOH, яка визначається рН-метричним титруванням. Площа, яку займає одна ОН-група (посадковий майданчик), вирахували як середню з отриманих для сухих оксидів тих же металів з відомими величинами Sпит граничних величин сорбції ОН-груп. Ця величина склала 50 Å. Ізотерми адсорбції ОН-груп є типовими ізотермами високої спорідненості (рисунок 1.2). Величини АОН залежать від рН осадження і зменшуються з його збільшенням.
Залежність АОН від рН осадження прямолінійна для всіх вивчених гідрогелів. Гідрогель, осаджений при рН, відповідний істинному рНТНЗ, має незаряджену поверхню, і величина АОН для нього відповідає кількості надлишкових, тобто адсорбованих ОН-груп, що і дозволяє обчислити Sпит. Графічною екстраполяцією за графіком залежності АОН від рН осадження отримані величини АОН і Sпит при істинних рНТНЗ в таблиці 1.2.
Таблиця 1.2 – Значення АОН і Sпит при істинних рНТНЗ
|
Zr |
Cr |
Fe |
In |
Істинний рНТНЗ |
9.4 |
8.4 |
8.1 |
9.9 |
АОН х 10-4 г-іон·г-1 |
14 |
31 |
19.5 |
9 |
Sпит, м2·г-1 , Е(ОН)n |
420 |
930 |
585 |
240 |
Таблиця 1.3 – Характеристики гідрогелей оксигідроксидів металів
Високі значення АОН при рНосадження<істинного рНТНЗ пояснюються тим, що при цьому виходить гель з позитивно зарядженою поверхнею, і частина ОН-груп при титруванні витрачається на нейтралізацію позитивного заряду. При рНосадження>істинного рНТНЗ поверхня заряджена негативно і вже містить частину адсорбованих ОН-груп, тому АОН з підвищенням рН осадження зменшується.
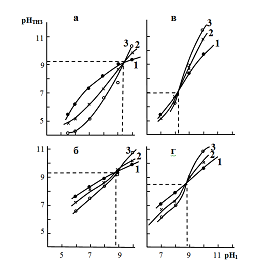
Рисунок 1.1 – Залежність pHТНЗ
від pH осадження. Цирконогелі:
отримані із
![]() (a,b), із
(a,b), із
![]() (c,d); фоновий
електроліт:
(c,d); фоновий
електроліт:
![]() (a,c),
(a,c),
![]() (b,d);
концентрації фонового електроліта,
моль·л-1: 1.0 або 0.5 (1), 0.1 або 0.05 (2),
0.01 або 0.005 (3)
(b,d);
концентрації фонового електроліта,
моль·л-1: 1.0 або 0.5 (1), 0.1 або 0.05 (2),
0.01 або 0.005 (3)
Таблиця 1.4 – Величини істинних рНТНЗ гідрогелів оксигідроксидів металів
Катіон металу |
Фоновий електроліт |
|||
NaCl |
Na2SO4 |
|||
pHосадж |
pHТНЗ |
pHосадж |
pHТНЗ |
|
Fe (III) |
8.1 |
8.1 |
7.95 |
8.6 |
Cr (III) |
8.4 |
7.9 |
9.1 |
9.1 |
Al (III) |
9.4 |
8.3 |
9.1 |
9.4 |
In (III) |
10.0 |
10.2 |
10.0 |
10.0 |
Sm (III) |
7.0 |
7.6 |
- |
- |
Ti (IV) |
4.5 |
4.7 |
- |
- |
Zr (IV) |
9.4 |
9.2 |
8.8 |
9.3 |
Sn (IV) |
4.0 |
4.1 |
4.0 |
4.1 |
Було вивчено вплив старіння гідрогелів ОГ Ti (IV), Zr (IV), In (III), Fe (III), Cr (III) в розчинах хлориду і сульфату натрію при 800 °С протягом 2 і 18 годин на їх активність в реакціях гетерогенного гідролізу (ГГ). Дослідження дозволило порівняти поведінку при старінні ОГ металів з аналогічними електронними структурами і зарядами центральних іонів (Ti і Zr); з однаковими іонними зарядами і радіусами, але різними електронними структурами (Fe і Cr), і, нарешті, з однаковими зарядами, але різними радіусами та електронними структурами (Fe, Cr і In). Швидкість ГГ, як і в інших роботах, була мірою сорбційних властивостей гідрогелів. Мають значення природа електроліту, в якому виконували старіння, і тривалість старіння, а також рНосадж гелів. Чим вище рНосадж гелю, тим більше зниження сорбційної активності за рахунок старіння. Для індіогелей і тітаногелей вплив старіння на швидкість реакції ГГ дуже мала, а для хромогелей старіння викликає настільки значну активацію, що константа швидкості реакції зростає на порядок величини. Зразки з рНосадж=7 у всіх відношеннях найбільш стійкі до старіння в розчинах електролітів при нагріванні.
Рисунок 1.2 – Ізотерми адсорбції ОН-груп (АОН) на поверхні свіжоосаджених оксигідроксидів Zr (IV) при рН осадження 5.5 (1), 7 (2) і 10 (3). [ОН]рівн –рівноважна концентрація ОН-груп в суспензії
