
- •1. Основы физико-химического материаловедения
- •1.1. Химическая связь и строение твёрдых тел
- •1.2. Дефекты кристаллической решётки. Их влияние на свойства материалов
- •1.3. Методы исследования структуры и состава
- •1.3. Основные свойства материалов
- •1.3.1. Классификация свойств
- •С войства материалов
- •1.3.2. Механические свойства материалов
- •1.3.3. Механические свойства, определяемые при динамических и циклических испытаниях
- •1.3.4. Длительная прочность и триботехнические характеристики материалов
- •1.3.5. Сопротивление материалов коррозии и теплофизические свойства
- •1.3.6. Электрофизические свойства материалов
- •1.3.7. Магнитные свойства материалов
- •1.3.8. Технологические свойства материалов
- •1.4. Кристаллизация материалов
- •1.4.1. Движущая сила кристаллизации и зародышеобразование
- •1.4.2. Неравновесная и вторичная кристаллизации
- •1.5. Введение в теорию сплавов
- •1.5.1. Фазы сплавов
- •1.5.2. Диаграмма состояния сплавов с неограниченной растворимостью. Правило отрезков (рычага)
- •1.5.3. Диаграммы состояния сплавов с ограниченной растворимостью
- •1.5.4. Диаграммы состояния сплавов, образующих химические соединения с полиморфным и эвтектоидным превращением
- •1.5.5. Связь между структурой и свойствами сплавов
- •1.5.6. Диаграммы состояния тройных сплавов
1. Основы физико-химического материаловедения
1.1. Химическая связь и строение твёрдых тел
При сближении атомов может произойти перекрытие их электронных оболочек. Возникающие при этом электростатические взаимодействия приводят к возникновению химических связей между атомами, и образованию многоатомных соединений (молекул, ионов, радикалов). Химическая связь возможна если:
1. Полная энергия многоатомной системы меньше, чем сумма энергий несвязанных атомов, из которых она образована.
2. Электронные плотности в поле сил химической связи и между сближенными на то же расстояние несвязанными атомами, заметно отличаются.
При образовании связи валентные электроны распределяются так, что силы притяжения и отталкивания между атомами уравновешиваются. Это равновесное расстояние между атомами соответствует длине химической связи.
Согласно классической теории валентности различают: ионную, ковалентную, металлическую и молекулярную (Ван-дер-Ваальсову) связи. Это объясняет разнообразие свойств веществ. Простой количественной характеристики химической связи нет. Так, Есв (энергия разделения твёрдого тела на атомы или молекулы) позволяет выделить только неимение прочную молекулярную связь (Есв 10 кДж/моль). Остальные типы связи по Есв практически не различимы (для всех Есв= 4001000 кДж/моль). Например, ионный NaCl имеет Есв= 650; ковалентный алмаз – 700; металлический Fe – 400 кДж/моль. Т.е. этот признак нельзя класть в основу классификации веществ.
Классический и квантово-механический подходы к объяснению типа химической связи объединяются, если положить в основу такой классификации пространственное распределение электронов т.е. то, как атомы делят между собой валентные электроны. Пространственное распределение электронов в кристаллах с различным типом химической связи на рис.1.1 (тёмные участки - области локализации валентных электронов).
а) модель ионного кристалла. Все валентные электроны находятся в 8-ми электронной оболочке аниона, что исключает их перемещение. Это диэлектрики. Образование такой связи возможно между атомами с различной электроотрицательностью. По мере уменьшения электроотрицательности происходит переход к ионно-ковалентным кристаллам (CdS) (возле Cd2+ имеется небольшая плотность ионов). KClAllBlVAlll BV
б)
чисто
ковалентная связь
– равномерное распределение электронов
возле соседних атомов. Устойчивая 8-ми
электронная оболочка образуется за
счёт спарившихся электронов соседних
атомов. Электронная плотность в
направлении связи достаточно велика,
т.е. наблюдается частичная коллективизация
электронов, что ухудшает электрические
свойства. Поэтому ковалентные кристаллы
даже с долей ионной связи являются
полупроводниками. Для них характерна
прочность, твердость и н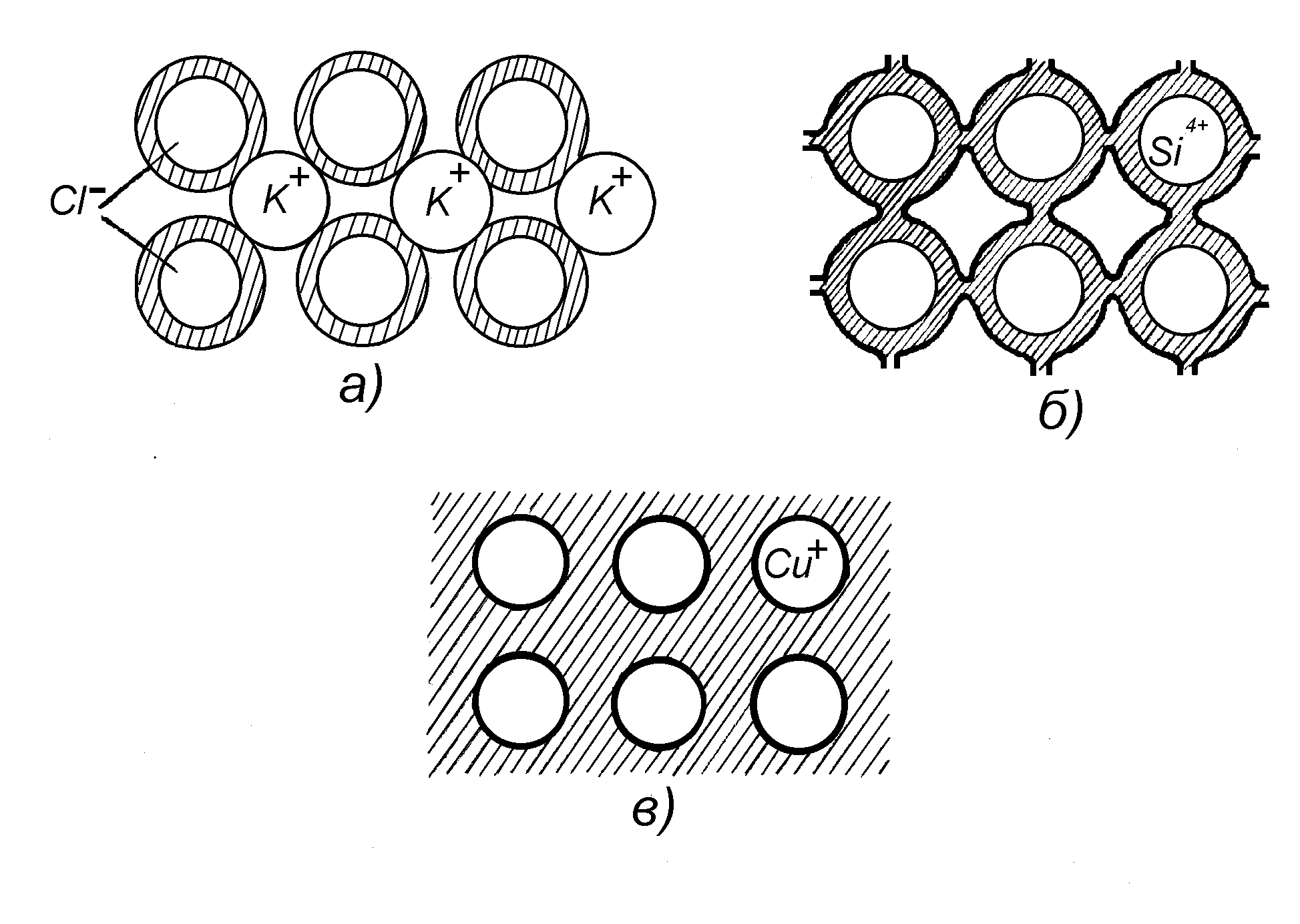 изкая
пластичность. Переход от ковалентной
к металлической связи SiGePb;
изкая
пластичность. Переход от ковалентной
к металлической связи SiGePb;
Рис.1.1. Распределение валентных электронов в химических связях
в) прочность металлической связи (полная коллективизация электронов) обусловлена притяжением положительных атомных остовов к свободным электронам. Ковалентный кристалл не образуется из-за малого количества валентных электронов. Большое число свободных электронов, ненаправленность валентных связей объясняют специфические свойства металлов – блеск, непрозрачность, прочность, пластичность, высокие электро- и теплопроводность. Обычно металлы кристаллизуются в структурах с плотной упаковкой атомов.
Все материалы могут находиться в трёх агрегатных состояниях: газовом, жидком, и твёрдом (4-е плазма). Критерием агрегатного состояния является соотношение средней потенциальной энергии взаимодействия атомов (молекул) в веществе к их кинетической энергии (р,Т) = Евз/Екин.
Газ – агрегатное состояние вещества, в котором частицы слабо связаны и хаотически движутся, заполняя весь объём. Для них (р,Т)<<1.
Жидкости сочетают свойства газов и твёрдых тел (р,Т) 1. Тепловое движение молекул жидкости – сочетание малых колебаний около положения равновесия и перескоков из одного положения равновесия в другое, чем обусловлена текучесть. Жидкости не обладают упругостью формы и практически несжимаемы.
Твёрдое тело характеризуется стабильностью формы, т.к. атомы совершают лишь малые тепловые колебания возле фиксируемых положений равновесия (р,Т) >>1. Это система сильно взаимодействующих частиц, пространственное упорядочение которых во многом определяет физические свойства вещества.
Кристаллы – твёрдые тела с 3-хмерной периодической атомной структурой (кристаллической решёткой), имеющие при равновесных условиях образования форму правильных симметричных многогранников. Если для жидкостей и некристаллических твёрдых тел характерен ближний порядок в расположении соседних частиц, то кристаллы имеют дальний порядок, т.е. строгую повторяемость во всех направлениях одного и того же структурного элемента.
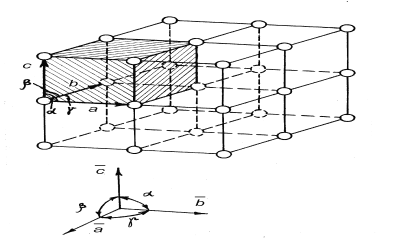
Строение
кристаллов характеризуется элементарной
ячейкой – минимальным объёмом
кристаллической решётки, путём трансляции
(параллельного переноса) которой можно
построить всю решётку. Рёбра элементарных
ячеек обозначаются ,
и
и называют периодами
кристаллической решётки или векторами
трансляций.
Углы между ними обозначаются ,
и
(рис.1.2). Каждая атомная плоскость
кристаллической решётки, пересекаясь
с осями координат, построенных на
векторах
![]() ,
отсекает на них отрезки соответствующие
целым числам периодов. Обратные им числа
h k l
называют кристаллографическими индексами
или индексами
Миллера.
Грани кристалла имеют индексы (100), (010),
(001).
,
отсекает на них отрезки соответствующие
целым числам периодов. Обратные им числа
h k l
называют кристаллографическими индексами
или индексами
Миллера.
Грани кристалла имеют индексы (100), (010),
(001).
 По
признакам симметрии элементарной ячейки
все кристаллы группируются в 7 сингоний,
которые отличаются соотношениями
периодов решётки и углами между векторами
элементарных трансляций.
По
признакам симметрии элементарной ячейки
все кристаллы группируются в 7 сингоний,
которые отличаются соотношениями
периодов решётки и углами между векторами
элементарных трансляций.
Р ис.1.2.
Элементарная ячейка Рис.1.3.
Структуры металлов и сплавов
ис.1.2.
Элементарная ячейка Рис.1.3.
Структуры металлов и сплавов
Каждая сингония включает несколько пространственных групп симметрии (их всего 230, систематизированы Е.С.Фёдоровым). Структура всех известных кристаллов соответствует какой-либо из этих групп.
Большинство металлов кристаллизуется в высокосимметричных решётках с плотной упаковкой атомов: кубических объемно центрированной (ОЦК) и гранецентрированной (ГЦК) и гексагональной плотной упаковке (ГПУ) (см. рис.1.3). ОЦК решётку имеют: Pb, K, Na, W, V, Cr, Feα и др.; ГЦК: Ni, Cu, Ag, Au, Pt, Fe и др.; ГПУ – Mg, Cd, Be, Zn и др. Периоды решётки a, b, c для большинства металлов 0,1 – 0,7 нм. Наибольшей плотностью упаковки обладает ГЦК и ГПУ (с/а = 1,633) решётки (74%).
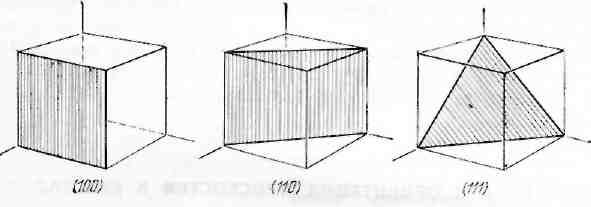
Даже наиболее симметричные ГЦК и ОЦК решётки обладают анизотропией, неоднородностью физических свойств в разных кристаллографических направлениях. Это связано с тем, что плотность атомов по различным плоскостям неодинакова, например в плоскости (100) ОЦК-решетки ¼*4 = 1 атом; (110) – 2, в ГЦК наибольшая плотность в плоскости (111) (рис.1.4). Кубические кристаллы изотропные по отношению к прохождению света, электро- и теплопроводности, но анизотропные в отношении к упругим, электрооптическим, пьезоэлектрическим свойствам. Наибольшая степень анизотропии характерна для кристаллов низких сингоний.
 (100)
(110)
(111)
(100)
(110)
(111)
Рис.1.4. Основные кристаллографические плоскости кубической решетки
Некоторые кристаллические фазы являются метастабильными (относительно устойчивыми). Полиморфизм – свойство веществ находиться в нескольких кристаллических модификациях с различной структурой. Feα (ОЦК) и Feγ (ГЦК); Соα (ГЦК) и Соβ (ГПУ) и др. Изоморфизм – свойство различных, но родственных по химическому составу веществ кристаллизуется в одинаковых структурах при одинаковом типе химической связи.
Большинство твёрдых металлов являются поликристаллическими, т.е. состоят из множества ориентирных хаотично мелких кристаллов (кристаллитов). Крупные одиночные кристаллы называются монокристаллами. Поликристаллы являются псевдоизотропными. Если есть преимущественная ориентация (текстура), возникает анизотропия.
Некристаллические твёрдые материалы характеризуются отсутствием дальнего порядка в расположении атомов, ионов, молекул. Среди них выделяют стеклообразные вещества, в которых при нагревании наблюдается обратимый переход из твёрдого в высокоэластичное состояние. Стеклообразные вещества метастабильны, при внесении в их расплав центров кристаллизации можно сформировать кристаллическую фазу.
Аморфные вещества образуются при очень быстром охлаждении расплава или в плёнках, осажденных на холодную подложку. Состояние квазистабильно и при нагреве переходит в кристаллическое. Многие аморфные металлические сплавы (например, железа) обладают комплексом ценных для практического использования свойств и находят все большее применение в технике.
