
- •NaCl Natrii chloridum.
- •KCl Kalii chloridum
- •NaBr Natrii bromidum.
- •KBr Kalii bromidum
- •NaI Natrii iodidum
- •Ki Kalii iodidum
- •Natrii hydrocarbonas NaHco3
- •Natrii tеtraborаs seu Borax (бура)
- •Protаrgolum seu Argentum proteinicum
- •Collargolum seu Argentum colloidale
- •Solutio Formaldehydi seu Formalinum
- •Hexamethylentetraminum seu Urotropinum seu Methenaminum
- •Глюкоза
- •Димедрол
- •Calcii gluconas
- •2. Метод нейтрализации.
- •Natrii citras pro injectionibus
- •Natrii hydrocitras pro injectionibus
- •Acidi glutaminicum
- •Acidum aminocapronicum
- •Ephedrini hydrochloridum
- •Резорцин – Resorcinum
- •Acidum benzoicum
- •Acidum salicylicum
- •Natrii benzoas
- •Салицилат натрия – Natrii salicylas
- •Acidum acetylsalicylicum (Aspirinum)
- •Стрептоцид – Streptocidum
- •Норсульфазол –Norsulfazolum seu Sulfathiazolum
- •Phthalazolum-фталазол
- •Anaesthesinum. Aethyliiaminobenzoas
- •Natrii para-aminosalicylas
- •Furacilinum
- •Antipyrinum
- •Analginum.
- •Butadionum
- •Pilocarpini hydrochloridum
- •Dibazolum
Acidum benzoicum

Получение
1 Окисление толуола

Свойства.Бесцветные игольчатые кристаллы или белый мелкокристаллический порошок. При нагревании возгоняется, перегоняется с водяным паром. Мало растворим в воде, растворим в кипящей воде, легко растворим в спирте, зфире, хлороформе и бензоле, растворим в жирных кислотах.
Подлинность
1.опр Тплав.122-124,50С
2 Реактив FeСl3
. Образуется осадок желто-розового цвета.

Нефармакопейные реакции.
1 Реакция позволяющая разделить две кислоты(бензойную и салициловую): растворяют в воде и хлороформе и прибавляют CuSO4. Водный слой окрашивается в зеленый цвет (салициловая кислота), хлороформенный слой окрашивается в бирюзовый цвет (бензойная кислота).
Количественное определение
1 Метод нейтрализации в спиртовой среде ( спирт необходим для растворения кислоты и уменьшения гидролиза продуктов реакции)

Применение Антисептическое средство.
Хранение. В хорошо укупоренной таре.
Acidum salicylicum

Орто-гидрокси бензойная кислота
Получение
1 Реакция карбоксилирование фенолята натрия (реакция идет при повышении давления, t=120-1300С)
Метод Кольбе, Шмидта

Полученную кислоту очищают путем многократной перекристаллизацией из воды
Свойства. Белые мелкие игольчатые кристаллы или легкий кристаллический порошок без запаха. Летуч с водяным паром, при осторожном нагревании возгоняется. Мало растворим в воде, растворим в кипящей воде, растворим в спирте, эфире, трудно растворим в хлороформе
Подлинность
1 Определение температуры плавления по ГФ 158-1610С
2 Реактив FeCL3
Салициловую кислоту растворяют в воде (t0) и прибавляют раствор FeCL3 появляется сине-фиолетовое окрашивание исчезающее при добавлении HCl,устойчивое при добавлении CH3COOH.

3 Реакция декарбоксилирования.
Сухой препарат нагревают с цитратом натрия, ощущается запах фенола.

4 В выпарительную чашку помещают несколько кристаллов салициловой кислоты и H2SO4 конц и нагревают осторожно. Выделившийся газ пропускают через известковую воду, которая мутнеет.
 CO2
+
Ca(OH)2=CaCO3+H2O
CO2
+
Ca(OH)2=CaCO3+H2O
Нефармакопейные реакции
1 Реакция позволяющая разделить две кислоты растворяют в воде и хлороформе и прибавляют CuSO4. Водный слой окрашивается в зеленый цвет (салициловая кислота), хлороформенный слой окрашивается в бирюзовый цвет (бензойная кислота).
2 Получение ауринового красителя.
В выпарительную чашку помещают несколько кристаллов салициловой кислоты добавляют формальдегид и H2SO4. Появляется малиновое окрашивание.
Количественное определение
1 Метод нейтрализации в спиртовой среде (спирт добавляют для растворения кислоты и подавления гидролиза продуктов реакции)
Нефармакопейный метод
Метод броматометрии




Примение.Антисептическое, кератолитическое средство.
Хранение В хорошо укупоренной таре, предохраняющей от действия света.
Natrii benzoas

Получение
Получают при нейтрализации кислот раствором Na2CO3. Полученный раствор выпаривают. Сухой остаток очищают многократной перекристаллизацией воды.
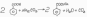
Свойства.Белый кристаллический порошок без запаха или с очень слабым запахом, сладковоъато-соленого вкуса.
Легко растворим в воде, трудно- в спирте. Реакция водных растворов щелочная.
Подлинность
1 На Na+
2 На кислотную часть
А) Реактив FeCl3
образуется осадок желто-розового цвета.

Б) К раствору препарата прибавляют соляную кислоту и образуется осадок кислоты, который отделяют, сушат и определяют температуру плавления = 120-1240С.
Количественное определение
Метод нейтрализации
ТНП растворяют в воде и добавляют эфир, добавляют смешанный индикатор метиловый синий и метиловый оранжевый (1:1). Раствор титруют раствором HCl с 0,5 моль/л и титруют до фиолетовой окраски водного слоя.
Эфир добавляют для извлечения кислоты, выделяющийся в процессе титрования.

Применение. Отхаркивающее средство.
Хранение. В хорошо укупоренной таре.
