
- •Модуль1 Змістовий модуль 1. Атомно-молекулярне вчення. Періодичний закон.
- •Тема 1. Вступ. Хімія як предмет природознавства. Роль хімії у вивченні природи і розвитку техніки. Хімія і екологія.
- •Тема 2. Основні поняття і закони хімії.
- •Тема 3. Періодичний закон і періодична система елементів.
- •Тема 1. Електронна будова атома.
- •Тема 2. Хімічний зв'язок.
- •Йонний зв’язок
- •Металічний зв’язок
- •Водневий зв’язок
- •Модуль 2
- •Змістовний модуль 4. Розчини. Дисоціація і комплексоутворення
- •Тема 1. Дисперсні системи. Властивості розчинів. Класифікація та основні характеристики дисперсних систем. Способи вираження концентрації розчинів. Фізичні властивості розчинів. Закони Рауля.
- •Тема 2. Розчини електролітів. Механізм електролітичної дисоціації. Ступінь дисоціації. Сильні та слабкі електроліти. Властивості розчинів електролітів. Константа дисоціації. Водневий показник
- •Тема 3. Розчини електролітів. Поняття про буферні розчини. Гідроліз солей, випадки гідролізу солей, рН розчинів солей. Добуток розчинності.
- •Змістовий модуль 5. Окисно-відновні процеси. Основи електрохімії та корозії.
- •Тема 1. Окисно-відновні процеси. Ступінь окиснення. Типи окисно-відновних реакцій. Метод електронного балансу при урівнюванні окисно-відновних реакцій.
- •Тема 3. Корозія металів. Види корозійного руйнування металів. Механізм хімічної та електрохімічної корозії. Фактори, що впливають на швидкість корозійних процесів. Методи захисту металів від корозії.
- •Тема 4. Комплексні сполуки. Координаційна теорія Вернера, будова, класифікація, номенклатура, використання комплексних сполук в хімії.
- •Змістовий модуль 7. Основи хімії та біогеохімії d- та f-елементів.
- •Тема 1. Перехідні біометали. Поширення в природі, властивості, добування, біологічна роль сполук.
- •Змістовий модуль 8. Геохімічні особливості геосфер земної кори та біосфери.
- •Тема 1. Геохімія та біогеохімія. Поширення та розподіл хімічних елементів у різних зонах Землі. Елементи – органогени, “біометали” або – метали життя. Роботи Вернадського.
- •Тема 1. Біогеохімічні процеси, які відбуваються у біосфері в результаті життєдіяльності організмів
- •Тема 2. Біогеохімічні властивості біметалів Біогеохімічна активність координаційних сполук
- •Біогеохімічна активність координаційних сполук
Тема 2. Розчини електролітів. Механізм електролітичної дисоціації. Ступінь дисоціації. Сильні та слабкі електроліти. Властивості розчинів електролітів. Константа дисоціації. Водневий показник
Речовини, розчини або розплави яких проводять електричний струм, називаються електролітами. Речовини, розчини або розплави яких не проводять електричного струму, називаються неелектролітами. Розпад електролітів на йони під час їхнього розчинення у воді називається електролітичною дисоціацією.
Основні положення теорії електролітичної дисоціації
1) Електроліти під час розчинення у воді розпадаються (дисоціюють) на позитивно й негативно заряджені йони. Розпад на йони здійснюється під дією диполів води.
2) Йони в розчині перебувають у гідратованому стані, тобто вони оточені диполями води.
3) Під дією електричного струму позитивно заряджені йони (катіони) рухаються до катода, негативно заряджені (аніони) — до анода. Завдяки руху йонів розчини електролітів проводять електричний струм.
4) У розчинах на йони розпадаються речовини з йонним і ковалентним полярним зв’язком.
Ступінь дисоціації
Ступінь
дисоціації
—
відношення числа молекул N,
що розпалися на йони, до загального
числа розчинених молекул
![]() :
:
![]() .
Ступінь дисоціації виражається в частках
одиниці або у відсотках.
.
Ступінь дисоціації виражається в частках
одиниці або у відсотках.
Якщо ступінь дисоціації менший 3 %, то електроліт називається слабким, якщо більший 30 % — сильним. Електроліти, ступінь дисоціації яких лежить у межах від 3 до 30 %, називаються електролітами середньої сили.
Електролітична дисоціація кислот, лугів, солей
Кислоти
дисоціюють на катіони Гідрогену й аніони
кислотного залишку, наприклад:
![]() .
Луги дисоціюють на катіони металу (або
йони амонію
.
Луги дисоціюють на катіони металу (або
йони амонію
![]() )
та аніони гідроксигрупи, наприклад:
)
та аніони гідроксигрупи, наприклад:
![]() .
Солі дисоціюють на катіони металу (або
йони амонію
)
та аніони кислотного залишку, наприклад:
.
Солі дисоціюють на катіони металу (або
йони амонію
)
та аніони кислотного залишку, наприклад:
![]() .
На
йони не розпадаються осади, гази, а також
вода — сполука, яка мало дисоціює.
.
На
йони не розпадаються осади, гази, а також
вода — сполука, яка мало дисоціює.
Реакції обміну в розчинах. Йонні рівняння
Реакції у водних розчинах з участю електролітів є реакціями між іонами. Вони називаються йонними реакціями, а рівняння цих реакцій — йонними рівняннями.
План запису йонних рівнянь реакцій
Записуємо схему реакції в молекулярній формі:
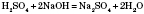
Перевіряємо, чи є серед реагентів або продуктів реакції малодисоційовані речовини, гази або речовини, які випадають в осад. У даному рівнянні є малодисоційована сполука — вода, отже,
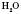 записуємо
в молекулярному вигляді, а решту речовин
— у вигляді йонів:
записуємо
в молекулярному вигляді, а решту речовин
— у вигляді йонів:
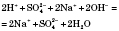
Це повне йонне рівняння.
Виключаємо з обох частин йонного рівняння однакові, тобто ті, що не беруть участі в реакції, йони.
Переписуємо
йони, що залишилися:
![]()
Скорочуємо
коефіцієнти:
![]()
Це скорочене йонне рівняння.
Якщо
в рівнянні немає малодисоційованих
речовин, газів або речовин, які випадають
в осад, то ця реакція не відбувається
повністю. Наприклад:![]()
![]() У цьому рівнянні всі йони
скорочуються, отже, з точки зору
електролітичної дисоціації реакція не
відбувається.
У цьому рівнянні всі йони
скорочуються, отже, з точки зору
електролітичної дисоціації реакція не
відбувається.
