
- •Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель.
- •Равновесие в гетерогенной системе раствор-осадок. Произведение растворимости (пр).
- •Кислотно-основное титроване. Ацидиметрия и алкалиметрия. Рабочие растворы. Стандартные растворы.
- •Алкалиметрия- рабочий раствор – раствор щелочи. Готовят по навеске.
- •Раствор щелочи стандартизируют по гидрофталату калия, щавелевой кислоте, бензойной кислоте и т.Д.
- •Условия образования осадков. Влияние различных факторов на образование осадков.
- •Кривая титрования. Выбор индикатора. Механизм действия индикатора.
- •1.Качественный анализ. Классификация методов по количеству исследуемого вещества.
- •Классификация реакций по способу проведения.
- •Аналитическая реакция. Реактивы. Частные, групповые.
- •Метод броматометрии. Способы фиксации точки эквивалентности. Применение в фармацевтическом анализе.
- •Методы качественного анализа. Дробный и систематический анализ.
- •Аргентометрия –метод Мора ,применение в фармацевтическом анализе;
- •Общая характеристика катионов 1 группы. Применение катионов 1 группы и их соединений в медицине.
- •Аргентометрия - Метод Фаянса
- •Катионы II аналитической группы. Общая характеристика. Значение соединений катионов II группы в медицине.
- •Метод Фольгарда –уравнение метода, условия титрования, индикатор.
- •III аналитическая группа катионов. Характеристика группы. Применение соединений 3-й группы.
- •Перманганатометрия. Использование метода для анализа лекарственных веществ.
- •Общая характеристика и применение соединений катионов IV группы в медицине.
- •Фотометрические методы анализа. Классификация.
- •Общая характеристика Катионов Vгр.
- •Требования к цветным реакциям в фотометрическом анализе.
- •Общая характеристика катионов VI группы.
- •Закон Ламберта-Бера.
- •Основные сведения о титриметрическом анализе, особенности и преимущества его. Закон эквивалентности.
- •Последовательность фотометрического метода анализа.
- •Классификация методов по типу реакции.
- •Хроматографический метод. Процессы, лежащие в основе метода.
- •Способы выражения концентрации рабочего раствора Растворы с молярной концентрацией эквивалента вещества, молярные растворы. Титр и титрованные растворы..
- •Последовательность хроматографического метода анализа. (на примере газо-жидкостной )
- •Классификация титриметрического анализа по способу проведения.
- •Метод прямого титрования. Определяемое вещество непосредственно реагирует с титрантом:
Способы выражения концентрации рабочего раствора Растворы с молярной концентрацией эквивалента вещества, молярные растворы. Титр и титрованные растворы..
Молярная концентрация вещества (молярность) – количество вещества, содержащееся в одном литре раствора. С=ν/V (моль/л или М).
Молярная концентрация эквивалента (нормальность) – количество моль эквивалента вещества, содержащееся в одном литре раствора.
С1/z =ν1/z /V (моль/л или н) или С1/z =z.C, где z – число ионов водорода, участвующих в кислотно-основной реакции или число электронов, участвующих в окислительно-восстановительной реакции.
Титр – один из способов выражения концентрации раствора.
Титр показывает
число граммов растворенного вещества
в 1 мл раствора.
Т=m/V
(г/мл) , Т=![]()
Например, выражение «титр H2SO4 равен 0,0049 г/мл» означает, что в 1 мл данного раствора серной кислоты содержится 0,0049 г H2SO4. Титр обозначается буквой Т с указанием формулы соответствующего вещества. В данном случае - ТH2SO4=0,0049 г/мл.
Титр по определяемому веществу - масса определяемого вещества, которому соответствует 1 мл рабочего раствора
Тх/у
=![]()
![]() ,
где х- рабочий
раствор, у- определяемое вещество;
,
где х- рабочий
раствор, у- определяемое вещество;
С1/z х - нормальная концентрация рабочего раствора,
М1/zу- эквивалентная масса определяемого вещества.
М1/z=М/ z ;
Z кислот = основности Z оснований= кислотности Z соли= валентность металла х число атомов металла,
В окислительно восстановительных реакциях z=число электронов
Последовательность хроматографического метода анализа. (на примере газо-жидкостной )
При хроматографировании компоненты смеси перемещаются через пористую стационарную (неподвижную) фазу под влиянием движущейся жидкости или газа, называемых подвижной фазой.
В некоторых случаях стационарной фазой служит тонкоизмельчённое твёрдое вещество, помещённое в узкую стеклянную или металлическую трубку. Измельчённое твёрдое вещество можно покрыть тонким слоем жидкости и поместить в стеклянную или металлическую трубку, через которую пропускают подвижную фазу.
Подвижную фазу- инертный газ -пропускают через твёрдую фазу под давлением.
Подготовка пробы - проба не должна содержать необратимо адсорбирующих веществ.
Ввод пробы- щприцом или микрощприцом через резиновый уплотнитель.
При передвижении смеси по колонке происходит разделение смеси на отдельные компоненты.
Отдельные вещества попадают в детектор. Используется детектор по теплопроводности или электронного захвата.
При прохождении вещества через детектор самописец выписывает хроматографический пик.
Качественная характеристика- время удерживания, количественная- высота или площадь пика.
Метод относительный. И требует калибровки.
Н екоторые
примеры хроматограмм показаны на рис.
екоторые
примеры хроматограмм показаны на рис.
Время от момента ввода пробы в колонку до момента регистрации максимума пика называется временем удерживания (tR). В оптимальных условиях оно не зависит от количества введенной пробы и с учетом геометрических параметров колонки определяется строением того или иного соединения, т. е. является качественной характеристикой компонентов. Количественное содержание компонента характеризуется величиной пика, точнее его площадью. Подсчет площади пика обычно осуществляют автоматически с помощью прибора интегратора, который фиксирует и время удерживания, и площадь пика. Современная аппаратура позволяет сразу получать компьютерную распечатку с указанием содержания всех компонентов разделяемой смеси.
Билет №17
Рабочие растворы. Растворы с титром приготовленным и титром установленным. Исходные вещества. Требования к исходным веществам.
Титранты – рабочие растворы, используемые при титровании.
Приготовление титрованных растворов:
Растворы с приготовленным титром – точную навеску, взятую на аналитических весах, растворяют в мерной колбе, т.е. готовят раствор, в котором точно известно количество растворенного вещества и объем раствора.
Растворы с установленным титром – раствор готовят приблизительно нужной концентрации, а точную концентрацию определяют титрованием, имея другой раствор с приготовленным титром.
Титрованный, или стандартный, раствор – раствор, концентрация которого известна с высокой точностью. Применяются для установления концентрации титрантов.
Требования к стандартам (к исходным веществам):
Высокая степень чистоты. Должны иметь состав, точно соответствующий химической формуле;
Устойчивость, не должны подвергаться воздействию компонентов атмосферы;
Иметь по возможности достаточно высокую молярную массу эквивалента; это уменьшает относительную ошибку при определении
Должно быть устойчивым в растворе
Должны быть легкодоступными (умеренная цена).
Примеры стандартов: дигидрат щавелевой кислоты Н2С2О4.2Н2О, карбонат Na2CO3, декагидрат тетрабората натрия Na2B4O7.10H2O (бура) и др.
Рефрактометрический метод.
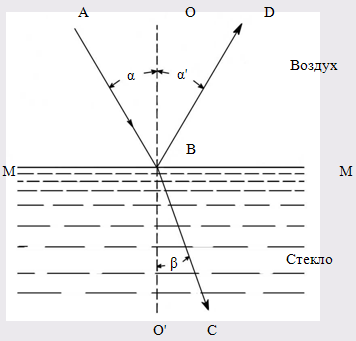
Является одним из самых простейших физ. методов с min затратой анализируемого вещества и коротким временем проведения.Рефрактометрия (от лат. refractus - преломленный и греч. metreo - измеряю) - метод анализа, основанный на явлении преломления света при прохождении из одной среды в другую. Преломление света, то есть изменение его первоначального направления, обусловлено различной скоростью распределения света в различных средах.. Согласно законом преломления, отношение синусов углов падения α и преломления β, равное отношению скорости распространения света V1 и V2 в двух соприкасающихся средах, есть величина постоянная: n= sin α/ sin β, где n – называется относительным показателем (или коэффициентом) преломления . .
Показатель преломления зависит от ряда факторов :
природы вещества;
концентрации раствора;
природы растворителя;
температуры;
длины волны света;
При работе с растворами веществ сначала измеряют показатель преломления растворителя, который вычитают из показателя преломления раствора. Определение проводят при температуре 200С и длине волны линии D спектра натрия 589,3 нм, и показатель преломления обозначают с индексами – nD20.
Принцип работы:
Основан на опред. показателя преломления методом предельного угла (угол полного отражения света).
Порядок работы:
1) Проверка чистоты соприкасающихся поверхностей призмы;
2) Проверка нулевой точки:
На поверхность измерительной призмы наносят 2-3 кап. дистиллированной воды и осторожно закрывают осветительной призмой.

3) Измерение показателя преломления раствора и определение концентрации раствора по таблице;
4) После определения показателя необходимо камеры промыть водой, вытереть досуха салфеткой, между камерами заложить прокладку из тонкого слоя ваты.
Содержание препарата вычисляем по формуле:
X = (n - n0) / F;
где n - показатель преломления препарата;
n0 - показатель преломления воды;
F - величина прироста показателя преломления при увеличении концентрации препарата на 1%.
Меры предосторожности при работе:
1) Перед определением показателя преломления призмы тщательно очищать от грязи и пыли;
2) Не допускается измерен. показат. преломления к-т и щелочей, т.к. они разъедают поверхность призмы;
3) После измерения протирают поверхности призм, чистят мягкой салфеткой смоченной водой или спиртом. Вытирают насухо и закладывают между призмами небольшую сухую чистую салфетку.
Категорически запрещается:
1) Вращать винт, окрашенный в красный цвет;
2) Оставлять на продолжительное время между призмами исследуемый раствор, т.к. поверхность призм после этого покрывается тонким матовым слоем, и измерение становится невозможным.
Билет №18
