
- •32)Поверхностная энергия.
- •Пав и пиав
- •33)Смачивание и растекание
- •Уравнение бэт
- •Механизм образования дэс
- •42) Коллоидная система состоит из двух частей: мицелл и интермицеллярной жидкости.
- •47) Коагуляция. Агрегативная и кинетическая устойчивость дисперсных систем. Термодинамические и кинетические факторы устойчивости.
- •50) Кинетика коагуляции. Уравнение Смолуховского. Константа скорости быстрой коагуляции.
- •51) Стабилизация дисперсных систем. Коллоидная защита. Механизм защитного действия вмв. Защитное число.
- •53) Осмотическое давление коллоидных растворов. Уравнение Вант – Гоффа. Значение явление осмоса в коллоидных системах.
- •54). Задачи и методы сидиментационного анализа.
- •57) К грубодисперсным системам относятся:
- •58) Эмульсии - особый вид дисперсных систем, дисперсная фаза и дисперсионная среда являются взаимонерастворимыми жидкостями, это системы ж/ж.
- •60) Аэрозоли - дисперсные системы, в которых частицы дисперсной фазы находятся во взвешенном состоянии. Дисперсионная среда - газ, дисперсная фазы
50) Кинетика коагуляции. Уравнение Смолуховского. Константа скорости быстрой коагуляции.
Кинетика коагуляции.
Процесс нарушения агрегативной устойчивости дисперсных систем, приводящий к агрегированию частиц и выделению дисперсной фазы, называют коагуляцией. Этот процесс проходит не моментально. Очевидно, что требуется какой-то промежуток времени для изменения под действием коагулирующего фактора структуры стабилизирующих слоев и формирования агрегатов частиц.
Если говорить об электролитной коагуляции, то в присутствии электролитов сжимаются двойные электрические слои и при этом снижается потенциальный энергетический барьер отталкивания частиц, препятствующий их слипанию при столкновении. В том случае, если потенциальный барьер отсутствует и любое столкновение частиц приводит к их слипанию, говорят о быстрой коагуляции. Если же остается некоторый потенциальный барьер отталкивания и не всякое столкновение способно привести к слипанию частиц, то такой процесс называют медленной коагуляцией.
При создании теории кинетики коагуляции необходимо было решить две задачи. Первая из них – определение частоты столкновений, вторая – определение эффективности столкновений.
Уравнение Смолуховского — кинетическое уравнение, описывающее эволюцию функции распределения координат и скоростей частиц при одномерном броуновском движении

![]() — функция
распределения броуновских частиц по
координатам и скоростям, v — скорость,
— функция
распределения броуновских частиц по
координатам и скоростям, v — скорость,
![]() -
внешняя сила,
-
внешняя сила,
![]() — постоянная
Больцмана,
T — температура,
— постоянная
Больцмана,
T — температура,
![]() —
параметр, характеризующий вязкость
среды, в которой происходит броуновское
движение.
—
параметр, характеризующий вязкость
среды, в которой происходит броуновское
движение.
Уравнение Смолуховского является частным случаем уравнения Фоккера — Планка.
скорость коагуляции определяется тремя факторами:
– радиусом сферы сил притяжения частиц;
– интенсивностью броуновского движения, которая определяет число столкновений в единицу времени и характеризуется коэффициентом диффузии D;
– начальной концентрацией частиц n0;
51) Стабилизация дисперсных систем. Коллоидная защита. Механизм защитного действия вмв. Защитное число.
Дисперсные системы обладают большой поверхностью раздела фаз и, следовательно, большой избыточной поверхностной энергией, поэтому они неустойчивы без стабилизаторов. При стоянии коллоидных растворов частички слипаются в более крупные, что приводит к образованию осадков. Эмульсии без стабилизаторов расслаиваются очень быстро до образования двух слоев жидкостей. Пены также разрушаются. Стабилизация коллоидных систем осуществляется образованием заряженного адсорбционного слоя в гранулах. Одноименно заряженные гранулы отталкиваются друг от друга, что препятствует их слипанию. Этому способствуют также дипольные молекулы воды, ориентированные у диффузных слоев мицелл. У гидрофильных коллоидов также около заряженных групп (-СОО-, -NН , - ОН- и др.) удерживается много молекул воды, препятствуя их слипанию. ^ Стабилизация эмульсий. Обычно одна из фаз эмульсий - вода, а другая - любая органическая жидкость, не смешивающаяся с водой - масло, бензол, бензин и другие углеводороды. Эту другую жидкость принято называть маслом. Таким образом различают эмульсии двух типов - масло в воде (М/В, масло - фаза, вода ~ среда) и вода в масле (В/М, вода - фаза, масло - среда). Для придания эмульсии устойчивости добавляется стабилизатор - поверхностноактивное вещество (ПАВ). Эти органические соединения, в молекулы которых входят одновременно и полярная группа (-ОН, -СООН, -NН2 и др.) и длинная неполярная углеводородная цепь.
Коллоидная защита — предохранение коллоидных растворов от коагуляции и, следовательно, повышение их устойчивости добавлением небольших количеств высокомолекулярных веществ (белков, крахмала, агар-агара и др.), так называемых защитных веществ. Коллоидная защиту используют при изготовлении устойчивых коллоидных препаратов серебра (колларгол), ртути, серы и других, применяемых в медицине.
Механизм защитного действия сводится к тому, что защищающее вещество адсорбируется коллоидными частицами и образует на их поверхности защитный слой, который придает частицам свойства высокомолекулярных соединений. Это подтверждается тем, что защищенные золи ведут себя по отношению к электролитам так же, как защищающие их вещества. Валентность коагулирующего иона имеет сравнительно малое влияние на порог коагуляции, но последний зависит от гидратации ионов. Адсорбция защитного коллоида на защищаемой взвеси, влияет на их электрокинетические свойства.
ЗАЩИТНОЕ ЧИСЛО - число миллиграммов высокомолекулярного соединения, которое необходимо добавить к 10 мл. стандартного золя для того, чтобы предотвратить его коагуляцию при введении 1 мл 10%-ного раствора хлорида натрия. При использовании в качестве стандартного золя золота, защитное число называют золотым.
52) Молекулярно – кинетические свойства коллойдных систем. Броуновское движение, диффузия. Уравнение Смолуховского для смещения коллоидных частиц. Коэффициент диффузии. Уравнение Эйнштейна – Смолуховского.
Как показали многочисленные исследования, коллоидные системы по своим молекулярно-кинетическим свойствам принципиально ничем не отличаются от обычных (истинных) растворов, только эти свойства у золей и растворов высокомолекулярных соединений выражены значительно (в сотни и тысячи раз) слабее. Все их молекулярно-кинетические свойства обусловлены броуновским движением.
Бр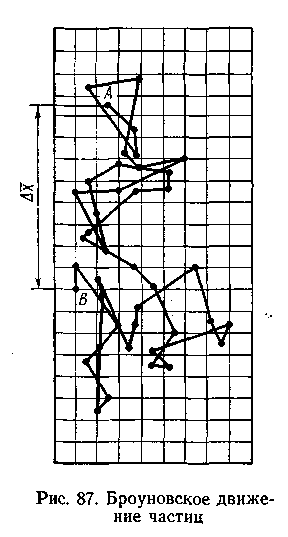 оуновское
движение. Частицы дисперсной фазы золя
под влиянием ударов молекул растворителя
находятся в состоянии непрерывного
хаотического движения. Так, если
рассматривать какой-либо золь в
ультрамикроскоп, можно заметить, что
частицы золя все время беспорядочно
движутся (рис.6.6).
Впервые это явление
было обнаружено английским ботаником
Р. Броуном (1827). Он рассматривал суспензию
растительной пыльцы в воде в микроскоп
и подробно описал беспорядочные
колебательные движения (в виде
своеобразного, никогда не прекращающегося
«танца»), совершаемые частицами
пыльцы.
Вначале Броун считал, что
эти движения присущи только живым
существам, но вскоре убедился, что они
свойственны любым суспензиям и эмульсиям
органических и неорганических веществ
при условии, что размер частиц достаточно
мал (в пределах от 1 до 5 мкм).
Опыты
показали, что броуновское движение
совершенно не зависит от природы
вещества; оно изменяется в зависимости
от температуры, вязкости среды и размеров
частиц.
оуновское
движение. Частицы дисперсной фазы золя
под влиянием ударов молекул растворителя
находятся в состоянии непрерывного
хаотического движения. Так, если
рассматривать какой-либо золь в
ультрамикроскоп, можно заметить, что
частицы золя все время беспорядочно
движутся (рис.6.6).
Впервые это явление
было обнаружено английским ботаником
Р. Броуном (1827). Он рассматривал суспензию
растительной пыльцы в воде в микроскоп
и подробно описал беспорядочные
колебательные движения (в виде
своеобразного, никогда не прекращающегося
«танца»), совершаемые частицами
пыльцы.
Вначале Броун считал, что
эти движения присущи только живым
существам, но вскоре убедился, что они
свойственны любым суспензиям и эмульсиям
органических и неорганических веществ
при условии, что размер частиц достаточно
мал (в пределах от 1 до 5 мкм).
Опыты
показали, что броуновское движение
совершенно не зависит от природы
вещества; оно изменяется в зависимости
от температуры, вязкости среды и размеров
частиц.
Коэффицие́нт диффу́зии — количественная характеристика скорости диффузии, равная количеству вещества (в массовых единицах), проходящего в единицу времени через участок единичной площади (например, 1 м²) при градиенте концентрации, равном единице (соответствующем изменению 1 моль/л → 0 моль/л на единицу длины). Коэффициент диффузии определяется свойствами среды и типом диффундирующих частиц.
Зависимость коэффициента диффузии от температуры в простейшем случае выражается законом Аррениуса:
![]()
 — коэффициент
диффузии [м²/с];
— коэффициент
диффузии [м²/с];
![]() — энергия
активации
[Дж];
— энергия
активации
[Дж];
![]() — универсальная
газовая постоянная
[Дж/К];
— универсальная
газовая постоянная
[Дж/К];
![]() — температура [K].
— температура [K].
ЭЙНШТЕЙНА - СМОЛУХОВСКОГО УРАВНЕНИЕ
- интегральное уравнение для плотности вероятности функции перехода .(t0, x0(t, х ))из положения x0 в момент времени t0 в точку . к моменту t:

