
- •26. Метод Фаянса. Прямая аргентометрия.
- •27. Комплексонометрия
- •33. Полярография — один из важнейших электрохимических методов анализа веществ, исследования кинетики химических процессов. Принцип метода[править]
- •39. Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении. Диссоциация в растворах[править]
- •Диссоциация при плавлении[править]
- •Классическая теория электролитической диссоциации[править]
- •40. Гидролиз солей.
- •2. Пишем ионное уравнение гидролиза, определяем среду
- •41. Методические находки
- •Водородный показатель (рН)
- •Окисление [править]
- •Восстановление [править]
- •Закон действующих масс в химической кинетике [править]
- •Закон действующих масс в химической термодинамике [править]
- •45. Плоскостная хроматография
- •Принцип ионообменной хроматографии[править]
- •48. Метод Кольтгофа
- •Цели количественного анализа[править]
- •Методы количественного анализа[править]
Окисление [править]
Окисление — процесс отдачи электронов, с увеличением степени окисления.
При окисле́нии вещества в результате отдачи электронов увеличивается его степень окисления. Атомы окисляемого вещества называются донорами электронов, а атомы окислителя —акцепторами электронов.
В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части (см. Свободные радикалы). При этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле.
Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель:
окислитель + e− ↔ сопряжённый восстановитель.
Восстановление [править]
Восстановле́нием называется процесс присоединения электронов атомом вещества, при этом его степень окисления понижается.
При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента. Примеры: восстановление оксидов металлов до свободных металлов при помощи водорода, углерода, других веществ; восстановление органических кислот в альдегиды и спирты; гидрогенизация жиров и др.
Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряжённый окислитель:
восстановитель — e− ↔ сопряжённый окислитель.
Несвязанный, свободный электрон является сильнейшим восстановителем.
43. Зако́н де́йствующих масс устанавливает соотношение между массами реагирующих веществ в химических реакциях при равновесии, а также зависимость скорости химической реакции от концентрации исходных веществ.
Закон действующих масс в химической кинетике [править]
Закон действующих масс в кинетической форме (основное уравнение кинетики) гласит, что скорость элементарной химической реакции пропорциональна произведению концентраций реагентов в степенях, равных стехиометрическим коэффициентам в уравнении реакции[1]. Это положение сформулировано в 1867 году норвежскими учёными К. Гульдбергом и П. Вааге. Для элементарной химической реакции:
![]()
закон действующих масс может быть записан в виде кинетического уравнения вида:
![]()
где ![]() — скорость
химической реакции,
— скорость
химической реакции, ![]() — константа
скорости реакции.
— константа
скорости реакции.
Для сложных реакций в общем виде это соотношение не выполняется. Тем не менее, многие сложные реакции условно можно рассматривать как ряд последовательных элементарных стадий с неустойчивыми промежуточными продуктами, формально эквивалентный переходу из начального состояния в конечное в «один шаг». Такие реакции называют формально простыми[2]. Для формально простых реакций кинетическое уравнение может быть получено в виде:
![]()
(для
трех исходных веществ, аналогично
приведённому выше уравнению).
Здесь ![]() ,
, ![]() ,
, ![]() — порядок
реакции по
веществам
— порядок
реакции по
веществам ![]() ,
, ![]() ,
, ![]() соответственно,
а сумма
соответственно,
а сумма ![]() —
общий (или суммарный) порядок
реакции.
,
,
могут
быть не равны стехиометрическим
коэффициентам и не обязательно
целочисленные.
—
общий (или суммарный) порядок
реакции.
,
,
могут
быть не равны стехиометрическим
коэффициентам и не обязательно
целочисленные. ![]() при
определённых условиях может быть равно
и нулю.
при
определённых условиях может быть равно
и нулю.
Закон действующих масс в химической термодинамике [править]
В химической термодинамике закон действующих масс связывает между собой равновесные активности исходных веществ и продуктов реакции, согласно соотношению:
![]()
где
![]() — активность веществ.
Вместо активности могут быть
использованы концентрация (для
реакции в идеальном растворе), парциальные
давления (реакция
в смеси идеальных газов), фугитивность
(реакция в смеси реальных газов);
— активность веществ.
Вместо активности могут быть
использованы концентрация (для
реакции в идеальном растворе), парциальные
давления (реакция
в смеси идеальных газов), фугитивность
(реакция в смеси реальных газов);
![]() — стехиометрический
коэффициент (для
исходных веществ принимается отрицательным,
для продуктов — положительным);
— стехиометрический
коэффициент (для
исходных веществ принимается отрицательным,
для продуктов — положительным);
![]() —
константа химического
равновесия.
Индекс «a» здесь означает использование
величины активности в
формуле.
—
константа химического
равновесия.
Индекс «a» здесь означает использование
величины активности в
формуле.
На
практике в расчётах, не требующих особой
точности, значения активности обычно
заменяются на соответствующие значения
концентраций (для реакций в растворах)
либо парциальных давлений (для реакций
между газами). Константу равновесия при
этом обозначают ![]() или
или ![]() соответственно.
Впервые закон действующих масс был
выведен из кинетических представлений
Гульдбергом и Вааге, а термодинамический
вывод его дан Вант-Гоффом в
1885 году[3].
соответственно.
Впервые закон действующих масс был
выведен из кинетических представлений
Гульдбергом и Вааге, а термодинамический
вывод его дан Вант-Гоффом в
1885 году[3].
Пример: для стандартной реакции
![]()
константа химического равновесия определяется по формуле
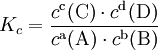
44. Буферные растворы (англ. buffer, от buff — смягчать удар) — растворы с определённой устойчивой концентрацией водородных ионов; смесь слабой кислоты и её соли (напр., СН3СООН и CH3COONa) или слабого основания и его соли (напр., NH3 и NH4CI). Величина рН буферного раствора мало изменяется при добавлении небольших количеств свободной сильной кислоты или щёлочи, при разбавлении или концентрировании. Буферные растворы широко используют в различных химических исследованиях.
Буферные растворы имеют большое значение для протекания процессов в живых организмах. Например, в крови постоянство водородного показателя рН поддерживается буферными смесями, состоящими из карбонатов и фосфатов. Известно большое число буферных растворов (ацетатно-аммиачный буферный раствор, фосфатный буферный раствор, боратный буферный раствор, формиатный буферный раствор и др.).
Значение
pH буферного раствора можно рассчитать
по формуле: ![]() ,
где
,
где ![]() это
отрицательный десятичный логарифм от
константы диссоциации кислоты
это
отрицательный десятичный логарифм от
константы диссоциации кислоты ![]() .
.
По
сути ![]() .
.
