
- •26. Метод Фаянса. Прямая аргентометрия.
- •27. Комплексонометрия
- •33. Полярография — один из важнейших электрохимических методов анализа веществ, исследования кинетики химических процессов. Принцип метода[править]
- •39. Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении. Диссоциация в растворах[править]
- •Диссоциация при плавлении[править]
- •Классическая теория электролитической диссоциации[править]
- •40. Гидролиз солей.
- •2. Пишем ионное уравнение гидролиза, определяем среду
- •41. Методические находки
- •Водородный показатель (рН)
- •Окисление [править]
- •Восстановление [править]
- •Закон действующих масс в химической кинетике [править]
- •Закон действующих масс в химической термодинамике [править]
- •45. Плоскостная хроматография
- •Принцип ионообменной хроматографии[править]
- •48. Метод Кольтгофа
- •Цели количественного анализа[править]
- •Методы количественного анализа[править]
26. Метод Фаянса. Прямая аргентометрия.
Титрант – AgNO3, индикаторы – эозинат натрия (Br–,I–), бромтимоловый синий (Cl–), среда – CH3COOH (30%).
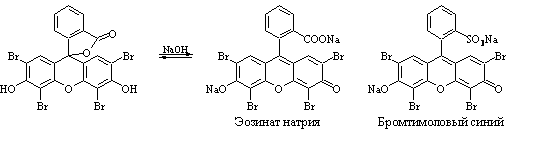
NaI + AgNO3 → AgI↓ + NaNO3.
Йодид серебра адсорбирует на себе одноименные ионы; появляется ярко-розовая окраска:
{m(AgI)∙nI–(n–x)K+}x–
В точке эквивалентности коллоидная частица становится электронейтральной, в КТТ начинает адсорбировать Ag+; идет перезарядка мицеллы, осадок коагулирует, раствор просветляется:
{m(AgI)∙nI–(n–x)K+}x–∙xAg+,
{m(AgI)∙nI–(n–x)K+}x–∙xAg+ + Ind2– → (x/2)Ag2Ind + {m(AgI)∙nI–(n–x)K+}x–.
fэкв(NaI)=1, ![]()
27. Комплексонометрия
Комплексонометрия, хелатометрия, трилонометрия, метод титриметрического анализа, основанный на образовании хорошо растворимых в воде и слабо диссоциированных комплексных соединений при реакции большинства катионов с аминополикарбоновыми кислотами (комплексонами). Конечную точку титрования устанавливают с помощью комплексонометрических и др. индикаторов (см. Индикаторы химические). В некоторых случаях, особенно при титровании мутных или сильно окрашенных растворов, используют безиндикаторные (инструментальные) методы — потенциометрию, кулонометрию, кондуктометрию (см. Электрохимические методы анализа), фотометрический анализ и др. К. применяют для определения содержания металлов в минеральном сырье, продуктах металлургического производства, фармацевтических препаратах, определения жёсткости воды и др.
28. ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
основаны на зависимости физ. св-в в-ва от его природы, причем ана-лит. сигнал представляет собой величину физ. св-ва, функционально связанную с концентрацией или массой определяемого компонента. Ф.-х. м. а. могут включать хим. превращения определяемого соед., растворение образца,концентрирование анализируемого компонента, маскирование мешающих в-в и др. В отличие от "классич." химических методов анализа, где аналит. сигналом служит масса в-ва или его объем, в Ф.-х. м. а. в качестве аналит. сигнала используют интенсивность излучения, силу тока, электропроводность, разность потенциалов и др.
Важное практич. значение имеют методы, основанные на исследовании испускания и поглощения электромагн. излучения в разл. областях спектра. К ним относится спектроскопия (напр., люминесцентный анализ, спектральный анализ}, нефелометрия и турбидиметрия и др. К важным Ф.-х. м. а. принадлежат электрохим. методы, использующие измерение электрич. св-в в-ва ( вольтамперометрия, кондуктометрия, кулонометрия,потенциометрия и т. д.), а также хроматогра-фия (напр., газовая хроматография, жидкостная хроматог-рафия, ионообменная хроматография, тонкослойная хроматография). Успешно развиваются методы, основанные на измерении скоростей хим. р-ций ( кинетические методы анализа),тепловых эффектов р-ций (термометрич. титрование, см. Калориметрия), а также на разделении ионов в магн. поле (масс-спектрометрия).
При выполнении Ф.-х. м. а. используют специальную, иногда довольно сложную, измерит. аппаратуру, в связи с чем эти методы часто наз. инструментальными. Многие совр. приборы оснащены встроенными ЭВМ, к-рые позволяют находить оптим. условия анализа (напр., спектральную область получения наиб. точных результатов при анализе смеси окрашенных в-в), выполняют расчеты и т. д.
Почти во всех Ф.-х. м. а. применяют два основных приема: методы прямых измерений и титрования. В прямых методах используют зависимость аналит. сигнала от природы анализируемого в-ва и его концентрации. Зависимость сигнала от природы в-ва - основа качеств. анализа (потенциал полуволны в полярографии и т. д.). В нек-рых методах связь аналит. сигнала с природой в-ва установлена строго теоретически. Напр., спектр атома водорода м. б. рассчитан по теоретически выведенным ф-лам. В количеств. анализе используют зависимость интенсивности сигнала от концентрации в-ва. Чаще всего она имеет вид I = a + bс (ур-ние связи), где I- интенсивность сигнала (сила диффузионного тока в полярографии, оптич. плотность в спектрофотометрии и т. д.), с - концентрация, аи b - постоянные, причем во мн. случаях а = 0 (спектрофотометрия, полярография и др.). В ряде Ф.-х. м. а. ур-ние связи установлено теоретически, напр. закон Бугера-Ламберта-Бера ( фотометрический анализ), ур-ние Ильковича (вольтамперометрия).
Численные значения констант в ур-нии связи определяют экспериментально с помощью стандартных образцов, стандартных р-ров и т. д. Только в кулонометрии, основанной на законе Фарадея, не требуется определение констант.
Наиб. распространение в практике получили след. методы определения констант ур-ния связи или, что то же самое, методы количеств, анализа с помощью физ.-хим. измерений:
1) Метод градуировочного графика. Измеряют интенсивность аналит. сигнала у неск. стандартных образцов или стандартных р-ров и строят градуировочный график в координатах I= f(с) или I= f(lgc), где с - концентрация компонента в стандартном р-ре или стандартном образце. В тех же условиях измеряют интенсивность сигнала у анализируемой пробы и по градуировочному графику находят концентрацию.
2) Метод молярного св-ва применяют в тех случаях, когда ур-ние связи I = bc соблюдается достаточно строго. Измеряют аналит. сигнал у неск. стандартных образцов или р-ров и рассчитывают b= I ст /с ст; если с ст измеряется в моль/л, то b - молярное св-во. В тех же условиях измеряют интенсивность сигнала у анализируемой пробы x и по соотношению <cx</c= x /b> или <cx = c></c стx /I> СТ рассчитывают концентрацию.
3) Метод добавок. Измеряют интенсивность аналит. сигнала пробы x,> а затем интенсивность сигнала пробы с известной добавкой стандартного р-ра x+ стt. Концентрацию в-ва в пробе рассчитывают по соотношению с x= с стx/(Ix+ ст< - Ix)>.
Методы титрования. Измеряют интенсивность аналит. сигнала I в зависимости от объема Vдобавленного титранта. По кривой титрования I=f (V )находят точку эквивалентности и рассчитывают результат по обычным ф-лам титриметрич. анализа (см. Титриметрия).
Ф.-х. м. а. часто используют при определении низких содержаний (порядка 10-3% и менее), где-классич. хим. методы анализа обычно неприменимы. В области средних и высоких концентраций хим. и Ф.-х. м. а. успешно конкурируют между собой, взаимно дополняя друг друга. Ф.-х. м. а. развиваются в направлении поиска новых хим.-аналит. св-в в-ва, увеличения точности анализа, конструирования новых прецизионных аналит. приборов, совершенствования существующих методик и автоматизации анализа. Интенсивно развивается в последнее время проточно-ижкекционный анализ - один из наиб. универсальных вариантов автоматизир. анализа, основанный на дискретном введении микрообъемов анализируемого р-ра в поток жидкого носителя с реагентом и последующего детектирования смеси тем или иным физ.-хим. методом.
Деление аналит. методов на физ., хим. и физ.-хим. весьма условно. Часто к Ф.-х. м. а. относят, напр., ядерно-физ. методы. В последнее время наметилась тенденция делить методы анализа на хим., физ. и биол.- вовсе без физ.-химических.
29. Оптические методы исследования
основаны на использовании законов оптики, касающихся природы, распространения и взаимодействия с веществом электромагнитного излучения оптического диапазона (видимый свет, ультрафиолетовое и инфракрасное излучение).
Законы геометрической оптики, характеризующие прямолинейное распространение света в однородных средах, его отражение и преломление в гетерогенных средах, лежат в основе расчета, конструирования и эксплуатации таких широко используемых в медицине приборов, как микроскопы, рефрактометры, медицинские осветители, аппараты для светолечения, эндоскопы, лазерные установки и др.
Для качественного и количественного определения химических элементов в биологических жидкостях и тканях, в лекарственных препаратах и других объектах служит спектрально-эмиссионный анализ. Он заключается в изучении спектра света, который испускают атомы и молекулы, возбужденные различными способами, например нагреванием до высоких температур. Разновидностью эмиссионного анализа является метод пламенной фотометрии, позволяющий определять содержание в биологических образцах ионов калия, натрия, лития и др.
Действие большой группы оптических приборов основано на оптических законах взаимодействия света с веществом. Для измерения рефракции или показателя преломления света исследуемых образцов используют рефрактометры. Их применяют при определении чистоты дистиллированной воды, содержания сахарозы в водных растворах, общего белка в сыворотке крови и пр.
Для измерения поглощения света веществом с целью анализа состава и структуры образца широко применяют фотометрические и спектрофотометрические методы (колориметрию, фотометрию, спектрофотометрию). Приборы, служащие для этой цели, получили название колориметров, фотометров, спектрофотометров. Спектрофотометры позволяют изучать характерные спектры поглощения различных веществ и устанавливать их химическое строение и количественное содержание в растворах, например ферментов, гормонов, витаминов, нуклеиновых кислот, углеводов, спиртов, липидов и др.
Величина рассеяния света исследуемыми объектами, например коллоидными растворами, определяется методом нефелометрии и турбидиметрии. О содержании вещества судят по интенсивности светового потока, который рассеивается взвешенными частицами определяемого вещества (нефелометрия), или по поглощению светового потока этими частицами (турбидиметрия).
Для измерения концентрации и изучения свойств оптически активных молекул применяют поляриметры и спектрополяриметры. В медицине они находят наибольшее практическое применение при определении концентрации сахара в моче (сахарометрия).
Поглощение света веществом нередко сопровождается возникновением вторичного излучения с меньшей длиной волны (см. Люминесценция). Приборы, служащие для изучения люминесценции, получили название флюориметров, спектрофлюориметров, микроцитоспектрофлюориметров. Они используются для структурного анализа биологически активных молекул, определения количественного содержания в образце витаминов, ферментов, промежуточных продуктов обмена, стероидов.
Совокупность оптических методов, используемых для изучения процесса восприятия света глазом человека, традиционно выделяется в самостоятельный раздел оптики — физиологическую оптику. Они служат для исследования остроты зрения, абсолютной чувствительности, критической частоты слияния световых мельканий и др. В этих методах используют такие оптические приборы, как офтальмоскопы, офтальмометры, глазные рефрактометры, адаптометры и т.д.
30. Колориметрия (от лат. color — цвет и греч. μετρώ — измеряю) — физический метод химического анализа, основанный на определении концентрации вещества по интенсивности окраски растворов (более точно — по поглощению света растворами).
Колориметрия — это метод количественного определения содержания веществ в растворах, либо визуально, либо с помощью приборов, таких какколориметры.
Колориметрия может быть использована для количественного определения всех тех веществ, которые дают окрашенные растворы, или могут быть, с помощью химической реакции, дать окрашенное растворимое соединение. Колориметрические методы основываются на сравнении интенсивности окраскиисследуемого раствора, изучаемого в пропущенном свете, с окраской эталонного раствора, содержащего строго определенное количество этого же окрашенного вещества, или же с дистиллированной водой.
Любопытна история возникновения колориметрии и фотометрии. Ю. А. Золотов упоминает, что Роберт Бойль (так же, как и некоторые ученые до него) использовал экстракт дубильных орешков, чтобы различить железо и медь в растворе. Однако, по-видимому, именно Бойль впервые заметил, что чем больше железа содержится в растворе, тем более интенсивна окраска последнего. Это был первый шаг к колориметрии. А первым инструментом колориметрии стали колориметры типа колориметра Дюбоска (1870)[1], которые использовались вплоть до недавнего времени[2].
Более совершенные приборы — спектрофотометры — отличаются возможностью исследования оптической плотности в широком диапазоне длин волнвидимого спектра, а также в ИК и УФ-диапазонах, с меньшей дискретностью длины волны (с использованием монохроматора).
Фотоколориметры и спектрофотометры измеряют величину пропускания света при определенной длине волны света. Контроль (обычно дистиллированная вода или исходный материал без добавления реагентов) используется для калибровки устройства.
Колориметрия широко применяется в аналитической химии, в том числе для гидрохимического анализа, в частности — для количественного анализа содержания биогенных веществ в природных водах[3], для измерения pH[4], в медицине, а также в промышленности при контроле качества продукции.
32. Потенциометрия
(от лат. potentia - сила, мощность и греч. metreo - измеряю * a. potentiometry; н. Potentiometrie; ф. Potentiometrie; и. potenciometria) - электрохим.метод исследования и анализа веществ, основанный на измерении электродвижущих сил (эдс) обратимых гальванич. элементов. П. используется для изучения кинетики и определения констант устойчивости комплексных соединений, констант диссоциации слабых кислот и оснований, а также произведения растворимости малорастворимых электролитов. П. включает редоксметрию и ионометрию. Гальванич. элемент, применяемый в П., обычно состоит из 2 электродов, к-рые помещают или в один и тот же раствор (элемент без переноса), или в 2 различных по составу раствора, имеющих между собой жидкостный контакт (элемент с переносом). Элементы без переноса используют для определения изменений термодинамич. потенциалов, энтропий, энтальпий и др. величин при разл. процессах. Электрод, по потенциалу к-рого судят о концентрации определяемых ионов в растворе, наз. индикаторным. Величину потенциала индикаторного электрода определяют, сравнивая её с величиной потенциала др. электрода, к-рый принято называть электродом сравнения. В качестве электрода сравнения может быть применён только такой электрод, величина потенциала к-рого остаётся неизменной при изменении концентрации определяемых ионов. Различают прямую П. и потенциометрич. титрование (ПТ). Первая используется для непосредственного определения концентрации веществ по значению потенциала индикаторного электрода (рН-метрия, ионометрия). При ПТ в исследуемый раствор, помещённый в потенциометрич. ячейку, опускают индикаторный электрод, возникновение потенциала на к-ром обусловливается или непосредственно определяемым веществом (если оно электроактивно), или косвенно (если оно неэлектроактивно) в результате его хим. взаимодействия с др. потенциалопределяющим компонентом. Конечную точку титрования (КТТ) определяют по скачку потенциала, вызванного заменой одной электрохим. реакции другой до и после КТТ с соответствующим изменением величины потенциала. Этот вариант метода называют ПТ без тока. КТТ удобно определять графически по кривой титрования (рис.).
При работе с необратимыми редокс-системами или компонентами обратимых редокс-систем (в отсутствие сопряжённых форм) потенциал индикаторного электрода устанавливается медленно, он неустойчив. В таких случаях применяют ПТ под током, к-рое заключается в том, что индикаторный электрод поляризуется, т.е. через него с помощью внеш. источника тока пропускают ток малой величины (неск. микроампер). В этом методе можно использовать 2 идентичных индикаторных электрода, погруженных в титруемый раствор, один из к-рых поляризуют анодно, а другой - катодно. При этом отпадает необходимость в электроде сравнения, а измеренная эдс соответствует разности потенциалов между 2 электродами. Ход титрования описывается дифференциальной кривой. В ПТ применяют реакции нейтрализации, окисления- восстановления, комплексообразования, осаждения. При использовании техники ультрамикроанализа с помощью ПТ можно определять - n * 10-10 веществ, напр., до 0,4 нг Сu2+ с относительным стандартным отклонением 4-9%. Достоинства ПТ: низкие границы определяемых концентраций, объективность и точность установления КТТ, селективность, возможность титрования в окрашенных и мутных средах, последовательное титрование неск. компонентов, простота автоматизации. П. широко применяется для анализа пром. и природных материалов, напр. руд, минералов, т.п., а также объектов окружающей среды. П. используется также в автоматизир. системах аналитич. контроля технол. потоков на обогатит. ф-ках и гидрометаллургич. з-дах.
