
- •2.Электронное и пространственное строение органических вещест
- •2. Адсорбция. Применение в медицине.
- •1.Теория а. М. Бутлерова.
- •2. Углеводы. Применение в медицине
- •2. Аминокислоты. (Строение, состав, получение, применение в медицине).
- •1.Окислительно-востановительные реакции. Применение в медицине.
- •2. Альдегиды и кетоны. (Строение, состав, получение, применение в медицине).
- •15 Билет
- •2. Белки. Применение в медицине.
- •16 Билет
- •1.Липиды. Применение а медицине.
- •17 Билет
- •18 Билет
- •1 Растворы. Применение в медицине.
- •19 Билет
- •20 Билет
- •1 Энтальпия. Применение в медицине.
- •20 Билет
- •1.Тэд. Степень диссоциации
- •21 Билет
- •1 Закон Гесса. Применение в медицине.
- •22Билет
- •23 Билет
- •24 Билет
- •2Факторы, влияющие на смещение равновесия
- •2. Кислоты
- •2. Нуклеиновые кислоты. Применение в медицине.
21 Билет
1 Закон Гесса. Применение в медицине.
Закон Гесса — основной закон термохимии, который формулируется следующим образом: Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания. Иными словами, количество теплоты, выделяющееся или поглощающееся при каком-либо процессе, всегда одно и то же, независимо от того, протекает ли данное химическое превращение в одну или в несколько стадий (при условии, что температура, давление и агрегатные состояния веществ одинаковы). Например, окисление глюкозы в организме осуществляется по очень сложному многостадийному механизму, однако суммарный тепловой эффект всех стадий данного процесса равен теплоте сгорания глюкозы. Согласно закону Гесса, тепловые эффекты всех этих реакций связаны следующим соотношением: ΔH1 = ΔH2 + ΔH3 = ΔH4 + ΔH5 + ΔH6. Закон открыт русским химиком Г.И. Гессом в 1840 г.; он является частным случаем первого начала термодинамики применительно к химическим реакциям. Практическое значение закона Гесса состоит в том, что он позволяет рассчитывать тепловые эффекты самых разнообразных химических процессов; для этого обычно используют ряд следствий из него.
2.Карбоновые кислоты (Строение, состав, получение, применение в медицине).
Карбоновые
кислоты – органические соединения,
содержащие одну или несколько
карбоксильных групп -СООН.Карбоксильная
группа содержит две функциональные
группы – карбонил >С=О и гидроксил
-OH, непосредственно связанные друг с
другом:
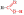 .
Карбоксильная
группа содержит высокополяризованную
карбонильную группу. Атом углерода
карбонильной группы, имеющий частичный
положительный заряд, оттягивает на
себя электроны связи С – О. Неподеленная
пара электронов атома кислорода
гидроксильной группы взаимодействует
с электронами
.
Карбоксильная
группа содержит высокополяризованную
карбонильную группу. Атом углерода
карбонильной группы, имеющий частичный
положительный заряд, оттягивает на
себя электроны связи С – О. Неподеленная
пара электронов атома кислорода
гидроксильной группы взаимодействует
с электронами
 –
связи карбонильной группы. Это приводит
к большему оттягиванию электронов от
атома водорода гидроксильной группы
увеличению полярности связи О – Н по
сравнению со спиртами, а также уменьшению
положительного заряда на атоме углерода
карбонильной группы кислот по сравнению
с альдегидами. В отличие от спиртов,
кислоты диссоциируют с образованием
ионов водорода Н+.
К общим способам получения предельных
монокарбоновых кислот относят: 1.
Окисление первичных спиртов, альдегидов,
алканов по действиям различных
окислителей. 2. В лаборатории карбоновые
кислоты можно получить из солей, действуя
на них серной кислотой при нагревании.
В
медицине используют салициловую кислоту
и
n-аминосалициловую
кислоту.
Издавна
люди использовали муравьиную кислоту
как средство для лечения ревматизма.
–
связи карбонильной группы. Это приводит
к большему оттягиванию электронов от
атома водорода гидроксильной группы
увеличению полярности связи О – Н по
сравнению со спиртами, а также уменьшению
положительного заряда на атоме углерода
карбонильной группы кислот по сравнению
с альдегидами. В отличие от спиртов,
кислоты диссоциируют с образованием
ионов водорода Н+.
К общим способам получения предельных
монокарбоновых кислот относят: 1.
Окисление первичных спиртов, альдегидов,
алканов по действиям различных
окислителей. 2. В лаборатории карбоновые
кислоты можно получить из солей, действуя
на них серной кислотой при нагревании.
В
медицине используют салициловую кислоту
и
n-аминосалициловую
кислоту.
Издавна
люди использовали муравьиную кислоту
как средство для лечения ревматизма.
22Билет
1 . Реакции состояния систем.
химическое равновесие – равновесие в обратимой реакции когда 2 противоположных реакции развиваются с постоянными и равными скоростями, и в системе не происходят окончательные изменения.
2 Биополиме́ры — класс полимеров, встречающихся в природе в естественном виде, входящие в состав живых организмов: белки, нуклеиновые кислоты, полисахариды. Биополимеры состоят из одинаковых (или разных) звеньев — мономеров. Мономеры белков — аминокислоты, нуклеиновых кислот — нуклеотиды, в полисахаридах — моносахариды. Выделяют два типа биополимеров — регулярные (некоторые полисахариды) и нерегулярные (белки, нуклеиновые кислоты, некоторые полисахариды). Белки имеют несколько уровней организации — первичная, вторичная, третичная, и иногда четвертичная. Первичная структура определяется последовательностью мономеров, вторичная задаётся внутри- и межмолекулярными взаимодействиями между мономерами, обычно при помощи водородных связей. Третичная структура зависит от взаимодействия вторичных структур, четвертичная, как правило, образуется при объединении нескольких молекул с третичной структурой.
Вторичная структура белков образуется при взаимодействии аминокислот с помощью водородных связей и гидрофобных взаимодействий. Основными типами вторичной структуры являются.
