
- •Глава 1. Cтехиометрия и материальные расчеты химической реакции
- •Примеры решения задач
- •1.2. Задачи для самостоятельного решения
- •1.2.1. Материальные расчеты по молям
- •1.2.2. Материальные расчеты по мольному потоку
- •1.2.3. Простые и сложные реакции
- •1.2.4. Задачи с изменением объема
- •Глава 2. Термодинамика химических реакций
- •2.1. Примеры решения задач
- •2C3h6↔н-c6h12↔ транс-c6h12
- •2.2. Задачи для самостоятельного решения
- •2.2.1. Расчет теплоты химической реакции
- •2.2.2. Расчет константы равновесия в случае простой реакции
- •2.2.3. Расчет константы равновесия при параллельно протекающих реакциях
- •2, 2, 3, 3-Тетраметилбутан
- •II) 2с3н6↔с6н12 (1-гексен)
- •II) 2с3н6↔с6н12 (1-гексен)
- •II) 2с3н6↔с6н12 (1-гексен)
- •2.2.4. Расчет константы равновесия при последовательно протекающих реакциях
- •2С3н6↔ н-с6н12 ↔с6н12 (транс-2-гексен)
- •2.2.5. Расчет константы равновесия в неидеальных газовых системах
- •Глава 3. Кинетика
- •3. 1. Примеры решения задач
- •3. 2. Задачи для самостоятельного решения
- •3. Разложение паров пропионового альдегида при нагревании в кварцевом сосуде протекает как гомогенная реакция первого порядка по уравнению
- •Глава 4. Реактора
- •4.1. Удельная производительность при расчете реакторов
- •1) Начальные концентрации или парциальные давления компонентов;
- •2) Мольные соотношения реагентов рив;
- •3) Мольные соотношения реагентов рис;
- •1 Реактор:
- •2 Реактор:
- •4.2. Селективность и основы выбора реакционного узла с точки зрения селективности реакций разных типов
- •4.3. Расчет селективности в случае параллельно протекающих реакций
- •4.4. Влияние условий процесса на селективность
- •Целевая реакция имеет более высокий порядок(рис)
- •Целевая реакция имеет более высокий порядок(рив)
- •Случай с последовательными реакциями
- •4.5. Задчи для самостоятельного решения
- •4.5.1. Расчет производительности реакторов
- •4.5.2. Расчет селективности реакторов
- •4.5.3. Характеристическое уравнение реакторов
Глава 2. Термодинамика химических реакций
2.1. Примеры решения задач
Пример 1. Определить стандартную теплоту реакции дегидрирования этана до метана, ацетилена и H2 в газовой фазе при стандартных условиях и при том же давлении и температуре 125 ОС (398 К);
1) Исходя из теплот сгорания веществ участвующих в реакции;
2) Исходя из теплот их образования.
Вещество |
C2H6, ккал/моль |
CH4, ккал/моль |
C2H2, ккал/моль |
H2, ккал/моль |
Δ |
372,82 |
212,8 |
310,62 |
68,310 |
Δ |
-20,236 |
-17,889 |
54,194 |
- |
Решение.
Δ =
= .
.
Δ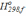 =
= .
.
2C2H6→2CH4+C2H2+H2
Δ .
.
Δ 54,194+(−17,889∙2)−(−2∙20,236)
= 58,89.
54,194+(−17,889∙2)−(−2∙20,236)
= 58,89.
Δ Δ
Δ +
+ .
.
|
C2H6 |
CH4 |
C2H2 |
H2 |
a |
1,074 |
4,171 |
5,607 |
6,95 |
b∙103 |
43,561 |
14,45 |
20,499 |
-0,20 |
c∙106 |
-17,891 |
0,267 |
-13,944 |
0,48 |
Δ =
58,89 ккал/моль = 58,89∙103
кал/моль.
=
58,89 ккал/моль = 58,89∙103
кал/моль.
Δ =
а+bT+cT2.
=
а+bT+cT2.




Допустим, что 1 Дж = 1 кал.
Δ =
58,89∙103+
=
58,89∙103+ 18,751−37,923∙10-3∙398+22,852∙10-6∙3982)dT
=
18,751−37,923∙10-3∙398+22,852∙10-6∙3982)dT
=
58,89∙103
+18,751(398−298)−37,923∙10-3∙ +22,852∙10-6∙
+22,852∙10-6∙ =
60,962 ккал/моль.
=
60,962 ккал/моль.
Δа = =
(2∙4,171+5,607+6,95)−(2∙1,074) = 18,751,
=
(2∙4,171+5,607+6,95)−(2∙1,074) = 18,751,
Δb
= =
(2∙1445+20,499−0,20)−(2∙43,561) = −37,923∙10-3,
=
(2∙1445+20,499−0,20)−(2∙43,561) = −37,923∙10-3,
Δс =
 = (0,267∙2−13,944+0,48)−(−17,891)∙2 = 22,852∙10-6.
= (0,267∙2−13,944+0,48)−(−17,891)∙2 = 22,852∙10-6.
Пример 2. Вычислить
теплоемкость CH4
при 25 ОС,
если при той же температуре и давлений
1 атм
 =
8,536 кал/К∙моль, считать что:
=
8,536 кал/К∙моль, считать что:
1) CH4− идеальный газ;
2) CH4− реальный газ.
Решение.
Формула Майера:
 .
.
где 8,31
8,31
 =
1,987 кал/К∙моль.
=
1,987 кал/К∙моль.
1 кал = 4,1868 Дж; 1 Дж = 0,2388 кал.
Формула для нахождения теплоемкости идеального газа:
 R
= 8,536−1,987 =
6,549 кал/К∙моль.
R
= 8,536−1,987 =
6,549 кал/К∙моль.
где R работа
расширения системы при изменении Т
на 1 ОС
производимой в результате подвода
дополнительного тепла.
работа
расширения системы при изменении Т
на 1 ОС
производимой в результате подвода
дополнительного тепла.
Формула для нахождения теплоемкости реального газа:
 .
.
где a = 0,00449 см6∙атм/моль; 1 см6∙1 атм = 0,0242 кал; 2а = 0,000217.
 =
6,5489 кал/К∙моль.
=
6,5489 кал/К∙моль.
CH4, при этих условиях в состоянии реального газа ведет себя как идеальный газ.
Пример 3. Для
газообразного
1,3-бутадиена теплоемкость
в интервале температур от 298 до 1500 К
задано уравнение:
теплоемкость
в интервале температур от 298 до 1500 К
задано уравнение:
 0,707+81,282∙10−3T−53,463∙10-6T2
кал/К∙моль.
0,707+81,282∙10−3T−53,463∙10-6T2
кал/К∙моль.
Определить среднюю теплоемкость в интервале температур от 400 до 500 К.
Решение.
Для решения используем формулу:
 ,
,
когда нагревание либо охлаждение системы не сопровождается фазовыми переходами.
 .
.

 =
= ∙(0,707∙100+81,282∙10-3∙
∙(0,707∙100+81,282∙10-3∙ −53,463∙10-6∙
−53,463∙10-6∙ )
= 4,5928 кал/К∙моль.
)
= 4,5928 кал/К∙моль.
Пример 4. Возможна ли реакция дегидроциклизации нормального октана в параксилол при 800 К, если известны следующие термодинамические параметры:
пар-р |
C8H18 |
параксилол |
H2 |
Δ |
Δ
, |
-49,82 |
4,290 |
0 |
5 |
Δ |
111,55 |
84,23 |
31,211 |
97,524 |
a |
1,651 |
-6,196 |
6,95 |
19,953 |
b∙103 |
177,317 |
145,716 |
-0,2 |
-32,401 |
c∙106 |
-94,95 |
-83,786 |
0,48 |
13,084 |
вычисленные
значения
При Т
= 800 К известны: Мо=0,9537,
М1∙10-3=0,1574,
М2∙10-6=0,0733.
Найти Δ .
.
Решение.



Δа
= =(−6,196+6,95∙4)−1,651
= 19,953;
=(−6,196+6,95∙4)−1,651
= 19,953;
Δb
=
 =
145,716+(4∙(−0,2)) −177,317 = −32,401∙10−3;
=
145,716+(4∙(−0,2)) −177,317 = −32,401∙10−3;
Δс = =
−83,786+4∙0,48−(−94,95) = 13,084∙10−6.
=
−83,786+4∙0,48−(−94,95) = 13,084∙10−6.
Δ =
4,290+49,82 = 54,110.
=
4,290+49,82 = 54,110.
Δ = 4∙31,211+84,23−111,55 = 97,524 кал/моль∙К.
 =
= −97,524−19,953∙0,9537−(−32,401∙10−3)
∙0,1574∙103
−13,084∙10−6
∙ 0,0733∙106
=
−26,33ккал/моль;
−97,524−19,953∙0,9537−(−32,401∙10−3)
∙0,1574∙103
−13,084∙10−6
∙ 0,0733∙106
=
−26,33ккал/моль;
= =
−26,33ккал/моль.
=
−26,33ккал/моль.
Пример 5. Пользуясь справочными данными найти зависимость мольной теплоты испарения жидкого этанола от температуры в интервале от 283 до 348 К при P=1 атм. В качестве нижнего предела интегрирования принять 0 К.
|
С2H6(жид) |
С2H6(газ) |
Δ |
−66,356 |
66,356 |
a |
25,46 |
4,946 |
b∙103 |
−39,6 |
49,087 |
c∙106 |
137 |
−-23,885 |
Решение.
С2H6(жид) → С2H6(газ)
Δ
=
 =
−56,240−(−66,356) = 10,116,
=
−56,240−(−66,356) = 10,116,
Δа = = 4,946−25,46 = −20,514,
Δb
= =
49,087∙10−3−(−39,6∙10−3)
= 88,687∙10−3,
=
49,087∙10−3−(−39,6∙10−3)
= 88,687∙10−3,
Δс
=
 =
−23,885−137 = −160,885∙10−6.
=
−23,885−137 = −160,885∙10−6.


 =
−20,514∙298+
=
−20,514∙298+ ∙88,687∙10−3+
∙88,687∙10−3+
 ∙(−160,885∙10−6)
= −3594,49.
∙(−160,885∙10−6)
= −3594,49.
10,116∙103=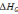 −3594,49
−3594,49
где =13,710 ккал/моль.
 =
= +
ΔаT+
+
ΔаT+ T2+
T2+ T3.
T3.
 =
13,710+(−20,514T)+44,343∙10−3T2−53,628∙T3∙10−6.
=
13,710+(−20,514T)+44,343∙10−3T2−53,628∙T3∙10−6.
Пример 6. Стандартная теплота реакции:
CH4+CO2→CO+H2,
который протекает в газовой фазе при 900 К равна 260119 Дж. Даны теплоемкости реагентов при различных реагентах.
Т ср |
800 |
1000 |
CH4 |
63,18 |
72,0 |
CO2 |
40,21 |
42,77 |
CO |
29,81 |
30,36 |
H2 |
28,96 |
29,15 |
Найти Δ .
Принять что в интервале от 800 до 1000
средняя теплоемкость:
.
Принять что в интервале от 800 до 1000
средняя теплоемкость:
 Результаты
расчета сравнить с литературной
величиной, которая равна
Результаты
расчета сравнить с литературной
величиной, которая равна
 259491
Дж.
259491
Дж.
Решение.
CH4+CO2→2CO+2H2
Δ =
= .
.
Δ =
.
=
.
Δ =
2∙29,81+28,96∙2−69,18−40,21 = 14,15,
=
2∙29,81+28,96∙2−69,18−40,21 = 14,15,
Δ =
2∙30,36+2∙29,15−72,0−42,7 = 4,25,
=
2∙30,36+2∙29,15−72,0−42,7 = 4,25,
Δ =
0,5(14,15+4,25)=9,2.
=
0,5(14,15+4,25)=9,2.
 =
=
 +(
+( (900-800)).
(900-800)).
 =
=
 +(
+( (900-800)).
(900-800)).
= (
( +
+ )
=
)
= (14,15+9,2)
= 11,675.
(14,15+9,2)
= 11,675.
 =
= −11,675∙100
= 260119−11,675∙100 = 258951,5 Дж.
−11,675∙100
= 260119−11,675∙100 = 258951,5 Дж.
отличается от табличного значения на 0,5 кДж.
Пример 7. Средняя мольная теплоемкость CH4 при постоянном объеме в интервале температур от 298−1500 К дана выражением:
 υ
=
8,983+30,229∙10−3T+3,722∙10−7T2
Дж/ К∙моль,
υ
=
8,983+30,229∙10−3T+3,722∙10−7T2
Дж/ К∙моль,
найти истинную мольную теплоемкость при постоянном давлении и температуре 25 OC считать, что CH4 подчиняется законам идеального газа. Использовать выражения:
Δ =
= .
.

Решение.
 8,31
8,31
 =
1,987 кал/К∙моль.
=
1,987 кал/К∙моль.
υ = 8,983+30,229∙10−3T+3,722∙10−7T2 Дж/ К∙моль,
υ = 8,983+30,229∙10−3(1500−298)+3,722∙10−7(1500−298)2,
= 8,983+8,31+30,229∙10−3T+3,722∙10−7T2,
= 17,293+30,229∙10−3T+3,722∙10−7T2,
 =
17,293T+30,229∙10−3T2+3,722∙10−7T3.
=
17,293T+30,229∙10−3T2+3,722∙10−7T3.
 =
17,293+60,458∙10−3T+11,166∙10−7T2
=
=
17,293+60,458∙10−3T+11,166∙10−7T2
= ,
,
 =
17,293+60,458∙10−3∙298+11,166∙10−7
∙2982
= 35,409 Дж/
К∙моль.
=
17,293+60,458∙10−3∙298+11,166∙10−7
∙2982
= 35,409 Дж/
К∙моль.
Пример 8. Для реакции:
CO(г)+H2O(г)→CO2(г)+H2(г)
рассчитать энтальпию
реации через величины энтальпии
разрывающихся и образующихся связей
при 298 К и 1 атм. Считать, что
 ,
,
Известно, что
 =
=
Р




 ешение.
:С=О + О →
С=О +H−H
ешение.
:С=О + О →
С=О +H−H
H H O
разр образ образ
ΔHp
= .
.
ΔHp
= 2∙ +
+ образ
=
2∙463+(−532−436) = −42
образ
=
2∙463+(−532−436) = −42 .
.
Пример 9. Рассчитать среднюю H диссоциации химической связи в молекуле метана по уравнению
CH4(г)→С(г) + 4H(г)
−74,85 718,38 217,94
Решение. Используем
справочные данные
 :
:
 =
718,38+4∙217,94−(−74,85) = 1664,99
.
=
718,38+4∙217,94−(−74,85) = 1664,99
.
Теплота пошедшая на разрыв четырех связей:
/4 = 416,25 .
Пример 10. Зависимость Кр от температуры для реакции:
CO(г)+H2O(г)→CO2(г)+H2(г)
Определяется следующим уравнением:
 Найти
стандартную теплоту реакции при 25 OC,
используя:
Найти
стандартную теплоту реакции при 25 OC,
используя:
1) Закон Гесса;
2) уравнение изобары
 .
.
Решение.
соед-е пар-р |
CO, ккал/моль |
H2, ккал/моль |
CO2, ккал/моль |
H2Oг, ккал/моль |
|
−26416 |
0 |
−94052 |
−57798 |
Δ =
= =
0+(−94052)−(−26416)−(−57798) = −9,838 ккал/моль
=
0+(−94052)−(−26416)−(−57798) = −9,838 ккал/моль
 =
2,303
=
2,303
 =
= ∙2,303−0,783
∙2,303−0,783 +0,00099029Т,
+0,00099029Т,
= −0,783
+0,00099029Т,
−0,783
+0,00099029Т,
 −0,783
−0,783 +0,00099029,
+0,00099029,

 −9,972
ккал/моль.
−9,972
ккал/моль.
Пример 11. Определить стандартную теплоту реакции:
CO+2H2↔CH3OH
если известно, что на других реакциях:
1) 2H2+HCOOCH3↔2CH3OH
2) CH3OH+CO↔HCOOH
Найдено экспериментальное выражение констант равновесия:


Решение.


 =
= .
.

 =2,303
.
=2,303
.
 =
=
 .
.
 =
=
 ∙RT
2=
22,807 ккал/моль.
∙RT
2=
22,807 ккал/моль.
 .
.
Пример 12. Вычислить состав равновесной смеси реакции превращения из пентена в децен, протекающий в газовой фазе, если в начале реакции мольное соотношение децена и пентена=1:1, =2,617 атм-1. Считать, что пентен и децен подчиняются законам идеальных газов, Т процесса 400 К. Найти мольные доли каждого компонента.
Решение.
2С2H5↔C10H10
2A↔B
|
С2H5 |
С10H10 |
τ=0 |
1 |
1 |
τ=τp |
1−2x |
1+x |
и зрасход образовано |
2x |
x |
υi |
2 |
1 |
∑ni |
2−x |
|
∑ni=1−2x+1+x=2−x.
NA
= ,
,
NB= ,
,
где =2,617 атм-1,
KP
=
 =
13,69 атм-1.
=
13,69 атм-1.
KP
=
 .
.
Рi=Ni∙Робщ.
PA= ,
,
PB= ,
,
KP
=
 =
=
 ,
,
KP = 13,69 атм-1.
13,69 = ( )
=
)
= ,
,
13,69−54,76x+54,76 −2−x−
=
0,
−2−x−
=
0,
55,76 −55,76 +11,69 = 0,
D = 501,84,
x1
= =0,7,
=0,7,
x2
= =0,3.
=0,3.
x1 и x2 проверяем подстановкой в NA и NB, x1 не подходит, так как NA становится отрицательным.
NA
= =
0,235∙100%
= 23,5%,
=
0,235∙100%
= 23,5%,
NB
= 0,765∙100%
= 76,5%.
0,765∙100%
= 76,5%.
∑N = 1.
A=23,5%,
B=76,5%.
Пример
13. Рассчитать
состав газообразной равновесной смеси
в реакции дегидроциклизации n-октана
в параксилол при 500 К и 1 атм, если
 −2,077.
Состав выразить в массовых процентах.
−2,077.
Состав выразить в массовых процентах.
Решение.
А↔В+4С

|
С8H18 |
С8H10 |
H2 |
τ=0 |
1 |
0 |
0 |
τ=τp |
1−x |
x |
4x |
и зрасход образовано |
x |
x |
4x |
υi |
−1 |
1 |
4 |
∑ni |
4x+1 |
||
Ni
= ,
,
NA
= ,
,
NB
= ,
,
NC
= .
.
PA=
NA∙Pобщ
= ,
,
PB
=
 ,
,
PC
= .
.
KP
=
 =
=
 ,
,
KP
= 0,0084.
0,0084.
0,0084 = .
.
P4=1
 ,
,
KP
= M∙ ,
,
 ,
,
 ,
,
 .
.
При x=0,194:
NA
= = 0,454,
= 0,454,
NB
= = 0,109,
= 0,109,
NC
=
 =
0,437.
=
0,437.
∑Ni=1.
A=45,4%.
NA
= .
.
mA
= =
0,454∙114 = 51,756,
=
0,454∙114 = 51,756,
mB = 0,11∙106 = 11,66,
mC = 0,437∙2 = 0,874,
∑mi = 64,29.
GA
= =
0,805∙100% = 80,5%,
=
0,805∙100% = 80,5%,
GB
=
 =
18,14%,
=
18,14%,
GC
= = 1,36%,
= 1,36%,
∑Gi = 100%.
Пример 13. Рассчитать состав равновесной смеси изомеризации этилбензола при 600 К и 1 атм в газовой фазе, если известно что
|
ЭБ |
О-ксилол |
М-ксилол |
П-ксилол |
ΔG600, ккал/моль |
57,646 |
56,103 |
55,099 |
56,060 |
Решение.

3 обратимые реакции:



ΔGP600
=
 .
.
1) ΔGP1,600 = 56,060−57,646 = −1,586;
2) ΔGP2,600 = 55,099−57,646 = −2,547;
3) ΔGP3,600 = 56,103−57,646 = −1,543.
ΔG
= −RT .
.


где R = 1,987 кал/К∙моль, тогда
 =
3,78,
=
3,78,
 = 8,45,
= 8,45,
 =3,648.
=3,648.
|
П−кс |
М−кс |
О−кс |
ЭБ |
τ=0 |
0 |
0 |
0 |
1 |
τ=τp |
x1 |
x2 |
x3 |
1−(x1+ x2+ x3) |
и зрасход образовано |
x1 |
x2 |
x3 |
x1+ x2+ x3 |
υi |
1 |
1 |
1 |
−1 |
∑ni |
1 |
|||
∑ni = x1+ x2+ x3+1−(x1+ x2+ x3) = 1.
Ni
=
N1
= ,
,
N2 = x2,
N3 = x3,
NЭБ =1−(x1+ x2+ x3).
Pi = Ni∙Pобщ,
где Pобщ=1, Pi = Ni.
KP
=
 ,
,

 =
= =
3,78 решаем систему уравнений.
=
3,78 решаем систему уравнений.
= =
8,45
=
8,45
= =
3,648
=
3,648
1) 3,78 x1 = 1−x1 −x2− x3;
2) 8,45 x2 = 1−x1 −x2− x3;
3) 3,648 x3 = 1−x1 −x2− x3;
 =
15,878,
=
15,878,
 ,
,
 ,
,
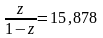 ,
,
z = 15,878 (1−z),
z = 15,878−15,878z,
16,878z = 15,878,
z = 0,94.
 ,
,
x1 = 0,224.
 ,
,
x2 = 0,5.
 ,
,
x3 = 0,218.
Пример 14. Вычислить летучесть водорода при 500 К и давлении 250 атм, если известно, что Ткр = 33,3 К; Ркр = 12,8 атм; Zкр = 0,29.
Решение.
 .
.
 .
.
где 1,1.
1,1.
 .
.
Пример 15. Рассчитать константы равновесия: Кγ, Кр, если Т = 800 К, Р = 2 МПа. Для реакции разложения нормального пентана до этилена и пропана
C5H12(Г)↔ C2H4(Г) + C3H8(Г)
Если известно, что ∆G800 = −16,050 кДж/моль.
соединение параметр |
А |
В |
С |
Ткр (К) |
469,8 |
370 |
282,4 |
Ркр (МПа) |
3,37 |
4,26 |
5,04 |
Решение.
 .
.
 .
.
 ,
,
 ,
,
 .
.
 ,
,
 ;
;
 .
.
 ;
;
 ;
;
 .
.
 .
.
 .
.
 ,
,
 ,
,
 .
.
Пример 16. Рассчитать состав равновесной смеси, получающаяся при полимеризации пропилена в газовой фазе:



 соед-е
соед-е
 4,11
4,11 ,
,
 ,
ккал/моль
,
ккал/моль