
- •Глава 1. Cтехиометрия и материальные расчеты химической реакции
- •Примеры решения задач
- •1.2. Задачи для самостоятельного решения
- •1.2.1. Материальные расчеты по молям
- •1.2.2. Материальные расчеты по мольному потоку
- •1.2.3. Простые и сложные реакции
- •1.2.4. Задачи с изменением объема
- •Глава 2. Термодинамика химических реакций
- •2.1. Примеры решения задач
- •2C3h6↔н-c6h12↔ транс-c6h12
- •2.2. Задачи для самостоятельного решения
- •2.2.1. Расчет теплоты химической реакции
- •2.2.2. Расчет константы равновесия в случае простой реакции
- •2.2.3. Расчет константы равновесия при параллельно протекающих реакциях
- •2, 2, 3, 3-Тетраметилбутан
- •II) 2с3н6↔с6н12 (1-гексен)
- •II) 2с3н6↔с6н12 (1-гексен)
- •II) 2с3н6↔с6н12 (1-гексен)
- •2.2.4. Расчет константы равновесия при последовательно протекающих реакциях
- •2С3н6↔ н-с6н12 ↔с6н12 (транс-2-гексен)
- •2.2.5. Расчет константы равновесия в неидеальных газовых системах
- •Глава 3. Кинетика
- •3. 1. Примеры решения задач
- •3. 2. Задачи для самостоятельного решения
- •3. Разложение паров пропионового альдегида при нагревании в кварцевом сосуде протекает как гомогенная реакция первого порядка по уравнению
- •Глава 4. Реактора
- •4.1. Удельная производительность при расчете реакторов
- •1) Начальные концентрации или парциальные давления компонентов;
- •2) Мольные соотношения реагентов рив;
- •3) Мольные соотношения реагентов рис;
- •1 Реактор:
- •2 Реактор:
- •4.2. Селективность и основы выбора реакционного узла с точки зрения селективности реакций разных типов
- •4.3. Расчет селективности в случае параллельно протекающих реакций
- •4.4. Влияние условий процесса на селективность
- •Целевая реакция имеет более высокий порядок(рис)
- •Целевая реакция имеет более высокий порядок(рив)
- •Случай с последовательными реакциями
- •4.5. Задчи для самостоятельного решения
- •4.5.1. Расчет производительности реакторов
- •4.5.2. Расчет селективности реакторов
- •4.5.3. Характеристическое уравнение реакторов
Глава 4. Реактора
Пример 1. Для реакции дегидратации этанола , протекающего в РИВ составить характеристическое уравнение:
а) для образования этилена;
б) для образования диэтилового эфира;
Рассчитать tист. для Снач( С2Н5ОН) = 12 моль/ л,
Сконеч. ( С2Н5ОН) = 12 моль/ л,
k1 реак.= 6,1∙10-1;
k2реак.= 5,8∙10-1 ;
Решение.
tист.
= =
= ;
;
С2Н5ОН→С2Н4+Н2О, А→В+С,(k1);
 =
−k1
CA
=
r1
;
=
−k1
CA
=
r1
;
2С2Н5ОН→С2Н5ОН+Н2О, А→В+С,(k2);
 =−k2
C
2A
= r2
;
=−k2
C
2A
= r2
;
τист.1
=  =
= =
= ln|(CA)|
=
ln|(CA)|
=  А)−
А)− А0)
=
А0)
=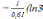 )−
)− )
= 2,273;
)
= 2,273;
τист.2
= 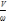 =
= =
−
=
−  ln|(CA)|
=
ln|(CA)|
= −
−
 )
= 0,43.
)
= 0,43.
Пример 2. В РПД протекает реакция нулевого порядка. Рассчитать время протекания реакции при условии СА0 = 5 моль/л, СА = 2 моль/л, k = 0,7,
Полученные результаты сравнить с теми, которые были бы получены, если бы реакция протекала в РИВ и в РИС.
Решение.
ri
= ;
τист.
=
;
τист.
= ;
r
= −k∙
C
0A
;
;
r
= −k∙
C
0A
;
τист.
= =
= (CA)|
=
(CA)|
= А−
А− А0)
= 4,29.
А0)
= 4,29.
РИВ
Fi
=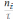 ;
ω
=
;
ω
=  ;
F
i
= ωi∙Ci,
;
Ci,
=
;
F
i
= ωi∙Ci,
;
Ci,
=  ;
;
 ;
τист=
;
τист= =
4,3.
=
4,3.
РИС
Fi
=
Fio+ ∙FA0∙xA0;
∙FA0∙xA0;
r
= =
= ;
V
=
;
V
= ;
;
τист.1
= =
= = 4,3.
= 4,3.
Вывод: Таким образом, если реакция нулевого порядка, то время реакции в РПД, РИВ, РИС одинакова.
Пример 3. Газофазная реакция получения продукта по схеме А→2 R
−rA = 6,57∙10-4∙C A0.7 кмоль/м3с, Т = 150 0 С, р =3,5 атм.
Исходное сырье не содержит продукта R, но имеет 12 % по объему инертных примесей. Объемная скорость подачи сырья ω0 = 5,6∙10-3 м3 /с.
Определить:
1.Степень превращения в РИВ, если VРИВ = 3 м3;
2.Степень превращения в РПД с VРПД = 2 м3, время загрузки и выгрузки составляет 10 % от времени реакции.
Найти для второго случая время протекания ХТП.
Решение. А→2 R с изменением объема,
В условии задачи часто не прописывается, что реакция идет с изменением объема. Однако объем нужно учесть если:
1.В условии газофазная реакция и сумма молей исходных реагентов не равна сумме продуктов.
2.Если в условии сказано, что реакция протекает с изменением плотности веществ- участников реакций.
Сi= ;
;
V
= V0(1+ ;
;
 =
= ;
;
 =
0,88;
=
0,88;
z
= xA
; V
= V0(1+ ;
;
τист= ; −rA
=
6,57∙10-4∙C
A0.7
кмоль/м3с;
; −rA
=
6,57∙10-4∙C
A0.7
кмоль/м3с;
CA=CAo+ ∙CAo∙xA=
CAo(1−xA);
∙CAo∙xA=
CAo(1−xA);
dCA=CAo
 (1−xA);
(1−xA);
dCA=−CAo dxA ;
τ
= − = −
= − ;
;
τ
= ;
τ
=
;
τ
=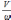 =
= =
357,14;
=
357,14;
Уравнение Ван-дер- Ваальса
PV =
nRT; P = RT=
CRT;
RT=
CRT;
CA0
= =
= =
88,78∙10-2
;
=
88,78∙10-2
;
τ
= 357 =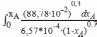 ;
;  ;
;
357 =
Задача далее решается подбором значения хА , подставим значения 0,1 0,2 и т.д. Перебирая значения хА подставляют в α и смотрят, численное значение, полученное в правой части уравнения.
Для РПД степень превращения будет точно такой же как в РИВ. (хА=0,86), а время 357 сек., τхтп =357+35,7=392,7;
τ
= 357 =
= ;
;
если без изменения
объема, то
СА
= ;
;
CA = CA0(1−xA); без изменения объема,
СА
=  ; с изменением объема.
; с изменением объема.
С изменением объема
r
= 6.5∙10-4
( ;
;
dCA
= d( ;
;
С изменением объема V = V0(1+ξz);
ξ
= ;
;
CA
= =
=
 =
= ;
;
По уравнение Клайперона СА0 = 88.78∙10-2;
Характеристическое уравнение РИВ
τ = = 357 =
= 357 = ;
;
dCA
= d[ ]
= 88.78∙10-2
d(
]
= 88.78∙10-2
d( )=
=
)=
= ;
;
 ;
;
Для РПД интеграл получится таким же, как и в первом случае.
Если был бы РИС , то
τис
т = 357 =
 =
=
 =
=
 =
=
 ;
;
Далее задача решается методом подбора.
Пример 4. Какую размерность имеет константа скоростей кинетических уравнений.
а)
r
=  ;
;
б)
r
=  ;
;
Решение.
а.)
[ ;
;
[
1+[

б.) [ скорость через Pi
, r
= [
скорость через Pi
, r
= [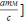 ;
;
[ =
=
 ;
;
[
[ ]
=
]
= 
Пример 5. Для газофазной реакции протекающей в РИС
N2 O5→N2 O4+0.5 O2
при 250 0 С, получены следующие кинетические опытные данные:
τ, мин |
0 |
20 |
30 |
40 |
50 |
60 |
Р, торр |
0 |
7 |
11,9 |
17,1 |
20,2 |
24,9 |
Показать, что реакция нулевого порядка.
Вычислить k при 250 0 С, определить размерность.
А→В+0,5 С
Решение.
r
=
 ;
;
r1
= ;
;
r2
=  ;
;
r3 = 0,43;
r4 = 0,40;
r5 = 0,42;
rср
= 0,4;
k
= 0, 4 [
Пример 6. Жидкофазная реакция первого порядка протекает без изменения плотности реагирующих веществ в РПД, продукты реакции в исходной смеси отсутствуют. За время τ1 =120 с, в целевой продукт превращается 20 % исходного вещества А. Определить хА в РИВ и РИС при τ2 =360 с.
Решение. Выводится характеристическое уравнение для РИВ через хА
СA=CA0+ ∙
CA0∙xA=
CA0(1−xA);
∙
CA0∙xA=
CA0(1−xA);
dτA=dCA0(1−xA)= CA0d(1−xA)=− CA0dxA;
τ
= − = −CA0
= −CA0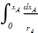 ;
;
rA
= −k
τ
= − ln(1-xA)
−
ln(1-xA)
−  (ln1)
=
(ln1)
= ln(1−0.2)
= 120;
ln(1−0.2)
= 120;
k =0,00186;
τист= =
= =
= =
= =
=
360 =
−0,6696 = ln(1− ;
;
 ;
;
Вывод характеристического уравнения для РИС:
τис
т
= =
=
 =
= = 360;
= 360;
360 ;
;
xA
= ;
;
В РИВ xA выше, следовательно вести процесс в РИВ намного выгоднее.
Пример 7. В РПД протекает жидкофазная реакция второго порядка А+В→…
При постоянном объеме и соотношение начальных концентраций
ϐ = ;
;
Известно, что за время τ=80 сек, степень превращения А по В равна 30 % .
Определить степени превращения веществ А и В в РИС и РИВ, если соотношение концентраций исходных веществ А и В на входе в реактор остается прежним, а подача этих веществ А и В, осуществляется раздельно.
Скорость подачи веществ ω0A=1,8∙10-3 м3 /с;
ω0в=2,7∙10-3 м3 /с;
Объем каждого ректора равен 5,2 м3.
Решение. Расчет необходимо вести по недостающему реагенту, т.е. по СВ0.
ri
= =
= ;
;
СB
=
CB0+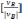 ∙
CB0∙xB
=
CB0(1−xB);
∙
CB0∙xB
=
CB0(1−xB);
dτB = dCB0(1−xB) = CB0d(1−xB) = −CB0dxB;
rB = −k∙CBCA;
СA
=
CA0+ ∙
CA0∙xA
=
CA0(1-xA);
∙
CA0∙xA
=
CA0(1-xA);
CA
=  ;
;
СA
=
CA0+ ∙
CB0∙xB
=
CA0−CB0∙xB;
∙
CB0∙xB
=
CA0−CB0∙xB;
CA = 1,22∙CB0-CBo∙xB = CB0(1,22-xB);
rB
= k∙CA∙CB
=
rB
=  (1−xB)
(1−xB) ;
;
τ
= 
 +
+ =
=
 ;
;
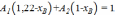 ;
;
1,22
 ;
;
1,22
1,22
1,22
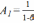 ;
; ;
;
 ;
;
[ ;
;
 ];
];
 0,04098;
0,04098;
РИС
ωА+ ωB = 4,5∙10-3 м3/с;
τист
= =
= = 1155.55 сек;
= 1155.55 сек;
 ;
;
 ;
;
 ;
;
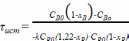 ;
;
1,155∙103

После преобразований получено квадратное уравнение
 ;
;
D
=  ;
;
 .
.
РИВ
 =
=
 ;
;
Характеристическое уравнение для РИВ такое же, как и для РПД.
Так как два потока
 и
и  c
концентрациями
c
концентрациями  и
и объединяются в
объединяются в  c
концентрацией
c
концентрацией  и входят в реактор ИВ, выходя из него с
такой же
,
но с концентрацией
и входят в реактор ИВ, выходя из него с
такой же
,
но с концентрацией  .
.

 ;
как для РПД
;
как для РПД
 ;
;
ϐ=1,22,
τ=1.156∙ ;
как для РИВ
;
как для РИВ
После преобразования характеристического уравнения получено выражение:
 = 0.915;
= 0.915;
 =
= =0,749
=0,749
РИС
 ;
;
Из стехиометр. уравнения А+В→…
 ;
Разделим обе части уравнения на СВ0
;
Разделим обе части уравнения на СВ0
 ;
;
 ;
;
 ;
после преобразований получено
;
после преобразований получено
 .
.
Пример 9. Для реакции между 3-этиламином и иодистым метилом протекающего а реакторе при одинаковых начальных концентрациях компонентов С0=0.05 моль/л получены следующие результаты:
|
325 |
1295 |
1550 |
1975 |
α, % |
31,5 |
64,9 |
68,8 |
73,7 |
Покажите, что реакция второго порядка.
Рассчитать k , установить ее размерность.
Вещество |
А |
В |
τ=0 |
С0 |
С0 |
τ= τр-ии |
С0-x |
С0-x |
Израсх/образовалось |
x |
x |
Решение.
a=С0, x= α∙a, переходим в моли
A+B→…
r = -k(C0-x)2, x = C0α, r = -k(C0-C0∙α)2
r
=

 ;
;
 ;
;
τ
= =τ;
=τ;
τ
= ;
;

τ
= =
=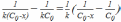 ;
;
 (
( ;
подставим x
= C0α,
;
подставим x
= C0α,
 =0,028;
=0,028;
 ;
;
 ;
;
 ;
;
Проверим, является ли реакция второго порядка, α-безразмерная.
 =
= ;
;
Реакция второго порядка.
Пример 10. В
реакторе РПД протекает жидкофазная
реакция второго порядка А+2В→….,
плотность реакционной смеси не изменяется,
k
рассчитывается
по А.
Соотношение концентраций  ,
за время τ=50 сек, х=12%
по А.
,
за время τ=50 сек, х=12%
по А.
Вычислить хА в РИВ и РИС при том же соотношении концентраций, если скорость подачи исходных веществ составляет ω0 =2.4∙10-2 м3 /с, объем каждого реактора равнее 5, 6 м3.
Рассчитать х по В.
Определить объем РИВ и РИС, необходимое для достижения рассчитанных выше степеней превращения, если соотношение начальных концентраций веществ,
 ,
при условии, что СА0
=
const.
,
при условии, что СА0
=
const.
Решение.
А+2В→…
 ;
;
 ;
;
 ;
;
 ;
;
 ;
;

 ;
;
 ;
;
τ
= ;
;
τ
=  =
=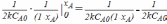 =
=
 ;
;
 ;
;
 ;
;
xA = xB = 0.12;
 ;
;
 ;
;
 =
= ;
;
После преобразований получено следующее выражение:
 =
= =
= ;
;
Уравнение для РИВ:
τ
= =
= = 233 сек;
= 233 сек;
 (
( ;
;
1,36∙10-3 ;
;
 0,388.
0,388.
Уравнение для
РИС, такое же.
такое же.
Вывод характеристического уравнения.
 ;
;
 (1-
(1- ;
;
233
 =
= =
=
 ;
;
При СА0 =const, СB0= СА0∙4;
 =
=
 ;
;
 )(4
)(4 );
);
 =
= =;
=;
 ;
;
VРИС=2,35 м3;
Определяем объем для РИВ:
 ;
;
VРИВ=2.43 м3
По номограмме
 =0,64,
M=2.
=0,64,
M=2.
Пример 11. Рассчитать k реакции окисления SO2 на оксиде железа при 680 0С,
если скорость реакции окисления описывается уравнением
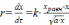 ,
,
где а− процентное содержание SO2,
хравн –равновесная степень превращения,
х– степень превращения в любой момент времени.
хравн 680С = 0,58, известно, что газ содержит 7 % SO2.
Экспериментальные данные:
τ, сек |
0.02 |
0.06 |
0.1 |
0.19 |
хдоп |
0.1 |
0.22 |
0.3 |
0.38 |

tg1α
= = 2,5;
= 2,5;
tg2α = 1,8;
tg3α = 0,6;
r
= 2,5∙ = 7,25;
= 7,25;
Вывод: константы получились разные, значит уравнение неверное.
По найденным r = 7,25, скорости реакции при 680 0 С, найти k при 650 0 С, если Еа =184 кДж∙моль.
Решение.
По уравнению Аррениуса  ;
;
 =
22.8;
=
22.8;
 = 7.18.
= 7.18.
Пример 12. Определить k взаимодействия N2 c O2 c образованием NO при Т=2000K, по следующим экспериментальным данным:
τ, сек |
0,035 |
0,12 |
0,25 |
0,425 |
0,61 |
х |
0,2 |
0,35 |
0,5 |
0,64 |
0,7 |
 =
= ;
;
 ;
;
x- процентное содержание по объему NO во время τ;
а- начальная концентрация N2 ; a=79
b-начальная концентрация O2; b=21

tg1α
= = 1,85;
= 1,85;
tg2α =1,25;
tg3α = 0,8;
tg4α = 0,53;
tg5α = 0,34;
 0,954;
0,954;
 =
= ;
;
 0,793
0,793
k1 =
= 3,48∙10-2;
3,48∙10-2;
 ;
;
 ;
;
 ;
;
 .
.

