
- •Глава I вода, ее состояние и роль в природе
- •1.1. Физико-химические свойства воды
- •1.2. Характеристика источников водоснабжения
- •1.3 Физические и химические показатели качества воды.
- •1.3.1 Характеристика физических показателей качества воды
- •XII I II III IV V VI VII VIII IX X Месяцы
- •1.3.2 Характеристика химических показателей качества воды
- •1.4 Биологические и бактериологические показатели качества воды
- •1.4.1 Характеристика водоема по биологическим показателям
- •1.4.2.Характеристика бактериологических показателей качества воды
- •1.5 Классификация примесей и загрязнений на основе их фазово-дисперсного состояния.
- •1.5.1 Классификация примесей и загрязнений воды
- •1.5.2. Физико-химическая характеристика дисперсных и растворимых примесей воды
- •1.5.3.Физико-химическая характеристика различных групп примесей и загрязнений воды
- •1.6.Требования к качеству воды, используемые в различных отраслях промышленности.
- •1.6.1.Использование воды в промышленности.
- •1.6.2. Требования к качеству воды различного назначения .
1.3.2 Характеристика химических показателей качества воды
Химический анализ природной воды имеет решающее значение в практике водоснабжения. Результаты анализа позволяют установить пригодность источника для питьевого и технического водоснабжения, наличие в воде вредных для организма загрязнений или соединений, способствующих ее коррозийной активности, вспениванию, образованию накипи и т. д.
На основании сопоставления результатов анализа природной воды с требованиями, предъявляемыми к ней потребителем, можно судить о том, каким процессам очистки следует подвергнуть эту воду для улучшения тех или иных показателей ее качества.
К химическим определениям относятся установление активной реакции воды, окисляемости, азотсодержащих веществ, растворенных в воде газов, плотного остатка и потерь при прокаливании, жесткости и щелочности, а также хлоридов, сульфатов, железа, марганца и других элементов.
Активная реакция воды, т. е. степень ее кислотности или щелочности, определяется концентрацией водородных ионов, точнее их активностью. Активность представляет собой эффективную концентрацию вещества, учитывающую взаимодействие его ионов или молекул друг с другом, а также с молекулами растворителя. Она позволяет судить об отклонении свойств данного вещества в реальном растворе от его свойств в идеальном растворе. Активность зависит от вида, концентрации каждого компонента раствора, температуры и давления. Как известно, вода в незначительной степени диссоциирует на ионы водорода и гид-роксила. В упрощенном виде, без учета воды, гидратирующей протон и гидро-ксил, процесс диссоциации можно представить в виде Н2О <= H+ + ОН. Для этой обратимой реакции константа равновесия определяется уравнением

где
 активности
соответствующих ионов.
активности
соответствующих ионов.
В
связи с тем, что степень диссоциации
молекул воды незначительна, воду можно
рассматривать как чистое вещество, для
которого при стандартных температуре
и давлении активность равна единице
( =
1). Тогда
=
1). Тогда
 =
Кю,
где
Kw*
10-14
—так
называемое ионное произведение воды,
зависящее только
от температуры:
=
Кю,
где
Kw*
10-14
—так
называемое ионное произведение воды,
зависящее только
от температуры:
t, °C |
Kw • 10-14 |
0 |
0,11 |
25 |
1,01 |
50 |
5,47 |
100 |
59,0 |
Поскольку содержание ионов Н+ и ОН- в воде очень мало, активности ионов
можно заменить их концентрациями:
[Н+] [ОН-] = Kw.
При комнатной температуре можно округленно принять Kw = 1 • 10 14. В нейтральном растворе концентрация водородных ионов равна концентрации гидроксильных ионов
[Н+] = [ОН] = 10 7 г-ион/л.
При [Н+] > 10 7 растворы имеют кислую реакцию, при [Н+] < 10 7 — щелочную.
Активную реакцию воды принято выражать водородным показателем рН, представляющим собой отрицательный десятичный логарифм концентрации водородных ионов: рН = —lg [H+]. рН нейтральных растворов равен 7, кислых растворов — меньше 7 и щелочных растворов — больше 7.
В отличие от чистой воды или нейтральных растворов солей, в которых концентрации [Н+] и [ОН] настолько малы, что ими можно пользоваться вместо активностей, в кислых и щелочных растворах концентрации этих ионов могут отличаться на несколько порядков по величине. В этом случае вместо концентрации необходимо пользоваться активностью.
В кислых или щелочных растворах ионное произведение воды выражается зависимостью = К’ю Связь между величинами Kw и К’ш описывается следующим уравнением:
Kw f 2 — Kw,
где f — коэффициент активности, зависящий от ионной силы раствора. Ионная сила является мерой напряженности электрического поля, создаваемого присутствующими в растворе ионами. Она определяется как полусумма произведений концентрации ионов на квадрат их валентности:

где С1, С2— концентрации ионов, присутствующих в воде, г-ион/л; Zj и Z2 — валентности ионов.
Обычно для большинства природных вод величина рН изменяется в пределах 6,5—8,5. На величину рН воды влияет повышенная концентрация гумусовых кислот, загрязнение водоема стоками промышленных предприятий и т. п.
Постоянство величины рН, которое имеет большое значение для нормального протекания в воде различных биологических и физико-химических процессов, обеспечивается в природных водах буферной системой, состоящей из растворенной в воде угольной кислоты и ионов НСО3. Угольная кислота диссоциирует на ионы
Н2СО3 НСО3 + Н+.
Константа равновесия при этом определяется из уравнения

откуда

Таким образом, концентрация ионов водорода прямо пропорциональна количеству Н2СО3 и обратно пропорциональна содержанию НСОГ- Концентрация водородных ионов такой буферной системы незначительно изменяется с разбавлением, так как рН системы определяется не концентрацией кислоты и ее соли, а отношением этих концентраций.
Прибавление некоторых количеств кислоты или щелочи мало влияет на рН воды, так как при прибавлении к воде щелочи часть ионов Н+, которые образовались при диссоциации угольной кислоты, связывается в малодис-социированную воду. Это приводит к диссоциации новых количеств кислоты и восстановлению первоначальной концентрации Н+. В случае прибавления к воде кислоты избыточные ионы водорода связываются с НСО~ в малодиссоци-ированную угольную кислоту, в результате чего концентрация Н+ в системе также изменяется незначительно.
Хотя емкость бикарбонатной буферной смеси в природной воде не очень велика, все же в процессах обработки воды, связанных с подкислением или подщелачиванием, рН последней, как правило, меняется мало.
Окисляемость воды. Наличие в природных водах органических и некоторых легкоокисляющихся неорганических примесей (сероводорода, сульфитов, закисного железа и др.) обусловливает определенную величину окисляемости воды. В связи с тем, что окисляемость поверхностных вод объясняется главным образом наличием органических веществ, определение окисляемости, т. е. количества кислорода, необходимого для окисления примесей в данном объеме воды, является одним из косвенных методов определения органических веществ в воде.
Наименьшей величиной окисляемости (~2 мг/л, О2) характеризуются артезианские воды. Окисляемость грунтовых вод зависит от глубины их залегания Грунтовые незагрязненные воды имеют окисляемость, близкую к окисляемости артезианских вод. Окисляемость чистых озерных вод в среднем составляет 5—8 мг/л кислорода; в речной воде она колеблется в широких пределах, доходя до 60 мг/л и более. Высокой окисляемостью воды отличаются реки, бассейны которых расположены в болотистых местностях. В болотных водах в некоторых случаях она достигает 400 мг/л.
Окисляемость природных, особенно поверхностных вод, не является постоянной величиной. Изменение химической характеристики поступающих в воду веществ меняет величину ее окисляемости. Повышенная окисляемость воды свидетельствует о загрязнении источника и требует применения соответствующих мероприятий по его охране при использовании для водоснабжения. Внезапное повышение окисляемости воды служит признаком загрязнения ее бытовыми стоками, поэтому величина окисляемости — важная гигиеническая характеристика воды.
Окисляемость определяют обработкой исследуемой воды марганцевокис-лым калием (перманганатная окисляемость). Однако такое определение имеет недостатки: степень окисления органических веществ перманганатом различна, некоторые органические вещества им вообще не окисляются. Кроме того, сам перманганат в условиях анализа разлагается. Установлено, что этим методом определяется примерно 50% органических веществ, находящихся в воде. Поэтому подобное определение дает лишь условное представление о количестве находящихся в воде примесей и загрязнений и служит в основном для сравнения качества воды одного источника в разных местах в различное время.
Наиболее полное окисление (90—95%) содержащихся в природных водах органических веществ достигается при замене перманганата бихроматом (бихроматная окисляемость). Высокая степень окисления, достигаемая при этом методе, позволяет применять его для количественного определения органических веществ в воде.
Дополнительные сведения о характере содержащихся в воде органических соединений можно получить, сравнивая отношение цветности и окисляемости. Повышенное значение этого отношения свидетельствует о преобладании в воде устойчивых гумусовых веществ болотного происхождения, пониженное — о гумусовых веществах планктонного происхождения. Средние значения характерны для почвенных гумусовых веществ.
Интересно отметить, что окисляемость воды после обработки ее коагулянтами и фильтрования снижается значительно меньше, чем цветность. Так, при обработке волжской воды окисляемость в среднем уменьшалась на 39, цветность — на 63%; в воде Оки окисляемость уменьшалась на 22, цветность — на 47%. Данное обстоятельство свидетельствует о наличии в природных водах большого количества неокрашенных органических веществ.
Таким образом, определение окисляемости является не только способом установления концентрации органических веществ, но в сочетании с другими показателями, например с цветностью, может служить и методом определения их происхождения.
Азотсодержащие вещества (ионы аммония, нитритные и нитратные ионы) образуются вводе в результате разложения белковых соединений, попадающих в нее почти всегда со сточными бытовыми водами, стоками коксобензольных, азотнотуковых и других заводов. Белковые вещества под действием микроорганизмов подвергаются распаду, конечный продукт которого — аммиак. Наличие последнего свидетельствует о загрязнении воды сточными водами.
Иногда в воде присутствуют ионы аммония неорганического происхождения, образующиеся в результате восстановления нитратов и нитритов гумусовыми веществами, сероводородом, закисным железом и т. д. Наличие в воде ионов NH4+, образующихся таким путем, не представляет опасности в санитарном отношении.
Если появление в воде азотсодержащих соединений происходит в результате гниения белковых веществ, то такие воды непригодны для питья. В природной воде ионы NH4+ неустойчивы и при окислении кислородом воздуха под действием бактерий Nitrosomonas и Nitrobacter постепенно превращаются в нитритные и нитратные ионы:
2NH4+ + 2ОН + ЗО2 = 2NO + 2Н+ + 4Н2О, 2NO2 + О2 = 2NO3.
Первая стадия окисления протекает значительно быстрее, чем вторая. Весь процесс окисления замедляется при понижении температуры, а при 0° С почти прекращается.
При недостатке кислорода и наличии безазотистых веществ (крахмала, клетчатки) ионы NO3 под действием группы денитрифицирующих бактерий разлагаются до азота
4NO3 + 5С = 2СО32 + 2N2 + ЗСО2.
Образование нитратов и нитритов в воде может быть не только следствием описанных выше процессов. Нитраты, например, образуются при электрических грозовых разрядах в результате окисления азота кислородом воздуха или при растворении нитратных солей почвенными водами. Восстанавливаясь, нитраты служат источником обогащения воды нитритами.
В поверхностных водах содержатся главным образом нитраты (количество их невелико, 0,001—0,003 мг/л). В артезианских водах содержание нитритов может достигать десятых долей миллиграмма в литре.
По наличию тех или иных азотсодержащих соединений судят о времени загрязнения воды стоками. Так, наличие в воде NH4+ и отсутствие нитритов указывает на недавнее загрязнение воды. Одновременное присутствие их свидетельствует о том, что с момента первичного загрязнения прошел уже какой-то промежуток времени. Отсутствие NH4+ при наличии нитритов и особенно нитратов говорит о том, что загрязнение произошло уже давно и вода за это время самоочистилась.
Повышенное содержание нитратов (более 50 мг/л) в воде, постоянно используемой для питья, приводит к нарушению окислительной функции крови — метгемоглобинемии. Случаи метгемоглобинемии наблюдались при употреблении питьевой воды, в которой концентрация нитратов составляла 60—800 мг/л.
Сухой остаток и потеря при прокаливании. О количестве солей, содержащихся в природных водах, можно судить по величине сухого остатка и потере массы при прокаливании. Сухой остаток, образующийся при выпаривании определенного объема воды, предварительно профильтрованной через бумажный фильтр, состоит из минеральных солей и нелетучих органических соединений. Органическая часть сухого остатка воды определяется потерей его при прокаливании.
Определение потери при прокаливании используется для контроля содержания органических веществ, хотя достоверные результаты получаются лишь для вод с малым содержанием солей. Для вод с повышенным количеством солей полученные данные обычно превышают истинное содержание органических веществ в результате частичного распада и улетучивания при прокаливании минеральных солей некоторых азотсодержащих соединений, карбонатов, а также кристаллизационной воды.
Хлориды и сульфаты. Благодаря большой растворимости хлористых солей ионы хлора содержатся почти во всех водах. Так, растворимость NaCl составляет 360, MgCl — 545 г/л. Большие количества хлоридов могут попадать в воду в результате вымывания поваренной соли или других хлористых соединений из соприкасающихся с водой пластов пород, а также при попадании в воду промышленных и хозяйственно-бытовых стоков. В последнем случае наряду с повышенным содержанием ионов хлора в воде наблюдается наличие аммиака, нитритов, повышенная окисляемость и другие показатели, свидетельствующие о загрязненности.
Кроме ионов С1 в природных водах часто встречаются ионы SO42. В реках и пресных озерах содержание сульфат-ионов обычно колеблется в пределах 60—100 мг/л. Сульфат-ионы попадают в воду в основном при растворении осадочных пород, в состав которых входит гипс. Иногда ионы SO42 образуются в воде в результате окисления сульфидов и самородной серы, а также вследствие загрязнения воды промышленными и бытовыми стоками. При отсутствии кислорода ионы SO42 под действием сульфатредуцирующих бактерий восстанавливаются до H2S.
Наличие в воде большого количества сульфатов нежелательно, так как сульфат натрия, например, нарушает деятельность желудочно-кишечного тракта, а сульфаты кальция и магния повышают некарбонатную жесткость воды.
Сульфаты и хлориды в определенных концентрациях являются причиной коррозийной активности (агрессивности) воды. Сульфатная агрессивность возникает при наличии в воде ионов сульфата в количестве 300 мг/л и более. Согласно дачным , воды, содержащие 250—800 мг/л SO42, слабо агрессивны и| только при концентрации SO42 более 800—900 мг/л становятся заметно aгpecсивными.
Воды, содержащие большое количество сульфатов, оказывают разрушающее действие на бетонные конструкции. Причиной служит образование гипса (в результате реакции между известью цемента и сульфатами), которое сопро-вождается увеличением объема и возникновением в бетоне трещин. Хлориды, содержащиеся в воде в больших количествах, при соприкосновении с бетоном разрушают его в результате выщелачивания образующихся при взаимодей-ствии с известью растворимых хлористого кальция и магния.
Щелочность воды. Под общей щелочностью воды подразумевается сумма содержащихся в воде гидроксильных ионов (ОН) и анионов слабых кислот, например угольной (ионов НСО3, СО3). Поскольку в большинстве природных вод преобладают углекислые соединения, различают обычно лишь бикарбонатную и карбонатную щелочность. При некоторых приемах обработки воды и при рН ее выше 8,5 возникает гидратная щелочность.
Таблица 3.
Сравнение различных единиц измерения жесткости воды
Единицы измерения жесткости воды |
мг-экв/л |
Градусы жёсткости |
||||
немецкие |
французские |
английские |
американские |
|||
мг-экв/л |
|
1,0000 |
2,8040 |
5,0050 |
3,5110 |
50,0450 |
Градус |
немецкий |
0,3566 |
1,0000 |
1,7848 |
1,2521 |
17,8470 |
|
французский |
0,1998 |
0,5603 |
1,0000 |
0,7015 |
10,0000 |
|
английский |
0,2848 |
0,7987 |
1,4235 |
1,0000 |
14,2530 |
|
американский |
0,0199 |
0,0560 |
0,1000 |
0,0702 |
1,0000 |
Щелочные металлы. Из ионов щелочных металлов в воде наиболее распространены Na+ и К+, попадающие в воду в результате растворения коренных пород. Основным источником натрия в природных водах являются залежи поваренной соли. В природных водах натрия содержится больше, чем калия. Это объясняется лучшим поглощением последнего почвами, а также большим извлечением его из воды растениями.
Жесткость воды. Жесткость природных вод обусловливается наличием в них солей кальция и магния. Ионы Са2+ поступают в воду при растворении известняков под действием содержащейся в воде углекислоты
СаСО3 + СО2 + Н2О <= Са2+ + 2HCO3
и при непосредственном выщелачивании водой гипса.
Основным источником ионов магния служат доломиты, также растворяющиеся водой в присутствии углекислоты
СаСО3 • MgCO3 + 2СО2 + 2Н2О <= Са2+ + Mg2+ + 4HCO3
Хотя указанные соли и не являются особо вредными для организма, наличие их в воде в больших количествах нежелательно, так как вода становится непригодной для хозяйственно-бытовых нужд и промышленного волоснаб-жения. В жесткой воде плохо развариваются овощи, перерасходуется мыло при стирке белья. Жесткая вода непригодна для питания паровьи котлов; ее нельзя использовать во многих отраслях промышленности.
Общая жесткость воды представляет собой сумму карбонатной (временной) и некарбонатной (постоянной) жесткости.
Карбонатная жесткость, связанная с присутствием в воде в основном бикарбонатов кальция или магния, почти полностью удаляется при кипячении воды. Бикарбонаты при этом распадаются с образованием углекислоты, в осадок выпадают карбонаты кальция и гидроокись магния.
Некарбонатная жесткость обусловливается присутствием кальциевых и магниевых солей серной, соляной и азотной кислот и кипячением не устраняется.
Жесткость воды представляет сумму эквивалентных концентраций ионов Са2+ и Mg2+ и выражается в миллиграмм-эквивалентах на 1 л. 1 мг-экв/л жесткости отвечает 20,04 мг/л ионов Ca2+ или 12,16 мг/л ионов Mg .
В зарубежных странах жесткость воды измеряется различными единицами. Так, немецкий градус составляет 10 мг СаО в 1 л воды, английский — 10 мг СаСО3 в 0,7 л воды, французский — 10 мг СаСО8 в 1 л воды, американский — 1 мг СаСО3 в 1 л воды. Соотношение между различными единицами жесткости воды приведено в табл. 2.
Железо и марганец. Железо в природных водах может находиться в виде ионов двух- и трехвалентного железа, коллоидов (неорганических — Fe (OH)3, Fe (OH)2, FeS и органических), комплексных соединений (главным образом органических комплексных соединений железа) и тонкодисперсной взвеси (Fe(OH)3, Fe(OH)2, FeS).
В поверхностных водах железо содержится в виде органических комплексных соединений, коллоидов или тонкодисперсных взвесей. В подземных водах при отсутствии растворенного кислорода железо обычно находится в виде двухвалентных солей. Форма, в которой присутствуют в природных водах железо и марганец, зависит от величины рН и содержания кислорода.
Окисление двухвалентного железа в воде с максимальной скоростью происходит при рН > 7, а двухвалентного марганца — при рН > 9.
Образующийся в результате гидролиза и окисления двухвалентного железа гидрат окиси железа малорастворим и благодаря защитному действию гумусовых веществ может присутствовать в природных водах в коллоидном состоянии.
Обычно содержание железа и марганца не превышает нескольких десятков миллиграммов в 1 л воды. Хотя вода, содержащая и более высокие количества этих ионов, совершенно безвредна для здоровья, все же для питьевых, промышленных и хозяйственных целей она непригодна, так как имеет неприятный чернильный или железистый привкус.
Наличие в воде железа и марганца может приводить к развитию в трубопроводах железистых и марганцевых бактерий, использующих в процессе своей жизнедеятельности энергию, выделяемую при окислении закисных соединений в окисные. Продукты жизнедеятельности бактерий накапливаются в таких количествах, что могут значительно уменьшить сечение водопроводных труб, а иногда и полностью их закупорить.
Соединения кремния. Кремний присутствует в природных водах в виде минеральных и органических соединений. Выщелачивание силикатных пород обогащает природные воды кремневой кислотой и ее солями. Кремневая кислота очень слабая и диссоциирует на ионы в незначительной степени
H2Si03 Н+ + HSiO3.
При рН <7 в воде находится только недиссоциированная кремневая кислота. Часть кремния может присутствовать в воде в коллоидном состоянии в виде SiO2 • Н2О или в виде поликремневой кислоты xSiO2 • уН2О. Наибольшее количество кремния находится в подземных водах. В воде поверхностных источников содержание его меньше и колеблется от десятых долей до нескольких миллиграммов в 1 л. Объясняется это тем, что соли кремния являются питательными веществами для многих организмов, населяющих открытые водоемы.
Наличие соединений кремния в питьевой воде не вредно для здоровья. Если же вода используется для питания паровых котлов высокого давления, содержание самого незначительного количества кремневой кислоты недопустимо из-за образования плотной силикатной накипи.
Соединения фосфора. Фосфор встречается в воде в виде ионов ортофосфорной кислоты или органического комплекса, а также в виде взвешенных частиц| органического и минерального происхождения. Соединения фосфора содержатся в природных водах в ничтожных количествах, однако имеют огромное зна-| чение для развития растительной жизни в водоемах.
Растворенные в воде газы. Из растворенных в воде газов наиболее важными! для оценки ее качества являются углекислота, кислород, сероводород, азот и[ метан. Углекислота, кислород и сероводород при определенных условиях прида-( ют воде коррозийные свойства по отношению к бетону и металлам.
Углекислота встречается в больших или меньших количествах всех природных водах. Подземные воды обогащаются углекислотой за счет
разложения органических соединений в воде и почвах, а также вследствие протекающих в глубине геохимических процессов.
Уменьшение содержания СО2 в природных водах может происходить благодаря выделению углекислоты в атмосферу, растворению карбонатных пород с образованием бикарбонатов или в результате фотосинтеза (фотосинтезом называется синтез органических соединений из СО2 и Н2О, протекающий в растениях под воздействием хлорофилла и энергии солнечных лучей).
Содержание углекислоты в природных водах колеблется от нескольких долей до нескольких сотен миллиграммов в 1 л. Наибольшее количество ее находится в подземных водах. В воде поверхностных источников содержание СО2 не превышает 20—30 мг/л.
В зависимости от величины рН воды углекислота встречается в ней в свободном (в виде углекислого газа СО2) или в связанном состояниях (в виде бикарбонат-ионов НСО3 и карбонат-ионов СО32). При рН < 4,0 бикарбонат-ионы в воде отсутствуют и вся углекислота находится в виде углекислого газа. При рН 8,4 в воде содержатся преимущественно ионы НСО3, а при рН > 10,5 — только ионы СОз2.
Ионы бикарбоната — наиболее распространены в природных водах. В некоторых случаях содержание их достигает 1200 мг/л. Для поддержания высоких концентраций ионов бикарбоната необходимо большое количество СО2. Однако это не реально в поверхностных водах, поэтому в реках и пресных озерах содержание НСО3 не превышает 300 мг/л. Наиболее устойчивы в речной воде ионы НСО3 в концентрации 50—70 мг/л. Содержание СО32 ионов в воде, за исключением содовых вод, невелико и определяется растворимостью карбоната кальция.
Находящиеся в воде ионы НСОз, СОз2 и углекислый газ связаны так называемым углекислотным равновесием
СО2 + Н2О <= H2CO2 H+ + HCO3 2H+ + CO32
При наличии ионов Ca2+ углекислотное равновесие выражается уравнением
Са2+ + 2НСО3 СаСО3 + СО2 + Н2О.
По закону действующих масс константа равновесия этой реакции

Если учесть, что концентрации [H2OJ и |СаСО3] — постоянные величины и могут быть введены в константу, а [Са2+] = 2 [НСО3], то

Из этого выражения видно, что бикарбонат-ионы существуют в растворе только при наличии свободной углекислоты. Часть свободной углекислоты, находящейся в равновесии с бикарбонатами, называется равновесной. Она как бы связана с бикарбонатами и поэтому не вступает в химические реакции
Избыточная свободная углекислота в отличие от равновесной очень активна и носит название агрессивной. Однако не вся она агрессивна: одна часть избыточной свободной углекислоты, действуя на углекислый кальций, превращает его в бикарбонат, а другая идет на увеличение количества равновесной углекислоты для удержания в растворе вновь образовавшихся количеств бикарбоната.
В водах открытых водоемов из-за низкого содержания углекислоты в воздухе присутствие агрессивной углекислоты маловероятно. В подземных водах содержание агрессивной углеки-1 слоты иногда бывает весьма
з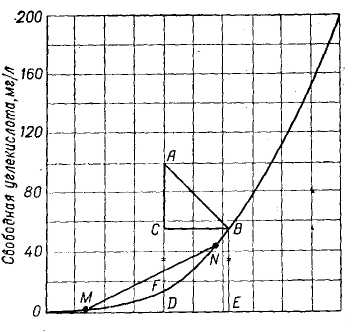 начительным.
начительным.
Рис. 7. Графическое определение содержания агрессивной углекислоты в воде.
40
80 120 160
200
Обязанная
углекислота :мг/л
Для определения агрессивной углекислоты в воде можно пользоваться кривыми равновесия связанная углекислота — свободная углекислота (рис. 7). Зависимость справедлива для какой-то определенной температуры воды. В случае температур она будет выражаться семейством кривых подобного рода.
Точки, лежащие на кривой MB, характеризуют количество свободной углекислоты, находящейся в равновесии с бикарбонатной углекислотой. Точки выше равновесной кривой соответствуют агрессивным водам, точки ниже кривой — водам, пересыщенным карбонате кальция.
На основании приведенного графика количество агрессивной углекислота определяют следующим образом. Допустим, что в растворе имеется 180 мг/л
углекислоты, из них 80 мг/л составляет связанная углекислота, 100 мг/л — свободная (рис. 7, точка А). 80 мг/л связанной углекислоты удерживается в води при наличии 11,5 мг/л равновесной (FD) Так как содержание свободной углекислоты равно 100 мг/л, в системе имеется избыток свободной углекислоты, част которой пойдет на растворение углекислого кальция, приводя к установлении равновесия. Этому равновесию на кривой отвечает точка, в которой количеств связанной и равновесной углекислоты должно, очевидно, равняться 180 мг/л. Такую точку легко найти графическим путем, проведя из точки А прямук под углом 45° к оси абсцисс до пересечения с кривой. В равенстве AD + DO = BE + Е0 легко убедиться. При установившемся равновесии количество раЕ новесной углекислоты соответствует отрезку BE. Количество агрессивной угле кислоты находим, проводя из точки В прямую, параллельную оси абсцис до пересечения с AD. Таким образом, отрезок CD соответствует равновесной углекислоте, а АС — агрессивной.
При увеличении в воде концентрации бикарбонатов количество необходимой равновесной углекислоты значительно повышается. Следовательно, вероятность наличия агрессивной углекислоты больше для мягких, чем для жестких вод.
При оценке агрессивности воды наряду с концентрацией агрессивной углекислоты следует учитывать солевой состав воды в связи с тем, что углекислотное равновесие зависит, как уже отмечалось, и от общего содержания солей. При увеличении содержания солей в воде количество свободной углекислоты необходимое для поддержания углекислотного равновесия, уменьшается. По этому при одном и том же содержании свободной углекислоты вода наличии большего количества солей будет более агрессивной.
Смешение двух или нескольких неагрессивных вод в результате смещений углекислотного равновесия может привести к появлению агрессивности. Воды состава М и N (см. рис. 7) не агрессивны, их смеси, состав которых определяется прямой MN, агрессивны.
Значительное нарушение углекислотного равновесия воды происходит при очистке природных вод коагулированием, так как введение каждого миллиграмма безводного сульфата алюминия или хлорного железа сопровождает выделением 0,8 мг свободной углекислоты.
Агрессивные свойства углекислоты основаны на ее способности взаимодействовать с карбонатными породами и переводить их в растворимые в воде бикарбонаты, а также на некотором снижении рН среды, в результате чего усиливается электрохимическая коррозия некоторых металлов, например железа.
Действие углекислоты на бетон сводится к растворению извести цемента, Что значительно ослабляет прочность бетона. Удаление извести нарушает равновесие и приводит к разложению других составных частей цемента, в частности силикатов и алюминатов кальция. На этом же процессе основано и коррозионное действие воды, содержащей углекислоту, по отношению к металлическим трубам.
Углекислота не является коррозионным агентом, непосредственно воздействующим на металл. Действие ее заключается в растворении карбонатов составных частей ржавокарбонатных отложений, которые образуются в водопроводной сети. В результате этого процесса происходит дальнейшая коррозия материала труб и образование новых отложений; вода приобретает желтую или красноватую окраску, неприятный вкус и содержит мелкие комья рыхлых железистых веществ.
Коррозионные отложения в водопроводных трубах, обладающие значительной адсорбционной способностью, поглощают остаточный хлор, снижая этим эффект обеззараживания. Наличие в трубопроводах соединений железа (II), которые образуются в результате разрушения материала труб, способствует развитию железобактерий, жизнедеятельность которых связана с процессом окисления железа. Присутствие в воде агрессивной углекислоты значительно ухудшает работу очистных сооружений за счет усиленного зарастания отстойников синезелеными водорослями и засорения фильтров пузырьками газа.
Кислород может находиться в природных водах в различных концентрациях (0—14 мг/л), что определяется интенсивностью противоположно направленных процессов, влияющих на содержание кислорода в воде. Обогащение воды кислородом происходит за счет растворения его из воздуха (в соответствии с парциальным давлением кислорода и температурной воды) и выделения водной растительностью в процессе фотосинтеза. Парциальным давлением называется давление, которое оказывал бы входящий в смесь газ, если бы он один занимал объем смеси при той же температуре.
Окисление некоторых примесей воды, гниение органических остатков, брожение, дыхание организмов понижают содержание кислорода в воде. Резкое уменьшение содержания кислорода в воде по сравнению с нормальным свидетельствуют о ее загрязнении.
Определение концентрации кислорода имеет большое значение при изучении физико-химического режима водоема, его самоочищения и биологической жизни.
Кислород интенсифицирует процессы коррозии металлов, поэтому в водах, которые используются для теплоэнергетических систем, количество растворенного кислорода лимитируется.
Как известно, коррозионные процессы в железе вызываются микрогальваническими парами, возникающими за счет имеющихся в металле примесей (например, углерода) или неоднородности обработки различных участков. Процесс коррозии железа можно представить следующими уравнениями:
на аноде — разрушение металла и образование избыточных электронов
2Fe — 4е = 2Fe2+;
на катоде в щелочных растворах (с которыми в большинстве случаев приходится иметь дело в практике водоподготовки) при наличии в воде растворенного кислорода идет ионизация кислорода с образованием гидроксильных ионов
О2 + 4е + 2Н2О 4ОН.
(С изменением рН меняется характер процесса. Так, с уменьшением рН на катодных участках вместо ионизации кислорода может начать выделяться газообразный водород: 2Н+ + 2е = Н2).
Таким образом, растворенный в воде кислород является стимулятором процессов коррозии. Однако при больших концентрациях кислорода возможно обратное явление — прекращение коррозии вследствие пассивации поверхности за счет образования окисных пленок.
Ионы Fe2+, реагируя с гидроксильными ионами воды, образуют гидрат закиси железа
Fe2+ + 2ОН = Fe (OH)2,
который под действием кислорода в присутствии влаги переходит в гидрат окиси
4Fe (ОН2) + 2Н2О + О2 = 4Fe (OH)3.
В дальнейшем гидрат окиси железа образует ржавчину
mFeO (H2O)P + nFe2O3 (НаО)q.
Сероводород попадает в природные воды в результате их соприкосновения с гниющими органическими остатками (сероводород органического происхождения) либо с некоторыми минеральными солями (гипсом, серным колчеданом и др.). Последние, восстанавливаясь и разлагаясь, выделяют сероводород (сероводород неорганического происхождения).
Наличие в воде сероводорода органического происхождения свидетельствует о загрязненности водоисточника. Обычно содержание сероводорода в природных водах не превышает нескольких десятков миллиграммов на 1 л. В поверхностных источниках присутствие сероводорода маловероятно, так как он легко окисляется. Иногда сероводород встречается в придонных слоях поверхностных источников.
В связи с ухудшением органолептических показателей воды, развитием серобактерий и интенсификацией процессов коррозии сероводород необходимо удалять из воды, используемой для хозяйственно-питьевого или промышленного водоснабжения.
Азот попадает в природные воды при поглощении его из воздуха, восстановлении соединений азота денитрифицирующими бактериями, а также в результате разложения органических остатков. Несмотря на меньшую по сравнению с кислородом растворимость азота содержание последнего в природных водах большее благодаря более высокому парциальному давлению его в воздухе.
Метан образуется в воде иногда в очень значительных количествах при разложении микробами клетчатки растительных остатков. Количество метана в природной воде может достигать 30 мг/л.
Микроэлементы. Наряду с органическими и минеральными примесями и загрязнениями, которые находятся в природных водах в относительно больших количествах, в последних содержится ряд химических элементов в самых ничтожных дозах (йод, бром, бор, фтор, селен и теллур и др.). В отличие от других примесей природных вод эти элементы почти не контролируются, хотя в настоящее время установлено, что они оказывают большое влияние на здоровье человека.
Для нормальной жизнедеятельности человеческого организма содержание перечисленных элементов в воде должно находиться в строго определенных пределах. При нарушении этих пределов могут возникать массовые заболевания, называемые геохимическими эндемиями. Например, установлена суточная потребность организма в йоде и фторе. Человек ежесуточно должен потреблять 0,06—0,10 мг йода. Отсутствие или недостаток его в питьевой воде и пище нарушают нормальную деятельность щитовидной железы и приводит к тяжелому заболеванию — эндемическому зобу.
Содержание фтора в питьевой воде должно находиться в пределах 0,7— 1,5 мг/л. Недостаточное или избыточное содержание его в воде одинаково вредно и вызывает разрушение зубов и изменения в костях скелета.
Радиоактивные элементы. К примесям природных вод относятся и радиоактивные элементы. Радиоактивность в той или иной мере свойственна всем водам. Допустимым пределом радиоактивности в обычной питьевой воде считается 108—109 мкКи/л. Радиоактивность некоторых минеральных вод достигает 2,8 • 103 мкКи/л (Кюри (Ки) = 3,7 • 1010 с 1)
Большое содержание урана и общая радиоактивность обнаруживается в воде рек, русла которых дренируют карнатиты (карнатит — радиоактивный минерал, отлагающийся в песчаниках, известняках и глинах). За последние годы усилилась опасность внешнего загрязнения природных вод радиоактивными элементами. Так, радиоактивность, являющаяся следствием испытаний атомного оружия, была отмечена в период дождей в Индии, Японии, Франции, США и других странах. Атомные реакторы, построенные в Америке до 1964 г., ежедневно дают свыше 400 000 м3 сточных вод с высокой радиоактивностью.
Ядовитые вещества попадают в воду с промышленными отбросами и канализационными стоками населенных пунктов, а также при умышленном отравлении водоема. Токсическая концентрация (токсической концентрацией называется такая концентрация ядовитых и отравляющих веществ, при которой происходит отравление человеческого организма) таких веществ обычно достигается уже при содержании их в количестве нескольких миллиграммов (редко одного-двух десятков миллиграммов) в 1 л воды. К этой группе веществ относятся свинец, цинк, медь, мышьяк, ртуть и др., а также органические вещества, называемые отравляющими (ОВ).
Свинец, медь и цинк попадают в воду главным образом с промышленными стоками. Наиболее ядовитым из этих металлов является свинец, который накапливается в организме и может вызвать опасное отравление.
Вода, подаваемая населению, не должна содержать более 0,1 мг/л свинца, 1 мг/л меди и 5 мг/л цинка. Определение содержания этих металлов требуется лишь в тех случаях, когда предполагается наличие их в источнике водоснабжения.
Мышьяк в очень небольших концентрациях может поступать в воду из почв, содержащих его соли. В значительных количествах он был обнаружен в некоторых минеральных водах. В открытые водоемы мышьяк попадает со сточными водами населенных пунктов и промышленных предприятий (от дубильных цехов кожевенных заводов, красильных, ситцепечатных фабрик, металлообрабатывающих заводов и т. д.).
Известны отравляющие вещества самого различного действия, однако, попадая в воду, они ведут себя в основном как общеядовитые. На зараженность воды отравляющими веществами могут указывать некоторые внешние признаки и данные обычных методов контроля, так как наличие ОВ вызывает изменение многих показателей воды, например рН, окисляемости, хлоропоглощаемости, содержания хлоридов и растворенного кислорода, а также данные биологических и бактериологических исследований. Поэтому все эти показатели в условиях отравления воды ОВ должны определяться и фиксироваться систематически.
