
- •Глава I вода, ее состояние и роль в природе
- •1.1. Физико-химические свойства воды
- •1.2. Характеристика источников водоснабжения
- •1.3 Физические и химические показатели качества воды.
- •1.3.1 Характеристика физических показателей качества воды
- •XII I II III IV V VI VII VIII IX X Месяцы
- •1.3.2 Характеристика химических показателей качества воды
- •1.4 Биологические и бактериологические показатели качества воды
- •1.4.1 Характеристика водоема по биологическим показателям
- •1.4.2.Характеристика бактериологических показателей качества воды
- •1.5 Классификация примесей и загрязнений на основе их фазово-дисперсного состояния.
- •1.5.1 Классификация примесей и загрязнений воды
- •1.5.2. Физико-химическая характеристика дисперсных и растворимых примесей воды
- •1.5.3.Физико-химическая характеристика различных групп примесей и загрязнений воды
- •1.6.Требования к качеству воды, используемые в различных отраслях промышленности.
- •1.6.1.Использование воды в промышленности.
- •1.6.2. Требования к качеству воды различного назначения .
Глава I вода, ее состояние и роль в природе
1.1. Физико-химические свойства воды
Вода — самое распространенное вещество на Земле: 3/4 поверхности земного шара покрыты морями, океанами, озерами, реками, ледниками. Кроме того, вода в больших количествах пропитывает земную кору и концентрируется в ней в виде подземных слоев, от которых берут начало многочисленные источники и ключи. Общее количество воды на земле составляет примерно 1500 млн. км3 (1,45 - 1018 м3).
По современным данным водные ресурсы земного шара слагаются из воды:
морей и океанов — 1350 млн км3 (1,35 • 1018 м3) с минерализацией примерно 35 г/л;
полярных ледников — 30—50 млн. - км3 (3,5 • 1016 м3) пресной, но недоступной для использования;
рек и озер — 0,4 млн. км3 (4 • 1014м3) пресной и доступной для использования;
подземной, залегающей до глубины 800 м — 4 млн. км3 (4 • 1015 м3) и до 1600 м — 4 млн. км3 (4 • 1015 м3) пресной или минерализованной .
Таким образом, моря и океаны содержат более миллиарда кубических километров воды, что составляет 1/4В00 часть массы Земли. Их средняя глубина 3800 м, т. е. равна 1/1М0 части радиуса земного шара. Эти данные П. Черниа (1959) свидетельствуют о том, что мировой океан, хотя и представляется огромным, но по сравнению с массой всей планеты запасы воды незначительны, а по качеству в основном непригодны для питья. Вода в небольшом количестве входит в состав кристаллических пород земли, в виде росы и тумана собирается на поверхности суши, в виде паров, туч и облаков концентрируется в нижних слоях атмосферы. Она является основой биосферы и необходимым строительным материалом клеток растений и живых организмов.
В природе вода находится в постоянном круговороте. С поверхности водоемов и почвы, с листьев растений она поднимается в виде паров, образуя облака и тучи, а затем в виде дождя и снега вновь возвращается на поверхность земли. Выпавшие осадки частично испаряются, стекают обратно в открытые водоемы, просачиваются в почву, перемещаясь под землей и выходя на поверхность через колодцы, буровые скважины, ключи и т. д.
В земных глубинах вода выполняет огромную работу, разрушая породы и минералы, растворяя соли, перекристаллизовывая осадки. Она принимает непосредственное участие в большинстве химических процессов, происходящих на земной поверхности.
С тех пор, как на Земле появилась вода, стала возможной жизнь, так как именно в водной среде зародилось живое органическое вещество.
Что такое вода? Достаточно ли значительны ее запасы на земле, чтобы удовлетворять неуклонно растущие потребности, и каково должно быть ее качество, чтобы она могла полноценно служить человеку? Вот вопросы, которые все с большим вниманием обсуждаются в литературе, на международных симпозиумах и т. д.
Согласно взглядам Бойля, Галлея и Лавуазье, первоначально все водоемы состояли из пресной воды, а соли в них вносились реками в течение длительных геологических периодов. Однако эта гипотеза неубедительна, ей противоречит тот факт, что количественный состав солей морской воды значительно отличается от состава солей, находящихся в пресных водах.
В морской воде содержится 89% хлоридов, 10% сульфатов и 0,2% карбонатов, а в пресных водах — 80% карбонатов, 13% сульфатов и 7% хлоридов. Вода закрытых морей, таких как Каспийское, не является типично морской. Она значительно менее солена и содержит в три раза больше карбонатов, чем вода океанов. По современным понятиям соленость воды морей и океанов является «первичной», не изменявшейся в течение геологических периодов.
В течение долгого времени считали, что вода — простое вещество. Первые попытки научно подойти к вопросу о природе воды относятся к 1783 г., когда Макэр установил, что в процессе сжигания водорода образуются капельки воды. Первые опыты получения воды в результате соединения водорода и кислорода при возникновении электрической искры были проведены английским физиком Кэвендишем.
Лавуазье и Лаплас пришли к выводу, что «вода не является простым веществом, она состоит из равных массовых частей воспламеняющегося воздуха и жизненного воздуха» (из водорода и кислорода). В 1785 г. Лавуазье и Менье в результате опытов по разложению и синтезу воды установили, что 2 г водорода соединяются с 16 г кислорода. Образование воды из двух объемов водорода и одного объема кислорода было доказано в 1805 г. Гумбольдтом и Гей-Люссаком. Ими была предложена классическая формула воды — Н2О и определена ее молекулярная масса — 18.
Найденное Берже и Менцелем различие между атомной массой водорода, определяемой химическими методами и рассчитанной с помощью масс-спектрометра, поколебало представления о сравнительно простом строении воды. Для объяснения этого расхождения исследователи предположили существование изотопа водорода с массой, равной 2. Это был дейтерий: Н2, или D. Вскоре Уотбэрн и Юри открыли тяжелую воду D2O, а затем обнаружили третий изотоп водорода — тритий Н3, или Т. В 1951 г. была получена сверхтяжелая вода (Т2О), которая представляет собой окись слаборадиоактивного трития. Существует также и полутяжелая вода HOD.
Наряду с присутствующими в природных условиях тремя изотопами водорода Н1, Н2, Н3 и искусственно полученными короткоживущими Н4 и Н5, известно девять изотопов кислорода: Oi3, О14, О15, О18, О17, О18, О19, О20 и О24. Таким образом, соединение, которое мы называем водой, представляет собой 135 изотопных разновидностей воды.
Основную массу воды составляют молекулы НгО16 (99,73 мол.%) и лишь 0,27 мол.% приходится на долю восьми стабильных изотопов (НаО17, НгО18, Н^О18, Н^О17, Н^О18, D2O16, D2O17, D.2O18). В молекуле воды, находящейся в свободном (и невозбужденном) состоянии, расстояние между ядрами атомов водорода и кислорода равно 0,9568 А, угол между направлениями своязей составляет 105°03', расстояние между ядрами атомов водорода — 1,54 А. Под влиянием взаимодействия молекулы воды с соседними молекулами или ионами эти параметры могут несколько изменяться. На внешней электронной оболочке атома кислорода находятся шесть электронов, два из которых, будучи неспаренными, участвуют в образовании ковалентной связи с атомами водорода, а остальные четыре представляют собой две неподеленные электронные пары.
При образовании молекулы воды происходит гибридизация атомных ор-биталей кислорода, в результате чего вместо отдельных облаков электронов, находящихся на различных энергетических подуровнях, возникают четыре гибридных (смешанных) электронных облака (sp3-гибридизация). При этом два гибридных облака, участвующих в образовании ковалентной связи, вытягиваются в направлении атомов водорода, чем обеспечивается более полное перекрывание валентных орбиталей. В результате того, что плотность электронных облаков, участвующих в образовании О—Н-связей, оказывается выше вблизи электроотрицательного атома кислорода, в местах расположения протонов возникают эффективные положительные заряды. Неподеленные пары электронов, находящиеся на гибридных орбиталях, не участвующих в образовании ковалентной связи, создают сравнительно большую величину электронной плотности в противоположной части молекулы, способствуя появлению двух полюсов отрицательных зарядов. Таким образом, в молекуле воды образуются четыре полюса зарядов, расположенных в вершинах несколько искаженного тетраэдра (искажение тетраэдра, т. е. отличие валентного угла Н—О—Н от тетраэдрического, связано с рассмотренной неравноценностью электронной плотности облаков).
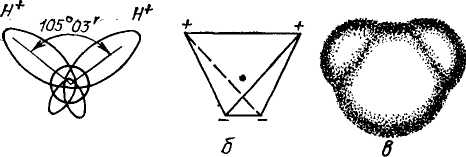
Рис. 1. Строение молекулы воды:
а — угол между связями О — Н;
6 — расположение полюсов заряда;
в — структура электронного облака молекулы.
Схематическое строение молекулы воды представлено на рис. 1. В соответствии с ним ядра водорода — протоны — оказываются почти полностью погруженными в электронное облако кислорода. Расстояние между ядром кислорода, находящимся во центре молекулы, и протоном у льда равно 0,99 А, у водяного пара — 0,958 А, радиус молекулы составляет 1,38 А.
Вследствие указанной несимметричности распределения электрических зарядов почти шарообразная молекула воды обладает ярко выраженными полярными свойствами, дипольный момент 1,86 дебая (диполем электрическим называется совокупность двух одинаковых по величине и про- тивоположных по знаку электрических зарядов, находящихся на некотором расстоянии один от другого. 1 дебай = 10 абс. эл.-ст. ед.) Этим, а также высокими донорно-акцепторными свойствами, объясняется ее способность растворять многие вещества.
Результаты определения молекулярной массы водяного пара указывают на то, что ему соответствует простейшая формула — Н2О. Наоборот, в жидком состоянии вода ассоциирована, т. е. наряду с простыми молекулами содержит и более сложные образования, соответствующие общей формуле (H2O)X. Подобные молекулярные агрегаты все время возникают и распадаются, что можно выразить следующей схемой: хН2О <^ (H2O)^.
При нагревании воды степень ее ассоциации уменьшается. Молекулы, обладающие постоянными диполями, могут за счет взаимного притяжения противоположных полюсов комбинироваться по две, по три и т. д. Однако действующие при этом силы притяжения невелики, и в данном случае подобная диполь-ная ассоциация играет второстепенную роль.
Таблица 1.
Физико-химические константы воды.
Температура, °С |
|
Критическое давление, бар |
221,43 |
замерзания (101 325 Н/м2) |
0,00 |
плотность, кг/м3 |
325,00 |
кипения (101 325 Н/м2) |
100,00 |
Теплота плавления при |
332,40 |
максимальной плотности |
3,98 |
нормальных условиях, кДж/кг |
|
Критическая температура, °С |
374,15 |
Теплота сублимации льда, кДж/кг |
2834,00 |
Удельная теплоемкость |
|
Криоскопическая константа |
1,850 |
(101 325 Н/м2), кДж/кг • град |
|
Эбулиоскопическая константа |
0,516 |
льда (0° С) |
2,039 |
Теплоемкость (25° С), Дж/моль |
76,070 |
воды (15° С) |
4,187 |
Теплота образования (Н, газ, |
|
водяного пара (100° С) |
2,039 |
101 325 Н/м2, 25° С), кДж/моль |
241,989 |
Ср/С0 (15° С) |
1,32 |
Теплота плавления (101 325 |
|
Удельная теплопроводность, |
|
Н/м2), кДж/моль |
6,012 |
Вт/м • град |
|
Теплота испарения |
|
льда (0°С) |
2,34 |
(101 325 Н/м2), кДж/моль |
44,041 |
воды (45° С) |
0,645 |
Энтропия (S, газ 101 325 Н/м2, |
|
пара (100° С) |
0,0231 |
25° С), Дж/моль град |
188,846 |
Скорость распространения |
1,496 |
Свободная энергия (F газ, |
|
звука (при 25° С), м/с |
101 325 Н/м2), кДж/моль |
228,750 |
Особое значение для ассоциации молекул воды имеют водородные связи, образующиеся между водородом одной молекулы и кислородом другой:
О—Н О—Н
Н Н
По сравнению с внутримолекулярными химическими связями, энергия которых измеряется десятками килокалорий на 1 моль, водородные связи более слабые (4—5 ккал/моль), поэтому возникающие ассоциаты молекул воды сравнительно неустойчивы, легко разрушаются и образуются вновь, обусловливая обратимый характер ассоциации.
Представления об образовании водородных связей лежат в основе многочисленных структурных моделей жидкой воды. Согласно донорно-акцепторной теории водородной связи, каждая молекула воды способна образовывать четыре водородные связи: две из них обеспечиваются неподелен-ными парами электронов атома кислорода и две — водородными атомами. Поскольку электронные орбитали в молекуле воды создают тетраэдрическую структуру, при образовании водородных связей возникает упорядоченное расположение молекул воды в виде тетраэдрически координированной льдоподобной решетки (рис. 2).
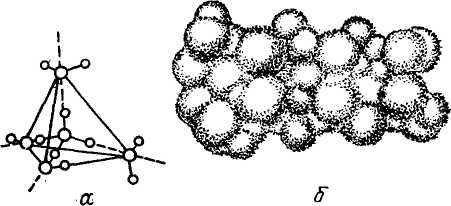
Рис 2. Тетраэдрическое расположение молекулы воды (а) в гексагональной решетке льда (б).
Льдоподобную структуру жидкой воды впервые предложили Бернал и Фаулер. Они с помощью рентгеноструктурного анализа исследовали расположение молекул воды при различных температурах и установили, что наряду с тетраэдрически координированными молекулами воды в ней существуют и мономеры, находящиеся в плотной упаковке, характерной для простых жидкостей.
Двухструктурная модель воды получила развитие в трудах многих исследователей. Кроме моделей воды с льдоподобным тетраэдрическим каркасом и находящимися в равновесии с ним мономерными молекулами воды, были предложены модели, в соответствии с которыми тетраэдрически связанные молекулы воды образуют рои определенных размеров. Рои отделены друг от друга пространствами, заполненными мономерными молекулами воды.
Представлениям о двух существенно разных энергетических состояниях молекул в жидкой воде соответствует и модель, предложенная О. Я. Самойловым. В ней рассматривается существование льдоподобных каркасов, полости которых частично заполнены молекулами воды.
В
результате теплового движения молекулы
приобретают с пособность
к трансляционному переходу в полостях
каркаса от одного положения равновесия
к другому. С повышением температуры
степень заполнения полостей
каркаса молекулами воды увеличивается.
пособность
к трансляционному переходу в полостях
каркаса от одного положения равновесия
к другому. С повышением температуры
степень заполнения полостей
каркаса молекулами воды увеличивается.
Совершенствуя модель О. Я. Самойлова, Ю. В. Гуриков пришел к выводу, что мономерные молекулы, находящиеся в полостях, могут образовывать с молекулами каркаса водородные связи. В этой работе, а также в работах других исследователей развиваются представления о сильных и слабых водородных связях в структуре воды, что позволяет объяснить экспериментальные данные, согласно которым концентрация мономерных молекул в воде очень мала (при температурах от 0 до 100° С она не превышает 1 %).
В основе всех рассмотренных моделей лежит представление о подобии структуры жидкой воды тетраэдрической структуре льда. Однако, несмотря на то, что существование такого подобия подтверждено экспериментально, основанные на нем модели воды не в состоянии объяснить многих опытных данных. Поэтому в последние годы все большее значение придается роли нететраэдриче-ских водородных связей в структуре воды, которые рассматриваются как «третий» элемент в дополнение к льдоподобным образованиям и мономерным молекулам. Высказываются также соображения об образовании в воде не трехмерных каркасов, а линейных кольцевых структур [14]. При этом кольца, состоящие из разного числа молекул, могут объединяться, образуя более сложные ас-социаты.
Как следует из приведенных данных, вопрос о структуре жидкой воды еще далек от своего разрешения. Вместе с тем развитие этих представлений помогает понять многие аномальные свойства воды, ее поведение в экстремальных условиях, а также особенности взаимодействия воды как растворителя с другими веществами.
Аномалии, обусловленные ассоциацией молекул воды, проявляются в ряде ее свойств. Так, для воды характерна наименьшая летучесть (несмотря на то, что у соединений водорода с элементами подгруппы кислорода она возрастает при переходе от тяжелых элементов к легким), максимальная плотность при температуре 3,98° С, аномально высокие теплота плавления и удельная теплоемкость, а также температуры плавления и кипения по сравнению с анологичными водородными соединениями элементов подгруппы кислорода.
Вода кипит под атмосферным давлением при 100° С и замерзает при температуре ниже 0° С. Температуры кипения и замерзания воды аномальны, вследствие наличия молекулярных ассоциаций. Если бы их не существовало, то точка кипения воды равнялась бы примерно —70° С, а точка замерзания составляла —90° С. Жидкую воду всегда считают идеальным типом текучего тела и в то же время «это жидкость, еще сохранившая воспоминания о кристаллической структуре льда, из которого она произошла» (К- Дюваль).
Вода обладает наибольшим поверхностным натяжением из всех известных жидкостей, за исключением ртути. Вязкость воды быстро уменьшается при повышении температуры и давления, а изменение ее теплоемкости в зависимости от температуры имеет аномальный характер (при повышении температуры теплоемкость сначала понижается и лишь затем начинает возрастать).
Некоторые аномалии свойств воды имеют большое практическое значение (табл. 1). В первую очередь это относится к свойству воды приобретать максимальную плотность при температуре 3,98° С, благодаря чему даже в самое холодное время года в водоемах сохраняется жизнь, так как образовавшийся при охлаждении слой льда защищает водоемы от глубокого промерзания. Не меньшее значение имеет и аномально большая теплоемкость воды, из-за которой в зимнее время массы воды медленно остывают, а летом постепенно нагреваются, являясь таким образом регулятором температуры на земном шаре. Поверхностное натяжение и плотность воды определяют высоту, на которую она может подниматься по капиллярам. Это свойство обеспечивает движение воды в стеблях растений и стволах деревьев, другими словами — их жизнь.
Таблица 2.
Аномальные физические свойства воды
Свойство |
Сравнительная характеристика |
Роль в физических явлениях и технических процессах |
|||
Летучесть |
Наименьшая среди соединений водорода с элементами подгруппы кислорода |
Медленная потеря влажности различными материалами |
|||
Плотность |
Наибольшая при 3,98° С, при дальнейшем охлаждении уменьшается, и вода переходит в лед |
Регулирует температуру воды по глубине водоемов |
|||
Фазовые переходы |
По сравнению с аналогичными соединениями других элементов VI группы температура плавления воды должна быть примерно — 90° С, а температура кипения —70°С |
Определяют термодинамику производственных процессов, протекающих в водной среде |
|||
Теплота плавления |
Наиболее высокая, за исключением аммиака |
Термостатирующий эффект в точке замерзания |
|||
Теплота испарения |
Наиболее высокая из всех известных веществ |
Очень важно для теплового и водного переноса в атмосфере. Большие затраты тепла на испарение в производственных процессах; экономия возможна за счет утилизации тепла, выделяющегося при конденсации пара |
|||
Теплоемкость |
Наиболее высокая из всех твердых и жидких веществ, за исключением аммиака |
Термостатирующий эффект в технологических процессах, перенос тепла водными течениями в природе, способствует сохранению постоянной температуры тела |
|||
Теплопроводность |
Наиболее высокая из всех жидкостей |
Определяет режим в теплообменной аппаратуре, а также регулирует течение биологических процессов |
|||
Вязкость |
Уменьшается с повышением давления в противоположность наблюдающемуся обычно у других веществ увеличению в интервале 0—30° С; при этих же температурах аномально быстро снижается при нагревании |
Определяет гидродинамику водных потоков и седиментацию взвешенных веществ |
|||
Поверхностное натяжение |
Наиболее высокое из всех жидкостей |
Определяет поверхностные явления в технологии |
|||
Диэлектрическая проницаемость |
Наиболее высокая из всех жидкостей |
Влияет на диссоциацию электролитов |
|
||
При температуре ниже 0° С вода затвердевает и в зависимости от условий образует лед, снег или иней. В твердой фазе она имеет шесть аллотропных форм, одна из которых —обычный лед — легче жидкой воды (плотность при 0° С равна 0,916). В последнем случае, по Берналу и Фаулеру, каждая молекула воды имеет четырех соседей, с которыми она соединена водородными связями. Это приводит к образованию ажурной конструкции с каналами, окруженными шестью молекулами воды. Поперечник каналов в местах их расширения превышает диаметр молекулы воды.
При плавлении льда кроме исчезновения связей дальнего порядка происходит разрушение связей ближнего порядка, в результате чего некоторые молекулы приобретают большую свободу и проваливаются в полости, которыми богата ажурная структура льда. Этим объясняется сжатие льда при плавлении и нагревании до 4° С. При температуре 0° С количество молекул, утративших свои связи с соседями, равно 9—15%. При переходе лед — вода плотность увеличивается примерно на 10%, и можно считать, что данная величина характеризует количество молекул, попавших в пустоты.
Как известно, различия в структуре жидкого и твердого состояния вещества сказываются на его способности к переохлаждению. Для воды, которая может оставаться в переохлажденном состоянии до —30° С и даже до еще более низкой температуры, установлено, что возможное переохлаждение зависит от предыдущей истории жидкости, и до температуры —30° С оно пропорционально предварительному перегреву. Это связано с тем, что в данных условиях в воде время установления равновесного состояния довольно продолжительное.
Квазикристаллическое состояние жидкостей разрешает с известной степенью приближения говорить об их полиморфизме, когда при плавном изменении внешних условий некоторые свойства могут резко изменяться. Такой процесс получил название фазовых переходов второго рода или гомеоморфных превращений. Причина их, как полагают, обусловлена скачкообразным изменением структуры жидкости. Для воды это изменение выражено столь резко, что воду при 25—75° С и вблизи 0° С можно рассматривать как два различных по своей природе растворителя. По данным Фите и Айве, «вторая точка плавления воды» лежит в интервале температур 30—40° С. Сент-Дьерди считает, что температура около 37° С «выбрана» биологическими системами как температура перехода между двумя разновидностями структуры воды, используемого ими в процессах жизнедеятельности .
Одно из важнейших физико-химических свойств воды состоит в ее способности образовывать растворы. Она является наилучшим растворителем для большого числа твердых соединений, жидкостей и газов.
Вода может быть связана с другими веществами различными способами. В виде кристаллизационной воды ее молекулы входят в состав некоторых соединений, например комплексных соединений кобальта, железа и др. Выделить такую воду можно только разрушив структуру.
Кристаллизационная вода легко выделяется при нагревании и вновь присоединяется к безводному веществу с образованием гидратов. Кристаллические структуры гидратов и безводного вещества отличаются между собой.
Существует пропитывающая вода (в цеолитах, чешуйках опала, глинах), смачивающая (или адсорбционная) вода (на поверхности стекла, кварца, ртути, в полостях пемзы), и, наконец, физиологически связанная вода, находящаяся в тканях живых существ.
Таким образом, как с физической, так и с химической точки зрения вода представляет собой одно из самых сложных веществ, к тому же наиболее трудно выделяемых в чистом виде.
Наличие в молекуле воды двух неподеленных пар электронов делает ее очень реакционноспособной. Инертные газы при низких температурах образуют с водой гидраты. Вода окисляется атомарным кислородом по перекиси водорода. Фтор при обычной температуре выделяет из нее атомарный кислород. При растворении в воде хлора, брома и йода протекает реакция
Н2О + Г2 НГ + НГО.
Щелочные и щелочноземельные металлы (кроме магния) разлагают воду при комнатной температуре; благородные металлы (Ag, Au, Pt) и ртуть с водой не взаимодействуют.
Во многих реакциях вода служит катализатором, а иногда, напротив,-каталитическим ядом. Растворяя окислы, она образует кислоты или щелочи. При взаимодействии ее с солями слабых кислот или слабых оснований происходит гидролиз этих солей. При растворении некоторых веществ в воде в ряде случаев образуются гидраты.
Способность воды растворять различные вещества обусловила многообразие состава природных вод, резко отличающихся друг от друга по своим качественным показателям.
