
- •Вопросы для подготовки к экзамену по курсу "Общая химия"
- •Химия как предмет естествознания.
- •Классы неорганических соединений.
- •Основания.
- •Получение
- •Оксиды Классификация
- •Получение
- •Химические свойства
- •Кислоты.
- •Получение
- •Химические свойства
- •Классификация
- •3. Основные положения атомно-молекулярного учения.
- •Основные законы химии (закон сохранения, постоянства состава, кратных отношений, Авогадро).
- •Закон эквивалентов.
- •Строение атома.
- •Квантовые числа.
- •Принцип Паули.
- •Правило Хунда.
- •Правило Клечковского.
- •11. Периодический закон д.И. Менднлеева.
- •12. Структура периодической системы
- •13. Химическая связь. Виды химических связей. 14.Ионная связь. 15.Ковалентная связь.
- •16. Межмолекулярное взаимодействие
- •17. Комплексные соединения
- •Классификация По заряду комплекса
- •19. Закон Гесса, следствие закона Гесса.
- •20. Скорость гомогенных химических реакций.
- •6.1.1 Зависимость скорости реакции от концентрации веществ
- •6.1.2. Особенности кинетики гетерогенных реакций
- •6.1.3. Зависимость скорости реакции от температуры
- •6.1.4. Уравнение Аррениуса
- •6.1.5. Энергия активации
- •6.1.6. Предэкспоненциальный множитель
- •6.1.7. Зависимость скорости реакции от катализатора
- •6.1.8. Гомогенный катализ
- •6.1.9. Гетерогенный катализ
- •21. Скорость гетерогенных химических реакций.
- •22. Факторы, влияющие на скорость химических реакций.
- •23. Обратные процессы. Химическое равновесие.
- •24. Принцип Ле-Шателье. Влияние параметров реакции на смещение равновесия.
- •27. Растворы неэлектролитов, их общие свойства, способы выражения концентрации.
- •28. Закон Рауля
- •29. Закон Вант-Гоффа.
- •30. Закон генри
- •31. Температура кипения и замерзания растворов.
- •32. Растворы электролитов. Сильные и слабые электролиты.
- •33. Водородный показатель
- •34.Гидролиз солей
- •35. Дисперсные системы и их классификация.
- •36.Строение мицеллы.
- •37. Кристаллическое и аморфное состояние вещества.
- •38. Общие свойства металлов. Стандартный электродный потенциал.
- •39. Методы получения металлов.
- •40. Электролиз. Законы электролиза.
- •41) Гальванические элементы.
- •42) Коррозия металлов.
- •43)Методы защиты от коррозии.
- •44) Сплавы. Основные типы двухкомпонентных диаграмм состония.
- •45) Минеральные вяжущие вещества, их химический состав.
- •46) Классификация органичесих соединений.
- •47. Высокомолекулярные соединения. Процессы полимеризации и поликонденсации.
- •48. Химия s-элемнтов
- •49)Химия р-элементов
- •50)Химия d-элементов
Квантовые числа.
Квантовые числа — энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой он находится.
В 1900 г. Планк показал, что способность нагретого тела к лучеиспусканию обусловлено тем, что лучистая энергия испускается или поглощается не непрерывно, а дискретно, т.е. отдельными порциями – квантами.
E=hλ
В 1905 г. Эйнштейн пришел к выводу, что электромагнитная энергия существует в форме квантов и излучение представляет собой поток неделимых частиц (фотонов), энергия которых определяется по уравнению Планка.
Главное квaнтовое число n определяет общую энергию электрона и степень его удаления от ядра (номер энергетического уровня); оно принимает любые целочисленные значения, начиная с 1 (n = 1, 2, 3, . . .)
Орбитальное (побочное или азимутальное) квантовое число l определяет форму атомной орбитали. Оно может принимать целочисленные значения от 0 до n-1 (l = 0, 1, 2, 3,..., n-1). Каждому значению l соответствует орбиталь особой формы. Орбитали с l = 0 называются s-орбиталями, l = 1 – р-орбиталями (3 типа, отличающихся магнитным квантовым числом m), l = 2 – d-орбиталями (5 типов), l = 3 – f-орбиталями (7 типов).
Магнитное квантовое число m определяет ориентацию орбитали в пространстве относительно внешнего магнитного или электрического поля. Его значения изменяются от +l до -l, включая 0. Например, при l = 1 число m принимает 3 значения: +1, 0, -1, поэтому существуют 3 типа р-АО: рx, рy, рz.
Спиновое квантовое число s может принимать лишь два возможных значения +1/2 и -1/2. Они соответствуют двум возможным и противоположным друг другу направлениям собственного магнитного момента электрона, называемого спином (от англ. веретено). Для обозначения электронов с различными спинами используются символы:
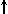 и
и 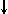 .
.
Принцип Паули.
Сформулированы в 1925 г.
В атоме не может быть двух электронов с одинаковыми значениями всех квантовых чисел.
Два любых электрона в атоме должны отличаться друг от друга, по крайней мере, одним значением квантового числа.
Принцип Паули имеет два следствия:
определение максимально числа электронов на энергетическом уровне
Xn=2n2
определение максимально числа электронов на энергетическом подуровне
X l =2(2l+1)
Распределение электронов в атоме по энергетическим уровням и подуровням изображается в виде электронной формулы:
1s22s22p63s33p63d104s24p64d104f14
Правило Хунда.
Главное квантовое число |
1 |
2 |
3 |
4 |
||||||||
Орбитальное квантовое число |
0 |
0 |
1 |
0 |
1 |
2 |
0 |
1 |
2 |
3 |
||
Буквенное обозначение. |
S |
S |
P |
S |
P |
d |
S |
P |
d |
f |
||
