
- •Вопросы для подготовки к экзамену по курсу "Общая химия"
- •Химия как предмет естествознания.
- •Классы неорганических соединений.
- •Основания.
- •Получение
- •Оксиды Классификация
- •Получение
- •Химические свойства
- •Кислоты.
- •Получение
- •Химические свойства
- •Классификация
- •3. Основные положения атомно-молекулярного учения.
- •Основные законы химии (закон сохранения, постоянства состава, кратных отношений, Авогадро).
- •Закон эквивалентов.
- •Строение атома.
- •Квантовые числа.
- •Принцип Паули.
- •Правило Хунда.
- •Правило Клечковского.
- •11. Периодический закон д.И. Менднлеева.
- •12. Структура периодической системы
- •13. Химическая связь. Виды химических связей. 14.Ионная связь. 15.Ковалентная связь.
- •16. Межмолекулярное взаимодействие
- •17. Комплексные соединения
- •Классификация По заряду комплекса
- •19. Закон Гесса, следствие закона Гесса.
- •20. Скорость гомогенных химических реакций.
- •6.1.1 Зависимость скорости реакции от концентрации веществ
- •6.1.2. Особенности кинетики гетерогенных реакций
- •6.1.3. Зависимость скорости реакции от температуры
- •6.1.4. Уравнение Аррениуса
- •6.1.5. Энергия активации
- •6.1.6. Предэкспоненциальный множитель
- •6.1.7. Зависимость скорости реакции от катализатора
- •6.1.8. Гомогенный катализ
- •6.1.9. Гетерогенный катализ
- •21. Скорость гетерогенных химических реакций.
- •22. Факторы, влияющие на скорость химических реакций.
- •23. Обратные процессы. Химическое равновесие.
- •24. Принцип Ле-Шателье. Влияние параметров реакции на смещение равновесия.
- •27. Растворы неэлектролитов, их общие свойства, способы выражения концентрации.
- •28. Закон Рауля
- •29. Закон Вант-Гоффа.
- •30. Закон генри
- •31. Температура кипения и замерзания растворов.
- •32. Растворы электролитов. Сильные и слабые электролиты.
- •33. Водородный показатель
- •34.Гидролиз солей
- •35. Дисперсные системы и их классификация.
- •36.Строение мицеллы.
- •37. Кристаллическое и аморфное состояние вещества.
- •38. Общие свойства металлов. Стандартный электродный потенциал.
- •39. Методы получения металлов.
- •40. Электролиз. Законы электролиза.
- •41) Гальванические элементы.
- •42) Коррозия металлов.
- •43)Методы защиты от коррозии.
- •44) Сплавы. Основные типы двухкомпонентных диаграмм состония.
- •45) Минеральные вяжущие вещества, их химический состав.
- •46) Классификация органичесих соединений.
- •47. Высокомолекулярные соединения. Процессы полимеризации и поликонденсации.
- •48. Химия s-элемнтов
- •49)Химия р-элементов
- •50)Химия d-элементов
45) Минеральные вяжущие вещества, их химический состав.
Вяжущими веществами назывются материаы, способные при смешивании с водой образовывать пластично-вязкую массу, которая, постепенно затвердевая, превращается в камневидное тело.
По условиям твердения и водостойкости продуктов твердения вяжущие вещества разделяются на воздушные и гидравлические. Воздушные вяжещие твердеют на воздухе, а продукты их твердения нестойки в воде (воздушна известь,гипсовые и магнезиальные вяжущие). Гидравлическиевяжщие твердеют на воздухе , а продукты их твердения длительо сохраняют прочность в воде (гидравлическая известь, портландский, глиноземистый, пуццолановый цементы).
Воздушная известь получают путём обжига карбонатных пород (известняка, мела, доломтизированных известнякв) при темпратуре 1000 - 1200 °С:
СаСО3 → СаО +СО2↑
В результате химической диссоциации СаСО3 разрушаеся кристаллическая решетка кальцита и получается оксид кальция с сильно разрыхлённой структурой. При гашении воздушная известь взаимодействует с одой с выделением большого количества теплоты:
Сао + Н2О → Са(ОН)2 , ΔН° (х.р.) = -35кДж.
Твердение извесково-песчаного раствора происходит в результате крбонизации Са(ОН)2 углекислым газом из воздуха:
Са(ОН)2 + СО2 → СаСO3 + Н2О
Портландский цемент - гидравлическое вяжущее вео, твердеющее и в воде, и в воздухе. Для производства портландцемента используют известняки и глины, которые берутся в соотношении 3:1 (по массе). Химический оств выражаетс в виде оксидов в % мас.:
СаО - 62...68; SiO2 - 18...26; Al2O3 - 4...9; Fe2O3 - 0,3...0,6.
Цементный клинкер представляет собо ситему из нескольких искусственных инералов, полученных при обжиге сырьевой смеси и состоит из тонкозернистых кристаллических и аморфных фаз. Минералогический состав цементного клинкера, % мас.:
3CaO * SiO2 трехкальцевый силикат (алит) - 40...65
2CaO * SiO2 двухкальцевый силикат (белит) - 15...40
3CaO * Al2O3 трёхкальциевый алюминат (целит) - 5...15
4CaO * Al2O3*Fe2O3 четырёхкальциевый алюмоферрит (браунмиллерит) - 10...20
При взаимодействии минелов цементного клинкера с водой происходят и гидролиз и задратация с образованем гидратных соединений:
3Cao * SiO2 + (n+1)H2O→2CaO * SiO2 * nH2O + Ca(OH)2
2Cao * SiO2 + nH2O→2CaO * SiO2 * nH2O
3Cao * Al2O3 + 6H2O→3CaO * Al2O3 * 6H2O
2CaO * Al2O3 * Fe2O3 + (m+6)H2O→3CaO * Al2O3 * 6H2O + CaO*Fe2O3 * mH2O
Магнезиальные вяжущие. Дляих получения используют природный минерал магнезит. Его обжигают при 750-800 С.
MgCO3 → MgO + CO2↑ (каустический манезит)
MgOHCl - магнезиальный цемент (выокя прочность, примерно 28 дней), хотя схватывается быстро. Он лучше других комбинируется с древенисто-волкнистыми веществаи. Самую высокую прочноть имеют кварц, песок и др.
46) Классификация органичесих соединений.
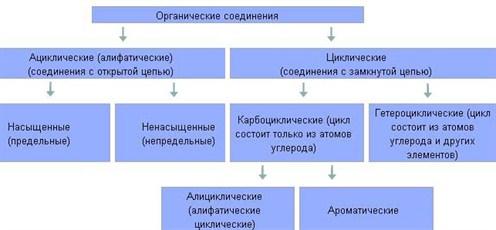
Органических соединений много, но среди них имеются соединения с общими и сходными свойствами. Поэтому все они по общим признакам классифицированы, объединены в отдельные классы и группы. В основе классификации лежат углеводороды – соединения, которые состоят только из атомов углерода и водорода. Остальные органические вещества относятся к «Другим классам органических соединений».
 Углеводороды
делятся на два больших класса: ациклические
и циклические соединения.
Углеводороды
делятся на два больших класса: ациклические
и циклические соединения.
Ациклические соединения (жирные или алифатические) – соединения, молекулы которых содержат открытую (незамкнутую в кольцо) неразветвленную или разветвленную углеродную цепь с простыми или кратными связями. Ациклические соединения подразделяются на две основные группы:
• насыщенные (предельные) углеводороды (алканы), у которых все атомы углерода связаны между собой только простыми связями;
• ненасыщенные (непредельные) углеводороды, у которых между атомами углерода кроме одинарных простых связей, имеются также и двойные, и тройные связи.
Ненасыщенные (непредельные) углеводороды делятся на три группы: алкены, алкины и алкадиены.
Алкены (олефины, этиленовые углеводороды) – ациклические непредельные углеводороды, которые содержат одну двойную связь между атомами углерода, образуют гомологический ряд с общей формулой CnH2n. Названия алкенов образуются от названий соответствующих алканов с заменой суффикса «-ан» на суффикс «-ен». Например, пропен, бутен, изобутилен или метилпропен.
Алкины (ацетиленовые углеводороды) – углеводороды, которые содержат тройную связь между атомами углерода, образуют гомологический ряд с общей формулой CnH2n-2. Названия алкенов образуются от названий соответствующих алканов с заменой суффикса «-ан» на суффикс «-ин». Например, этин (ацителен), бутин, пептин.
Алкадиены – органические соединения, которые содержат две двойные связи углерод-углерод. В зависимости от того, как располагаются двойные связи относительно друг друга диены делятся на три группы: сопряженные диены, аллены и диены с изолированными двойными связями. Обычно к диенам относят ациклические и циклические 1,3-диены, образующие с общими формулами CnH2n-2 и CnH2n-4. Ациклические диены являются структурными изомерами алкинов.
Циклические соединения в свою очередь делятся на две большие группы:
карбоциклические соединения – соединения, циклы которых состоят только из атомов углерода; Карбоциклические соединения подразделяются на алициклические – насыщенные (циклопарафины) и ароматические;
гетероциклические соединения – соединения, циклы которых состоят не только из атомов углерода, но атомов других элементов: азота, кислорода, серы и др.
В молекулах как ациклических, так и циклических соединений атомы водорода можно замещать на другие атомы или группы атомов, таким образом, с помощью введения функциональных групп можно получать производные углеводородов. Это свойство ещё больше расширяет возможности получения различных органических соединений и объясняет их многообразие.
Наличие тех или иных групп в молекулах органических соединений обуславливает общность их свойств. На этом основана классификация производных углеводородов.
К «Другим классам органических соединений» относятся следующие:
Спирты получаются замещением одного или нескольких атомов водорода гидроксильными группами – OH. Это соединение с общей формулой R – (OH)х, где х – число гидроксильных групп.
Альдегиды содержат альдегидную группу (С = О), которая всегда находится в конце углеводородной цепи.
Карбоновые кислоты содержат в своём составе одну или несколько карбоксильных групп – COOH.
Сложные эфиры – производные кислородосодержащих кислот, которые формально являются продуктами замещения атомов водорода гидроокислов – OH кислотной функции на углеводородный остаток; рассматриваются также как ацилпроизводные спиртов.
Жиры (триглицериды) – природные органические соединения, полные сложные эфиры глицерина и односоставных жирных кислот; входят в класс липидов. Природные жиры содержат в своём составе три кислотных радикала с неразветвлённой структурой и, обычно, чётное число атомов углерода.
Углеводы – органические вещества, которые содержат содержащими неразветвленную цепь из нескольких атомов углерода, карбоксильную группу и несколько гидроксильных групп.
Амины содержат в своём составе аминогруппу – NH2
Аминокислоты – органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы.
Белки – высокомолекулярные органические вещества, которые состоят состоящие из альфа – аминокислот, соединённых в цепочку пептидной связью.
Нуклеиновые кислоты – высокомолекулярные органические соединения, биополимеры, образованные остатками нуклеотидов.
