
- •Классификация аминокислот.
- •4. Простые и сложные белки, их классификация. Характер связей простетических групп с белком. Биологические функции белков. Способность к специфическим взаимодействиям с лигандом.
- •5. Углеводсодержащие белки: гликопротеины, протеогликаны. Основные углеводы организма человека: моносахариды, дисахариды, гликоген, гетерополисахариды, их структура и функции.
- •8. Хромопротеины, их классификация. Флавопротеины, их структура и функции. Гемопротеины, структура, представители: гемоглобин, миоглобин, каталаза, пероксидаза, цитохромы. Функции гемопротеинов.
- •13. Энзимопатия у детей и важность их биохимической диагностики (на примере нарушения азотистого и углеводного обмена).
- •14. Витамины, классификация витаминов (по растворимость и функциональная). История открытия и изучения витаминов.
- •15. Витамин а, структура, участие в обменных процессах. Гипо- гипер- и авитаминоз а, их причины и особенности проявления. Пищевые источники, суточная потребность.
- •17. Витамин рр, структура коферментов, участие в обменных процессах. Гипо - и авитаминоз рр. Пищевые источники, суточная потребность.
- •18. Витамин в2, структура коферментов, участие в обменных процессах. Гиповитаминоз и авитаминоз в2. Суточная потребность, пищевые источники.
- •19. Витамин с, структура, участие в обменных процессах. Гипо- и авитаминоз с. Пищевые источники, суточная потребность.
- •20. Витамин в1, структура кофермента, участие в обменных процессах. Гиповитаминоз и авитаминоз в1. Пищевые источники, суточная потребность.
- •21. Витамин в6, структура кофермента, участие в обменных процессах. Гиповитаминоз и авитаминоз в6. Пищевые источники, суточная потребность.
- •22. Пантотеновая кислота и биотин, их участие в обменных процессах. Гиповитаминозы и авитаминозы в3 и н. Суточная потребность, источник этих витаминов.
- •23. Фолиевая кислота и кобаламин, их участие в обменных процессах, авитаминозы. Пищевые источники, суточная потребность.
- •24. Витамин е и к, участие их в обменных процессах. Гиповитаминозы и авитаминозы этих витаминов. Пищевые источники, суточная потребность.
- •25. Возрастные потребности в отдельных витаминах у ребенка. Особенности проявления гипо- и авитаминозов в раннем детском возрасте.
- •27. Гормоны гипоталамуса – либерины и статины. Химическая природа. Механизм их действия на молекулярном уровне, биологический эффект.
- •29. Гормоны задней доли гипофиза: вазопрессин, окситоцин. Химическая природа. Механизм их действия, биологический эффект. Нарушения функций организма, связанные с недостатком выработки этих гормонов.
- •32. Паратгормон и кальцитонин. Химическая природа. Механизм действия на молекулярном уровне. Влияние на обмен кальция, гиперкальциемия и гипокальциемия.
- •35. Половые гормоны: андрогены, эстрогены. Химическая природа. Механизм действия на молекулярном уровне, влияние на обмен веществ. Нарушения обмена при недостатке и избытке этих гормонов в организме.
- •45. Свободно-радикальное окисление. Токсичность кислорода: образование активных форм кислорода, их действие на липиды и другие вещества клетки. Механизм защиты: антиоксидантные системы
- •Регуляция глюконеогенеза происходит с участием гормонов и с участием метаболитов.
- •60. Лабильность уровня глюкозы в крови у детей раннего возраста. Наклонность к гипогликемии. Своеобразие учета результатов нагрузной пробой сахара у детей.
- •62. Особенности переваривания и всасывания жиров в организме ребенка.
- •72. Повышенная активность биосинтеза и распада нейтральных жиров в тканях ребенка. Бурый жир, его значение.
- •73. Неустойчивость липидного обмена, связанная с недостаточно сформированной нейроэндокринной регуляцией. Кетонемия и ацетонемия у детей. Факторы, способствующие их развитию.
- •Гормональная регуляция синтеза и мобилизации жиров.
- •75. Патология обмена холестерина у детей. Наследственные нарушения липидного обмена: семейная гиперхолестеринемия и семейная триглицеридемия.
- •76. Обмен аминокислот и белков в питании ребенка. Понятие об азотистом балансе. Физиологическая азотемия новорожденных.
- •79. Замедленное переваривание белков в желудке у детей. Особенности исследования функции желудка в детском возрасте.
- •84. Обмен фенилаланина и тирозина. Образование катехоламинов, гормонов щитовидной железы, меланина. Нарушения процессов распада тирозина: фенилкетонурия, алкаптонурия, альбинизм.
- •85. Лабильность дезаминирования в гепатоцитах ребенка. Повышенная концентрация аминокислот в крови и моче ребенка раннего возраста. Своеобразие обмена некоторых аминокислот. Фенилаланин, тирозин.
- •88. Пути обезвреживания аммиака в организме ребенка. Преобладание у детей раннего возраста урикотелического пути обмена аммиака. Причины нарастания аммиака крови.
- •89. Биосинтез пиримидиновых нуклеотидов, этапы этого процесса. Оротацидурия. Распад пиримидиновых нуклеотидов. Биосинтез дезоксирибонуклеотидов. Участие утф и цтф в обменных процессах.
- •91. Обмен нуклеиновых кислот и нуклеотидов у ребенка. Генетические нарушения, связанные с наследственными заболеваниями.
- •92. Биосинтез днк (репликация): стехиометрия реакций, днк-полимераза, матрица. Повреждение и распад днк.
- •Этапы биосинтеза днк.
- •93. Биосинтез рнк (транскрипция): рнк-полимераза, стехиометрия реакции, днк как матрица. Регуляция транскрипции. Посттранскрипционная достройка рнк. Молекулярные мутации. Наследственные болезни.
- •96. Распад гема. Билирубин как продукт распада гема. Метаболизм билирубина. Нарушение его обмена. Желтухи и их биологическая диагностика.
- •97. Физиологическая желтуха новорожденных, ее причины.
- •98. Обмен гемоглобина у детей. Типы и виды гемоглобина. Его возрастная эволюция. Возрастные особенности 2,3-дфг эритроцита. Гемоглобинопатии.
- •101.Возрастные колебания общего белка крови и его фракции. Наличие фетальных белков в крови. Иммуноглобулины. Неспецифические факторы защиты.
- •103.Возрастные особенности содержание и распределения воды в организме ребенка. Лябильность водного обмена. Физиологическая потеря жидкости новорожденными.
- •106.Важность минеральных солей для обменных процессов у детей (пластическая и регуляторная роль). Значение прикорма ребенка для уменьшения дефицита минеральных солей.
- •110. Мукополисахаридоз у детей – наследственная лизосомальная болезнь накопления.
- •113.Роль креатинфосфата в мышечном сокращении у ребенка. Физиологическая креатинурия. Врожденные энзимопатии (фосфорилаза и фосфоглюкомутаза), приводящие к патологии мышечной системы.
- •114.Биохимия мышечной ткани у детей.
- •118.Своеобразие химического состава и метаболических процессов мозга плода и у ребенка раннего возраста.
- •120.Важность определения функционального состояния печени в детском возрасте.
- •121.Возрастные особенности процессов гниения в желудочно-кишечном тракте ребенка.
- •123.Характеристика периода новорожденности и его биохимические аспекты. Биохимические сдвиги новорожденного впервые часы постнатального периода.
- •124.Своеобразие метаболизма ребенка и его регуляция в различные возрастные периоды. Биохимические критерии, характеризующие отдельные возрастные этапы.
- •126.Особенности обмена веществ у ребенка раннего возраста. Несовершенство высших форм регуляции. Своеобразие гормональной регуляции.
- •127.Изменения ферментативных систем в ходе индивидуального развития организма как проявление биохимической адаптации. Срочная и замедленная адаптация.
32. Паратгормон и кальцитонин. Химическая природа. Механизм действия на молекулярном уровне. Влияние на обмен кальция, гиперкальциемия и гипокальциемия.
К гормонам белковой природы относится также паратиреоидный гормон (паратгормон). Они синтезируются паращитовидными железами. Молекула паратгормона быка содержит 84 аминокислотных остатка и состоит из одной полипептидной цепи. Выяснено, что паратгормон участвует в регуляции концентрации катионов кальция и связанных с ними анионов фосфорной кислоты в крови. Биологически активной формой считается ионизированный кальций, концентрация его колеблется в пределах 1,1–1,3 ммоль/л. Ионы кальция оказались эссенциальными факторами, не заменимыми другими катионами для ряда жизненно важных физиологических процессов: мышечное сокращение, нервно-мышечное возбуждение, свертывание крови, проницаемость клеточных мембран, активность ряда ферментов и т.д. Поэтому любые изменения этих процессов, обусловленные длительным недостатком кальция в пище или нарушением его всасывания в кишечнике, приводят к усилению синтеза паратгормона, который способствует вымыванию солей кальция (в виде цитратов и фосфатов) из костной ткани и соответственно к деструкции минеральных и органических компонентов костей. Другой орган-мишень паратгормона – это почка. Паратгормон уменьшает реабсорбцию фосфата в дистальных канальцах почки и повышает канальцевую реабсорбцию кальция. В особых клетках – так называемых парафолликулярных клетках, или С-клетках щитовидной железы, синтезируется гормон пептидной природы, обеспечивающий постоянную концентрацию кальция в крови - кальцитонин. Формула:
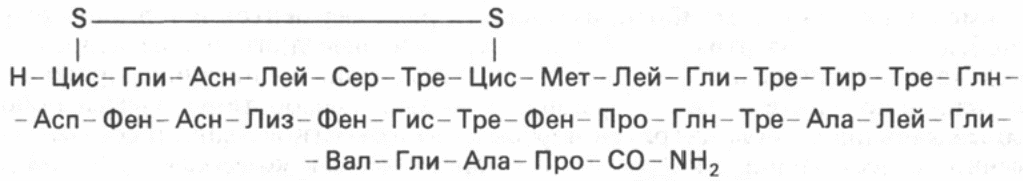
Кальцитонин содержит дисульфидный мостик (между 1-м и 7-м аминокислотными остатками) и характеризуется N-концевым цистеином и С-концевым пролинамидом. Биологическое действие кальцитонина прямо противоположно эффекту паратгормона: он вызывает подавление в костной ткани резорбтивных процессов и соответственно гипокальциемию и гипофосфатемию. Таким образом, постоянство уровня кальция в крови человека и животных обеспечивается главным образом паратгормоном, кальцитриолом и кальцитонином, т.е. гормонами как щитовидной и паращитовидных желез, так и гормоном – производным витамина D3. Это следует учитывать при хирургических лечебных манипуляциях на данных железах.
33. Гормоны мозгового слоя надпочечников – катехоламины: адреналин и норадреналин. Химическая природа и биосинтез. Механизм действия гормонов на молекулярном уровне, их роль в регуляции обмена углеводов, жиров и аминокислот. Нарушения обмена при заболеваниях надпочечников.
Эти гормоны по строению напоминают аминокислоту тирозин, от которого они отличаются наличием дополнительных ОН-групп в кольце и у β-углеродного атома боковой цепи и отсутствием карбоксильной группы.
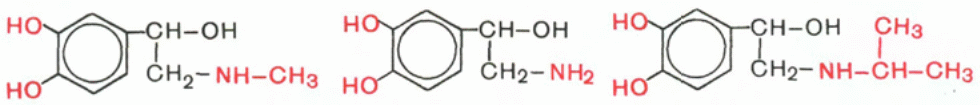
Адреналин Норадреналин Изопропиладреналин
В мозговом веществе надпочечников человека массой 10 г содержится около 5 мг адреналина и 0,5 мг норадреналина. Содержание их в крови составляет соответственно 1,9 и 5,2 нмоль/л. В плазме крови оба гормона присутствуют как в свободном, так и в связанном, в частности, с альбуминами состоянии. Небольшие количества обоих гормонов откладываются в виде соли с АТФ в нервных окончаниях, освобождаясь в ответ на ихраздражение. Кроме того, все они оказывают мощное сосудосуживающее действие, вызывая повышение артериального давления, и в этом отношении действие их сходно с действием симпатической нервной системы. Известно мощное регулирующее влияние этихгормонов на обмен углеводов в организме. Так, в частности, адреналин вызывает резкое повышение уровня глюкозы в крови, что обусловлено ускорением распада гликогена в печени под действием фермента фосфорилазы. Гипергликемическйй эффект норадреналина значительно ниже – примерно 5% от действия адреналина. Параллельно отмечаются накопление гексозофосфатов в тканях, в частности в мышцах, уменьшение концентрации неорганического фосфата и повышение уровня ненасыщенных жирных кислот в плазме крови. Имеются данные о торможении окисления глюкозы в тканях под влиянием адреналина. Это действие некоторые авторы связывают с уменьшением скорости проникновения (транспорта) глюкозы внутрь клетки. Известно, что и адреналин, и норадреналин быстро разрушаются в организме; с мочой выделяются неактивные продукты их обмена, главным образом в виде 3-метокси-4-оксиминдальной кислоты, оксоадренохрома, метоксинорадреналина и метоксиадреналина. Эти метаболиты содержатся в моче преимущественно в связанной с глюкуроновой кислотой форме. Ферменты, катализирующие указанные превращения катехоламинов, выделены из многих тканей и достаточно хорошо изучены, в частности моноаминоксидаза (МАО), определяющая скорость биосинтеза и распада катехоламинов, и катехолметилтрансфераза, катализирующая главный путь превращения адреналина, т.е. о-метилирование за счет S-аденозилметионина. Приводим структуру двух конечных продуктов распада
34. Глюкагон и инсулин. Химическая природа, биосинтез инсулина. Механизм действия этих гормонов на молекулярном уровне. Их роль в регуляции обмена углеводов, жиров, аминокислот. Биохимические нарушения при сахарном диабете.
И нсулин,
получивший свое название от наименования
панкреатических островков. Молекула
инсулина, содержащая 51 аминокислотный
остаток, состоит из двух полипептидных
цепей, соединенных между собой в двух
точках дисульфидными мостиками. В
физиологической регуляции синтеза
инсулина доминирующую роль играет
концентрация глюкозы в крови. Так,
повышение содержания глюкозы в крови
вызывает увеличение секреции инсулина
в панкреатических островках, а снижение
ее содержания, наоборот,– замедление
секреции инсулина. Этот феномен контроля
по типу обратной связи рассматривается
как один из важнейших механизмов
регуляции содержания глюкозы в крови.
При недостаточной секреции инсулина
развивается специфическое заболевание
– сахарный
диабет. Физиологические
эффекты инсулина: Инсулин —
единственный гормон, снижающий
содержание глюкозы в крови, это реализуется
через:
нсулин,
получивший свое название от наименования
панкреатических островков. Молекула
инсулина, содержащая 51 аминокислотный
остаток, состоит из двух полипептидных
цепей, соединенных между собой в двух
точках дисульфидными мостиками. В
физиологической регуляции синтеза
инсулина доминирующую роль играет
концентрация глюкозы в крови. Так,
повышение содержания глюкозы в крови
вызывает увеличение секреции инсулина
в панкреатических островках, а снижение
ее содержания, наоборот,– замедление
секреции инсулина. Этот феномен контроля
по типу обратной связи рассматривается
как один из важнейших механизмов
регуляции содержания глюкозы в крови.
При недостаточной секреции инсулина
развивается специфическое заболевание
– сахарный
диабет. Физиологические
эффекты инсулина: Инсулин —
единственный гормон, снижающий
содержание глюкозы в крови, это реализуется
через:
усиление поглощения клетками глюкозы и других веществ;
активацию ключевых ферментов гликолиза;
увеличение интенсивности синтеза гликогена — инсулин форсирует запасание глюкозы клетками печени и мышц путём полимеризации её в гликоген;
уменьшение интенсивности глюконеогенеза — снижается образование в печени глюкозы из различных веществ
Анаболические эффекты
усиливает поглощение клетками аминокислот (особенно лейцина и валина);
усиливает транспорт в клетку ионов калия, а также магния и фосфата;
усиливает репликацию ДНК и биосинтез белка;
усиливает синтез жирных кислот и последующую их этерификацию — в жировой ткани и в печени инсулин способствует превращению глюкозы в триглицериды; при недостатке инсулина происходит обратное — мобилизация жиров.
Антикатаболические эффекты
подавляет гидролиз белков — уменьшает деградацию белков;
уменьшает липолиз — снижает поступление жирных кислот в кровь.
Глюкагон — гормон альфа-клеток островков Лангерганса поджелудочной железы. По химическому строению глюкагон является пептидным гормоном. Молекула глюкагона состоит из 29 аминокислот и имеет молекулярный вес 3485. Первичная структура молекулы глюкагона следующая:
NH2-His-Ser-Gln-Gly-Thr-Phe- Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser- Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu- Met-Asn-Thr-COOH
Механизм действия глюкагона обусловлен его связыванием со специфическими глюкагоновыми рецепторами клеток печени. Это приводит к повышению опосредованной G-белком активности аденилатциклазы и увеличению образования цАМФ. Результатом является усиление катаболизма депонированного в печени гликогена. Глюкагон оказывает сильное инотропное и хронотропное действие на миокард вследствие увеличения образования. Результатом является повышение артериального давления, увеличение частоты и силы сердечных сокращений
