
- •50 50 50 Электролиз расплавов и водных растворов"солей. Закон Фарадея,применение
- •52 52 52 Химическое равцовесие в гетерогенных системах. Адсорбция. Уравнение Гиббса. Поверхностно-активные вещества.
- •53 53 53 Гетерогенные дисперсные системы (суспензии, эмулъсии
- •54 54 54 Коллоидные растворы (золи). Механизм образования мицеллы при взаимодействии электролитов в водной среде. Строение мицеллы. Устойчивость и коагуляция золей.
- •55 55 55 Основные классы неорганических соединений: оксиды, основания,
- •56 56 56 Комплексные соединения, их структура (комплексообразователъ, лиганды, внешняя сфера, внутренняя сфера, координационное число).
- •58 58 58 Квантово-механическая модель атома. Принцип неопределенности
- •60 60 60 Строение атомных ядер. Изотопьi.
- •61 61 61Периодический закон Менделеева. Периодическая таблица (периоды и группы).
- •62 62 62 Потенциал ионизации, сродство к электрону, электроотрицательнссть
- •63 63 63 ОбраЗование коваленТной химической связи (метод в€ijIентных связей).
- •64 64 64 Обменнъiй механизм образования ковалентной связи (сигма-связь,пи-связь).
- •65 65 65 Щонорно-акцепторная связь. Механизм образования коваJIентной связи.
- •66 66 66 Направпенность ковалентной связи. Концепц ия rибридизации атомных
- •67 67 67 Ионная связь, метаJIлическая связь, водородная связь.
- •68 68 68 Межмолекулярные взаимодействия (дисперсионное, ориентационЕое,
- •69 69 69 S-элементы группы 1а. Их общая характеристика.
- •72 72 72 Оксиды и гидроксиды s-элементов, их получение, свойства, применение.
62 62 62 Потенциал ионизации, сродство к электрону, электроотрицательнссть
элементов; характер измеЕения по группам и периодам Периодической
системы элементов.
Энергия ионизации Е1 – минимальная энергия, которую требуется затратить на то, чтобы удалить данный электрон с атомной орбитали невозбужденного атома на бесконечно большое расстояние от ядра без сообщения ему кинетической энергии. Энергия ионизации соответствует следующему процессу: Э + ЕI → Э+ + е, где ЕI - кДж / моль. Энергия ионизации количественно характеризует способность атома удерживать электроны, что является важной характеристикой его химической активности. Энергии ионизации возрастает в периоде по мере увеличения порядкового номера элемента. Наименьшее ее значение имеют щелочные металлы, находящиеся в начале периода. Наибольшее значение энергии ионизации характерно для инертных газов, находящихся в конце периода.
В группе элементов энергия ионизации уменьшается с повышением порядкового номера элемента. Это обусловлено увеличением размеров атомов и экранированием внешних электронов внутренними.
Сродство к электрону атома ЕА – энергия, которая выделяется (или затрачивается) при присоединении к нейтральному атому электрона с образованием отрицательного иона: Э + е → Э- + ЕА где ЕА - кДж / моль. Сродство к электрону считают положительным, если присоединение электрона сопровождается выделением энергии (ЕА> 0). Если для присоединения электрона нужно затратить энергию, то сродство к электрону считается отрицательным (ЕА<0). Сродство к электрону зависит от электронной структуры атома. Наибольшим сродством к электрону обладают элементы подгрупп 7А (галогены) у большинства металлов и благородных газов сродство к электрону невелико или даже отрицательно. Наименьшее значение сродства к электрону у атомов с заполненными и наполовину заполненными s и р-подуровнями. В подгруппах сверху вниз сродство к электрону атомов уменьшается, но не всегда монотонно. Вследствие экспериментальных трудностей значение сродства к электрону известны не для всех атомов.
Понятие электроотрицательности элементов ввел американский физикохимик Полинг. По определению Полинга электроотрицательность – это способность атома в молекуле или сложном ионе притягивать к себе электроны, участвующие в образовании химической связи. Электроотрицательность зависит от типа соединений, валентного состояния элемента. Поэтому такая характеристика имеет условный характер. Однако ее использование полезно для качественного объяснения типа химических связей и свойств соединений. В периоде электроотрицательность возрастает с увеличением порядкового номера элемента (слева направо), а в группе, как правило, убывает по мере увеличения заряда ядра (сверху вниз). Таким образом , наименьшее значение электроотрицательности имеют s-элементы 1 группы, а наибольшее р-элементы 6 и 7 групп.
63 63 63 ОбраЗование коваленТной химической связи (метод в€ijIентных связей).
Ковалентная связь – тип химической связи между атомами, возникающей при обобществлении электронов, которые принадлежат этим атомам.
Типы связей:
Одинарная 1
- , двойная 1+1
=, тройная 1+2
![]()
Энергия связи – энергия, которую надо затратить, чтобы разорвать химическую связь. Тоже количество энергии выделяется при образовании химической связи. С увеличением кратности связи, энергия увеличивается. Энергия -связи меньше энергии -связи.
Ковалентная связь может быть:
1 полярной (если атомы различаются по электроотрицательности, то электронная пара будет смещаться к атому с большей электроотрицательностью)

2 неполярной (между атомами 1-го типа, с одинаковой
электроотрицательностью) Н − Н
Мерой полярности
служит дипольный момент:![]() ,
где
,
где
![]() −заряд
электрона,
−расстояние
между центрами заряда.
−заряд
электрона,
−расстояние
между центрами заряда.
С увеличением электроотрицательности одного из атомов полярность молекулы увеличивается. Процесс смещения электронной пары к наиболее электроотрицательному атому называется поляризацией.
Поляризуемость – динамическая поляризация, способность молекулы изменять свою полярность под действием внешнего электрического поля. Поляризуемость уменьшается с уменьшением размера атома:
![]() −
−![]() >
−
>
−![]() >
−
>
−![]() >
−
>
−![]()
. Метод валентных связей (- и -связи), метод молекулярных орбиталей, гибридизация атомных орбиталей.
Для объяснения ковалентной связи используют 2 метода квантово-механического расчета:
1.метод валентных связей (МВС)
2.метод молекулярных орбиталей (ММО)
Согласно методу
валентных связей
ковалентная связь образуется не путем
передачи, а путем обобществления
неспаренных электронов с антипараллельными
спинами по 1-му от каждого атома.
Образовавшаяся в этом случае электронная
пара принадлежит обоим атомам.
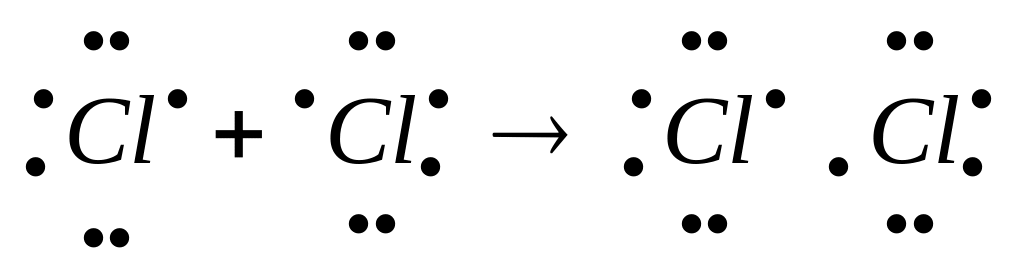 Сl
– Cl
– обозначение ковалентной связи.
Сl
– Cl
– обозначение ковалентной связи.
Чем в большей степени перекрываются атомные орбитали, тем прочнее связь.
Перекрывание атомных орбиталей возможно лишь при их определенной взаимной ориентации в пространстве.
Ковалентная связь в отличие от ионной имеет направленность.
Атомные орбитали могут перекрываться двумя способами:
1-ый способ: перекрывание в направлении главных осей (осей, связывающих ядра).

Образовавшаяся при этом перекрывании ковалентная связь называется -сигма связь.
2-ой способ: P-орбитали с параллельными осями.
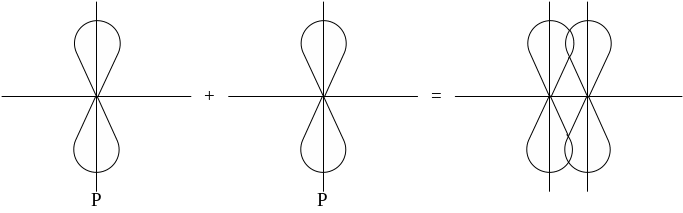
Боковое перекрывание образует -связь, менее прочную связь чем - сигма. В соответствии с правилом Паули между двумя атомами может быть либо 1-сигма связь, либо 1-сигма и 1-связь, либо 1-сигма и 2-связи.
