
- •1. История развития поршневых двигателей и требования к ним.
- •2. Общее устройство и принцип работы поршневого двигателя внутреннего сгорания.
- •Основные понятия и определения.
- •4. Классификация двигателей.
- •5. Термодинамический процесс. Рабочее тело и параметры его состояния
- •6. Законы идеальных газов
- •7. Уравнение состояния идеальных газов
- •8. Первый закон термодинамики
- •9. Внутренняя энергия рабочего тела
- •10. Обратимые и необратимые термодинамические процессы
- •11. Изохорный процесс
- •12. Изобарный процесс
- •13. Изотермический процесс
- •14. Адиабатный процесс
- •15. Политропный процесс
- •16. Второй закон термодинамики, его физическая основа
- •17. Цикл теплового двигателя
- •18. Цикл Карно
- •19. Принцип работы двс
- •20. Цикл с подводом теплоты при постоянном объеме
13. Изотермический процесс
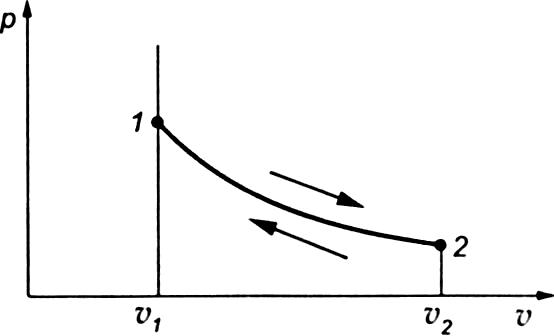 Изотермическим
процессом называется процесс, протекающий
при постоянной температуре: Т= const.
Изотермическим
процессом называется процесс, протекающий
при постоянной температуре: Т= const.
Поскольку в изотермическом процессе Т = const, то уравнение состояния газа pv = RT= const.
В изотермическом процессе в соответствии с законом Бойля—Мариотта справедливо следующее соотношение:
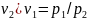 (1.11)
(1.11)
или
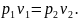
Соотношение (1.11) показывает, что в изотермическом процессе объемы при различных состояниях газа обратно пропорциональны давлениям, соответствующим этим состояниям.
При вычислении внутренней энергии, используя общую формулу (1.6), получим
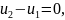
Следовательно, в изотермическом процессе изменение внутренней остается постоянной.
Удельная работа изменения объема в изотермическом процессе определяется уравнением

или
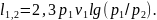 (1.12)
(1.12)
На основании первого закона термодинамики

а так как u2 - u1 = 0, то
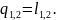
Таким образом, в изотермическом процессе расширения вся подведенная теплота расходуется на внешнюю работу, а при изотермическом процессе сжатия внешняя работа полностью превращается в теплоту.
14. Адиабатный процесс
Адиабатным процессом называют процесс, протекающий без подвода и отвода теплоты:
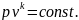 (1.13)
(1.13)
 где
k
— показатель адиабаты — величина,
равная отношению удельной изобарной
теплоемкости к удельной изохорной
теплоемкости:
где
k
— показатель адиабаты — величина,
равная отношению удельной изобарной
теплоемкости к удельной изохорной
теплоемкости:
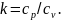
Для идеальных газов k есть величина постоянная, зависящая от природы газа, т. е. от числа атомов в молекуле газа.
Протекание адиабатного процесса без теплообмена с окружающей средой может осуществляться в цилиндре, который имеет идеально теплоизолированные стенки. Однако в природе не существует такой изоляции. Поэтому адиабатный процесс есть идеальный процесс и на практике осуществить его невозможно. Реально можно получить процесс с некоторым приближением к идеальному адиабатному процессу. Например, если процессы протекают очень быстро, т. е. в такое короткое время, что газ не успевает принять или передать теплоту стенкам цилиндра.
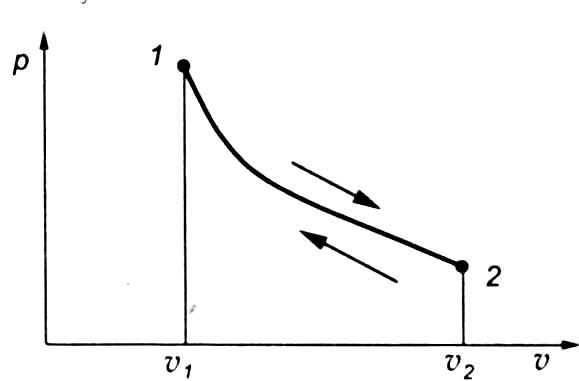
Кривая адиабатного процесса называется адиабатой. Она представляет собой неравнобокую гиперболу.
Зависимость между давлением и объемом для двух точек адиабатного процесса имеет вид
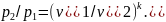 (1.14)
(1.14)
Для начального и конечного состояний газа в адиабатном процессе
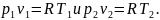
Разделив почленно второе уравнение на первое, получим

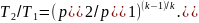 (1.16)
(1.16)
Изменение внутренней энергии определяется формулой
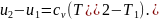
На основании первого закона термодинамики
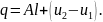
Так как процесс адиабатный, то
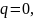
следовательно,

откуда
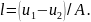
Учитывая, что А — величина постоянная, можно сделать вывод о том, что удельная работа в адиабатном процессе получается только за счет изменения внутренней энергии рабочего тела.
15. Политропный процесс
Политропным процессом называют процесс, в котором могут изменяться одновременно все параметры газа (р, v, Т), и между газом и окружающей средой осуществляется теплообмен.
Процессы в тепловых машинах, как правило, являются политропными.
Уравнение политропного процесса:
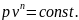 (1.17)
(1.17)
где n — показатель политропы.
Если выразить теплоемкость газа в политропном процессе через cn, то показатель n будет иметь вид
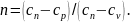
Учитывая, что ср/сv = k, получим
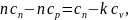
откуда
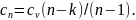
Количество теплоты определяется из уравнения первого закона термодинамики
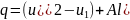
или из уравнения (3):
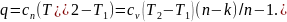 (1.18)
(1.18)
Уравнение политропного процесса является общим для всех основных рассматриваемых процессов. Так уравнения изохорного, изобарного, изотермического и адиабатного процессов можно получить из уравнения политропного процесса, если показателю политропы n давать соответствующие значения. Например, если n = ±∞, то уравнение (1.17) примет вид v = const, что соответствует изохорному процессу, если п = 0, то vn = v0 = 1, и уравнение (1.17) примет вид р = const, что соответствует изобарному процессу, если п = 1, то уравнение политропного процесса преобразуется в уравнение адиабатного процесса pvk = const. Таким образом:
для изохорного процесса n = ±∞,
для изобарного процесса п = 0,
для изотермического процесса п = 1,
для адиабатного процесса п = k.
