
- •1. История развития поршневых двигателей и требования к ним.
- •2. Общее устройство и принцип работы поршневого двигателя внутреннего сгорания.
- •Основные понятия и определения.
- •4. Классификация двигателей.
- •5. Термодинамический процесс. Рабочее тело и параметры его состояния
- •6. Законы идеальных газов
- •7. Уравнение состояния идеальных газов
- •8. Первый закон термодинамики
- •9. Внутренняя энергия рабочего тела
- •10. Обратимые и необратимые термодинамические процессы
- •11. Изохорный процесс
- •12. Изобарный процесс
- •13. Изотермический процесс
- •14. Адиабатный процесс
- •15. Политропный процесс
- •16. Второй закон термодинамики, его физическая основа
- •17. Цикл теплового двигателя
- •18. Цикл Карно
- •19. Принцип работы двс
- •20. Цикл с подводом теплоты при постоянном объеме
10. Обратимые и необратимые термодинамические процессы
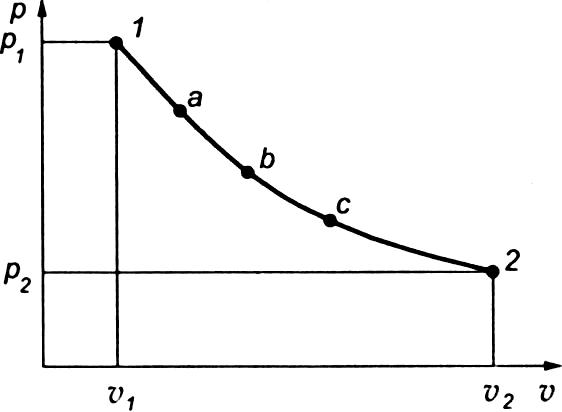
Термодинамическим процессом называется последовательное изменение состояния рабочего тела, при котором параметры его состояния (все или некоторые) изменяются, а масса рабочего тела, совершающего процесс, остается неизменной.
 По
координатам р
и v
можно определить состояние рабочего
тела.
По
координатам р
и v
можно определить состояние рабочего
тела.
Если тело перешло из состояния 1 в состояние 2 через ряд состояний а, b, с и др., то это означает, что тело совершило термодинамический процесс.
Работа не является только функцией состояния газа, так как она зависит и от характера процесса.
На
рис. показаны два различных процесса
перехода газа из состояния 1
в состояние 2.
Работы 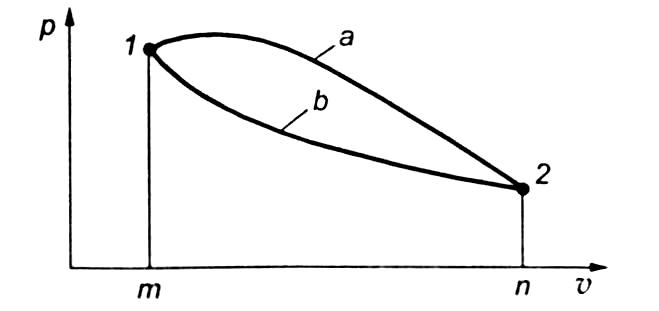 этих
процессов не равны при одинаковых
начальных и конечных состояниях газа:
L1
= sm1а2п
> L2
= sm1b2n
(s
— площадь).
этих
процессов не равны при одинаковых
начальных и конечных состояниях газа:
L1
= sm1а2п
> L2
= sm1b2n
(s
— площадь).
.В тепловом двигателе работа расширения всегда больше работы, затраченной на сжатие. Полученная таким образом разность работ (согласно первому закону термодинамики эквивалентна применяемой в двигателе теплоте) используется для различных целей.
Обратимыми называются процессы, в результате совершения которых в прямом и обратном направлениях термодинамическая система возвращается в исходное состояние.
В случае обратимых процессов обратный процесс представляет собой «зеркальное отображение» прямого процесса: если, например, в прямом процессе к системе подводится какое-то количество теплоты, то в обратном процессе от системы отводится точно такое же количество теплоты.
Необратимым называется процесс, при котором система не возвращается в исходное состояние.
Все естественные самопроизвольные процессы необратимы. Обратимых процессов в природе не существует. Типичным примером необратимого процесса является процесс трения. Работа, затраченная на преодоление трения, превращается в теплоту.
Рабочее тело может произвести работу только при переходе из неравновесного состояния в равновесное.
11. Изохорный процесс
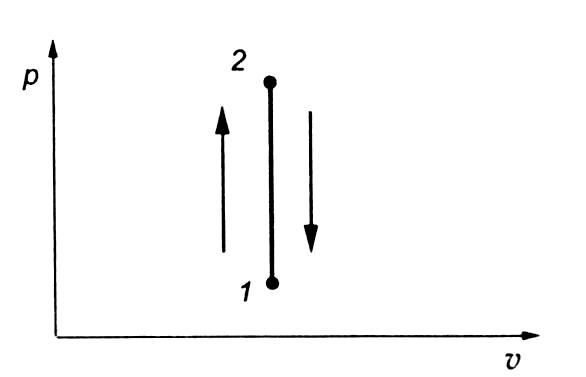 Изохорными
называются процессы, протекающие при
постоянном объеме.
К таким процессам относятся нагревание
или охлаждение газа в сосуде постоянного
объема: v
= const
Изохорными
называются процессы, протекающие при
постоянном объеме.
К таким процессам относятся нагревание
или охлаждение газа в сосуде постоянного
объема: v
= const
Переход газа из состояния 1 в состояние 2 сопровождается нагреванием газа, а переход из состояния 2 в состояние 1 — охлаждением. Направление процесса определяется по изменению давления: при нагревании газа давление растет, а при охлаждении — падает.
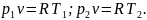
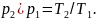
Выражение показывает, что в изохорном процессе давление газа прямо пропорционально абсолютной температуре.
Изменение удельной внутренней энергии:
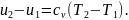 (1.6)
(1.6)
В процессе при постоянном объеме внешняя работа не совершается, т. е. удельная работа изменения равна нулю:
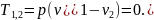
Тогда внешняя теплота равна изменению внутренней энергии, так как q1,2 = ∆u + Al1,2, но так как l1,2 = 0, то q1,2 = u2 - u1, или

Таким образом, в изохорном процессе вся подведенная теплота идет на увеличение внутренней энергии газа.
12. Изобарный процесс
 Изобарными
процессами называются процессы,
протекающие при постоянном давлении:
р = const.
Изобарными
процессами называются процессы,
протекающие при постоянном давлении:
р = const.
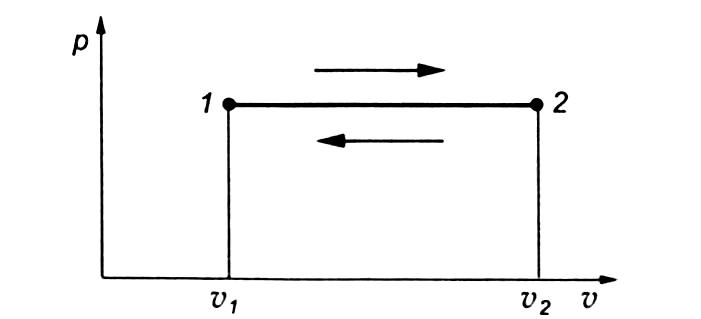
Процесс расширения газа на диаграмме соответствует переходу из состояния 1 в состояние 2, а процесс сжатия — переходу из состояния 2 в состояние 1.
Для определения соотношения параметров напишем уравнение начального и конечного состояний газа при р = const:

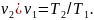 (1.7)
(1.7)
Выражение (1.7) показывает, что в изобарном процессе объемы газа пропорциональны абсолютным температурам.
Изменение внутренней энергии:
Удельная работа газа в этом случае будет равна площади прямоугольника, основанием которого служит отрезок абсциссы v2—v1, а высотой — отрезок ординаты р:
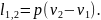 (1.8)
(1.8)
Уравнение работы изменения объема идеального газа в изобарном процессе можно представить и в другом виде:
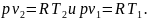
Вычитая второе уравнение из первого, получим
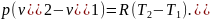 (1.9)
(1.9)
Из уравнений (1.8) и (1.9) получим
 (1.10)
(1.10)
Теплота, которая сообщается газу в изобарном процессе, на основании первого закона термодинамики может быть найдена по формуле

или по общей формуле

